応用化学系 News
マウス体内の血液で触媒を作り、がんに運んで化学治療
体内創薬化学研究所確立への第一歩に
概要
東京工業大学 物質理工学院 応用化学系の田中克典教授(理化学研究所(理研)開拓研究本部 田中生体機能合成化学研究室 主任研究員、応用化学系ライフエンジニアリングコース 主担当)、今井恭祐大学院生(博士後期課程1年)、チャン・ツンチェ特任助教(研究当時、現 理研研究員)、同 科学技術創成研究院の六車共平助教(理研基礎科学特別研究員(研究当時))らの研究チームは、マウスに遷移金属触媒[用語1]や試薬を順に静脈投与することによって、(1)血液中のタンパク質(アルブミン)から遷移金属触媒複合体(人工金属酵素)を体内で作り、その触媒活性を利用して(2)がんに人工金属酵素を送り込むとともに、(3)抗がん活性分子を生体内合成し、副作用を抑えたがん治療を行うことに成功しました。
本研究成果は、金属触媒反応によって、マウスの静脈中に元々存在するタンパク質を原料として人工金属酵素を合成し、さらにその人工金属酵素による二度の金属触媒反応をがん治療に利用した世界初の例であり、生体内のタンパク質、さらには体内のあらゆる物質を原料とするがんの化学療法の開発に大きな貢献をもたらすと期待できます。今回の生体内での二度の金属触媒反応を巧みに利用する治療法は非常に革新的であり、この成果によって、田中教授らの目指す、体内の現地で、体内の分子を有効に利用しながら薬剤や生物活性分子を直接合成して治療を行う生体内合成化学治療[用語2]を用いた、「体内創薬化学研究所[用語2]」の確立に大きく近づきました。
がんの化学療法においては正常組織への副作用が長年の課題です。その解決策の一つとして、遷移金属触媒を使ってがんのある場所でさまざまな抗がん活性物質を合成し、がんを治療する生体内合成化学治療が田中教授らを中心に世界中で研究されています。しかし、これまでは反応容器内で合成・精製した人工金属酵素を体内に投与するのが一般的でした。
今回、研究チームは、遷移金属触媒とcRGD(環状アルギニンーグリシンーアスパラギン酸)ペプチド[用語3]を静脈投与することで、血液中に存在するアルブミンから、人工金属酵素を作りました。この人工金属酵素は、自らの金属触媒活性で表面に搭載したcRGDペプチドの効果によりがんに選択的に移行するとともに、がんでもう一度金属触媒活性を発揮して抗がん活性分子を合成し、副作用なくがんを治療することができました。
本研究は、科学雑誌『Angewandte Chemie International Edition』オンライン版(7月11日付)に掲載されました。
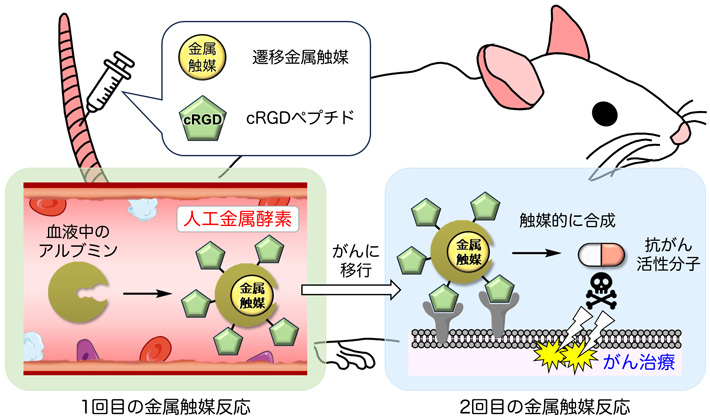
血液中のアルブミンを用いた人工金属酵素の合成とがん選択的な治療の概略図
背景
抗がん剤はがんを治療することができますが、その毒性から正常細胞にも影響を及ぼしてしまうため副作用が大きな問題になります。正常細胞への影響を減らす方法として、毒性を持たない前駆体(プロドラッグ)をがん細胞だけで毒性を発揮する抗がん剤へと変換する方法が盛んに研究されています。
田中教授らは、金やルテニウム(Ru)などの遷移金属触媒の反応を体内で活用した生体内合成化学治療を開発し、副作用のないがん治療において世界をリードしてきました。通常、遷移金属触媒は生体内では触媒毒によってすぐに活性を失ってしまいますが、アルブミンの疎水性ポケットに遷移金属触媒を導入することによって触媒が保護され、薬剤を体内で合成することができます※1-3。しかし、これまでの研究では、あらかじめ反応容器で合成・精製した遷移金属触媒複合体(人工金属酵素)を体内に投与して治療を行ってきました。
そこで本研究では、アルブミンを「体内で有効利用できる人工金属酵素の原料」として用いることを計画しました。生体内で人工金属酵素を合成するとともに、この金属触媒活性を有効に利用して、人工金属酵素を体内のがん部位に運びます。さらにがん部位で抗がん活性分子を合成して、そのままがんを治療するという、生体内での二度の金属触媒反応を有効に利用した革新的な治療技術を検討しました。
-
※1
触媒的「現地合成」によるがん治療|理化学研究所
 (2019年7月2日プレスリリース)
(2019年7月2日プレスリリース)
-
※2
体内でベンゼン環を作る|東工大ニュース
 (2022年1月10日プレスリリース)
(2022年1月10日プレスリリース)
-
※3
極微量の触媒で抗がん剤を体内で大量生産|東工大ニュース
 (2023年9月27日プレスリリース)
(2023年9月27日プレスリリース)
研究手法と成果
研究チームは、血液に、アルブミンの疎水性リガンドを持つルテニウム触媒、ならびにベンジルフルオライド構造[用語4]を持つ蛍光分子を加えると、まず血液中のアルブミンの疎水性ポケットにルテニウム触媒が配位し、次にルテニウム触媒によってベンジルフルオライド蛍光分子が活性化されることで、アルブミンが選択的に蛍光標識されることを見いだしました(図1)。
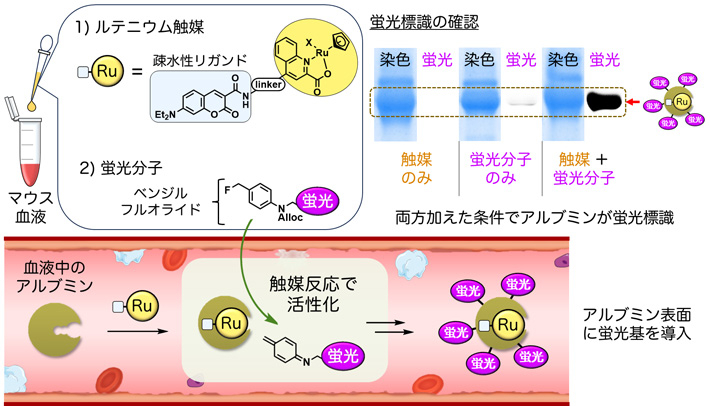
図1. ルテニウム触媒とベンジルフルオライドを用いた血中アルブミンの蛍光標識
- マウスの血液にルテニウム(Ru)触媒とベンジルフルオライド構造を持つ蛍光分子を加えると、ルテニウム触媒の疎水性リガンドの効果で、ルテニウム触媒が血液中のアルブミンに配位する。するとルテニウム触媒が触媒反応によって蛍光分子を活性化させる。その活性種がアルブミンと反応し、アルブミンが選択的に蛍光標識される。
この結果から、ベンジルフルオライド蛍光分子の代わりに、体内でがん組織に移行する性質を持つcRGDペプチドを持つベンジルフルオライドを加えることで、人工金属酵素の表面にcRGDペプチドを導入でき、体内で選択的にがんに移行する人工金属酵素を作ることができると考えました。さらに、人工金属酵素はがんに選択的に移行した後でも触媒活性を維持し、そこに抗がん活性ペプチドを持つベンジルフルオライド※4を体内に投与することで、二度目の金属触媒反応によってがんに抗がん活性分子を接着させ、副作用を抑えたがん治療を実現できると予測しました(図2A)。
そこで、ヒト結腸腺がん細胞(SW620)を移植したゼノグラフトモデルマウス[用語5]を用いた治療実験を行いました。まず、ルテニウム触媒とcRGDペプチドを持つベンジルフルオライドをゼノグラフトモデルマウスに静脈投与しました。1時間後に抗がん活性ペプチドを持つベンジルフルオライドを静脈投与したところ、顕著ながんの増殖抑制効果が見られました(図2B)。一方で三つの試薬のうち、1種類もしくは2種類、あるいは溶媒のみを投与した条件(ビークル)では、治療効果は全く認められませんでした。
以上の結果から、マウスの血液中に豊富に存在するアルブミンを有効利用して、(1)体内で直接人工金属酵素を合成するとともに、その金属触媒活性によって、(2)がんに人工金属酵素を運び、(3)がんを副作用なく治療できることが分かりました。
-
※4
たった1回の投薬で効く体内触媒戦法|東工大ニュース
 (2021年9月2日プレスリリース)
(2021年9月2日プレスリリース)
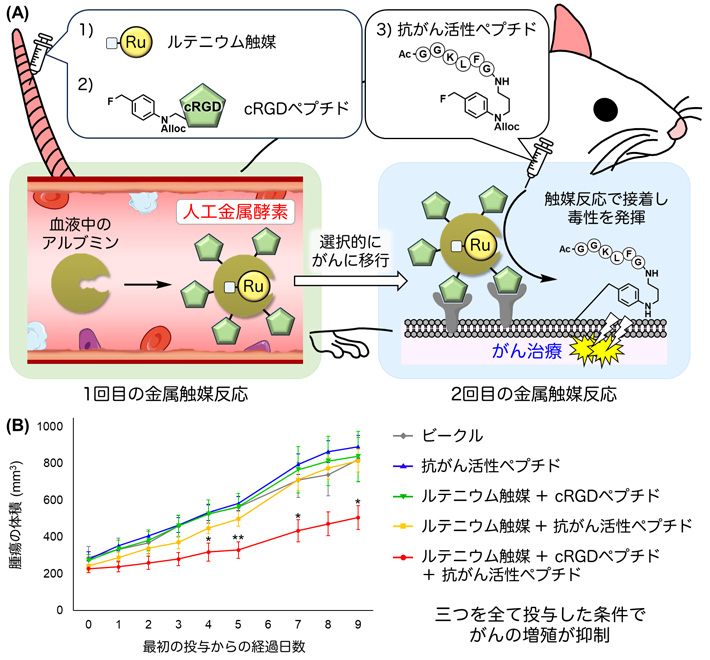
図2. SW620がんを移植したゼノグラフトモデルマウスを用いたがん治療
-
(A)生体内合成化学治療の手順。ルテニウム触媒とcRGDペプチドを持つベンジルフルオライドを、SW620がんを移植したマウスに静脈投与し、体内で人工金属酵素を合成した。がんに移行した人工金属酵素によって、追加で投与した抗がん活性ペプチドを持つベンジルフルオライドががんに接着され、毒性を発揮する。
(B)マウスに試薬を投与した後の腫瘍の体積の変化。三つの試薬を全て投与した条件(赤)だけで腫瘍の増殖が抑制された。
今後の期待
本研究成果は、生体内での二度の金属触媒反応を巧みに利用することで、マウスの静脈中に存在するタンパク質を原料として人工金属酵素を合成し、がんの治療に応用した世界で初めての例です。今回使用したルテニウム触媒だけでなく、多種多様な遷移金属触媒を含む人工金属酵素を血中で作り、そのまま体内でさまざまな治療分子を「現地」で合成して治療することが期待できます。この研究成果は、生体内のタンパク質を原料とするがんの革新的な生体内合成化学治療の開発、ひいては体内創薬化学研究所確立への大きな第一歩につながるものです。
研究チーム・発表者
東京工業大学
物質理工学院 応用化学系
- 田中克典 教授(理研 主任研究員、発表者)
- 今井恭祐 博士後期課程1年
- チャン・ツンチェ(Chang Tsung-Che)特任助教(研究当時、現 理研研究員)
- アンバラ・プラディプタ(Ambara Pradipta)助教(発表者)
科学技術創成研究院
- 六車共平 助教(理研基礎科学特別研究員(研究当時))
理化学研究所 開拓研究本部 田中生体機能合成化学研究室
- テクニカルスタッフII 中村亜希子
- 研究パートタイマーII 草苅百合子

左から田中克典、今井恭祐、六車共平、チャン・ツンチェ
- 用語説明
[用語1] 遷移金属触媒 : 周期表の第3族から第11族までに属する遷移金属元素を含む触媒。これらの元素は特定の官能基に対して強い親和性を示すため、さまざまな有機化学反応を触媒することが知られている。
[用語2] 生体内合成化学治療、体内創薬化学研究所 : 生体内合成化学治療とは、通常はフラスコの中で行われる複雑な有機合成化学反応を、生体内(疾患部位)で行い、治療薬を体内で直接合成することで疾患を治療する手法である。田中教授らのグループはこの分野で世界をリードしてきており、生体内合成化学治療を中心として、体内の疾患部位で薬剤を効率的に合成し副作用なく治療したり、病状に個体差の大きい患者に対してその一人一人に最も適した薬剤を体内で合成・スクリーニングしたりする一連の技術を「体内創薬化学研究所」と名付け、その実現を目指している。
[用語3] cRGD : (環状アルギニンーグリシンーアスパラギン酸)ペプチド がんに特異的に発現している受容体と強く相互作用するペプチド。この性質を利用して、がんに選択的に薬剤などを送達するのによく用いられる。アルギニン(R)、グリシン(G)、アスパラギン酸(D)の三つを基本構造とする環状のペプチド。
[用語4] ベンジルフルオライド構造 : ベンゼン環のベンジル位(ベンゼン環から一つ炭素を伸ばした位置)にF(フッ素)が結合している構造。Fが脱離すると、この構造が反応性の高い構造に変換される。
[用語5] ゼノグラフトモデルマウス : ヒトに由来するがん細胞を免疫不全マウス(免疫に欠陥があるマウス)へ移植したモデル。
- 論文情報
| 掲載誌 : | Angewandte Chemie International Edition |
|---|---|
| 論文タイトル : | In vivo synthetic anticancer approach by resourcing mouse blood albumin as a biocompatible artificial metalloenzyme |
| 著者 : | Kyosuke Imai, Kyohei Muguruma, Akiko Nakamura, Yuriko Kusakari, Tsung-Che Chang, Ambara R. Pradipta, and Katsunori Tanaka |
| DOI : | 10.1002/anie.202411225 |
- マウス体内でがんの糖鎖構造を合成化学的に変換|東工大ニュース
- “生細胞での有機合成化学”による新しい乳がん術中迅速診断法(CTS法)の臨床試験を開始|東工大ニュース
- がんに貼り付く極小サイズの分子接着剤 生体内合成化学による新しいラジオセラノスティクス|東工大ニュース
- 金触媒反応を引き金とするハイドロゲル化|東工大ニュース
- 極微量の触媒で抗がん剤を体内で大量生産|東工大ニュース
- わずか窒素3原子でがんを見つけてα線治療|東工大ニュース
- 植物毒の「現地合成」でがん細胞の増殖阻害に成功|東工大ニュース
- 乳がん術中迅速診断多施設臨床研究を行う共同研究を開始|東工大ニュース
- 体内でベンゼン環を作る|東工大ニュース
- たった1回の投薬で効く体内触媒戦法|東工大ニュース
- 金属触媒で"変身"する保護基|東工大ニュース
- 世界初のマウス体内におけるタギング治療|東工大ニュース
- 体内での環化付加反応によるがん化学療法|東工大ニュース
- がん細胞上で薬剤を化学合成|東工大ニュース
- 糖鎖の不均一性を秩序よく高次化してがんを見つける|東工大ニュース
- 生体内の金属触媒反応で薬効と物性を制御する|東工大ニュース
- 触媒駆動型の生体内エチレンセンサー|東工大ニュース
- 田中克典教授がアステラス病態代謝研究会の「2022年度最優秀理事長賞」を受賞|東工大ニュース
- 田中克典教授が日本化学会第37回学術賞を受賞|東工大ニュース
- 田中克典 Katsunori Tanaka|研究者検索システム 東京工業大学STARサーチ
- 六車共平 Kyohei Muguruma|研究者検索システム 東京工業大学STARサーチ
- 田中克典研究室
- 田中克典研究室|物質理工学院 研究室検索サイト
- 西山・三浦研究室
- ライフエンジニアリングコース(大学院課程)|教育|物質理工学院 応用化学系
- 応用化学コース(大学院課程)|教育|物質理工学院 応用化学系
- 応用化学系(学士課程)|教育|物質理工学院 応用化学系
- 生命理工学院 生命理工学系
- 科学技術創成研究院 (IIR)
- 化学生命科学研究所
- #20 田中克典「フラスコではなく体の中で薬を合成する」× 中野民夫 Tokyo Tech DLab "STAY HOME, STAY GEEK" 研究者インタビュー|YouTube
- 理化学研究所
- 研究成果一覧