生命理工学系 News
タンパク質合成を停止させる新規ペプチド配列を発見
ポイント
- タンパク質を構成するアミノ酸配列の一部は、合成装置リボソームの機能を阻害する「難翻訳」配列でもあることが明らかになりつつあります。
- 難翻訳配列を大腸菌ゲノムから大規模に探索する手法を開発し、新たな難翻訳配列pepNLとnanCLを新規に同定しました。
- PepNLペプチドは翻訳中にリボソーム内で「ヘアピン」状の構造を形成し、タンパク質合成を阻害することが判明しました。
- 細胞内のアミノ酸濃度が十分に高い場合、終止コドンの読み飛ばしによってPepNLによる翻訳阻害が回避されることも明らかとなりました。
概要
生命を形作るタンパク質は、DNAにコードされた遺伝子配列をもとに細胞内装置リボソーム[用語1]によって合成され、この過程は「翻訳」と呼ばれます。リボソームはどんなタンパク質でも合成可能、と思われがちですが、実際には合成しやすい配列と、合成が困難な「難翻訳配列[用語2]」が存在することが明らかになってきました。これまでにさまざまなアミノ酸配列が難翻訳であることが判明し、かつその一部は遺伝子発現制御に利用され得ることも報告されています。しかしどれだけのアミノ酸配列が難翻訳なのか、そしてなぜ難翻訳となるのかの原理は完全には理解されていない状況です。
東京科学大学 生命理工学院 生命理工学系の幸保明直大学院生(博士後期課程)、丹羽達也助教(生命理工学コース 主担当)、田口英樹教授(生命理工学コース 主担当)、岡山大学 学術研究院 環境生命自然科学学域(理)の茶谷悠平准教授、東京大学 大学院理学系研究科 生物科学専攻の安藤佑真大学院生(修士課程)、伊藤弓弦准教授、濡木理教授らのグループは大腸菌をモデル生物として、未同定の難翻訳配列を探索するための新技術を開発しました。この技術を用いた大規模解析により、大腸菌遺伝子から二つの新たな難翻訳配列pepNLとnanCLを同定しました。さらにクライオ電子顕微鏡によりPepNLによって合成が停止したリボソームの構造を解析したところ、PepNLペプチドがリボソームトンネル内で異常な折れ曲がり(ヘアピン)を形成し、翻訳を停止させるメカニズムを解明しました。
本研究は3月8日、英国学術雑誌 「Nature Communications」オンライン版に掲載されました。
※ 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
現状
生物の細胞を形作るタンパク質は、ヒトでは20,000種、大腸菌のような比較的単純な生物でも4,000種に及び、その種類は膨大です。これらのタンパク質は20種類のアミノ酸が独自の配列で並ぶことで形成され、生命活動に不可欠な機能を果たしています。こうした配列の多様性は、生体内で起こる複雑な生命現象を支える重要な要素となっています。そのため、これらを合成(翻訳)する細胞内装置リボソームは、あらゆるアミノ酸の組み合わせを合成できることを求められます。しかし、実際にはリボソームにも得手不得手があり、特定のアミノ酸配列の合成に困難を抱えていることが明らかとなってきました。
近年の技術革新などから、こうしたリボソームの弱点:難翻訳配列の存在が明らかになり、さまざまに研究が進められています。難翻訳配列の中には特定の条件下でのみリボソーム機能を阻害することで、遺伝子発現を制御するものも存在します。また、特定の薬剤が特定のアミノ酸配列の合成を選択的に阻害する例も報告されており、リボソームの機能が生理学的、薬理学的なプロセスと密接に関連していることが明らかになりつつあります。しかし、難翻訳配列の全体像や、どのようなメカニズムでリボソーム機能を阻害するのかといった点には、いまだ未解明の点が数多く残されています。
研究成果
今回岡山大学、東京科学大学、東京大学の合同研究チームは、大腸菌を解析対象としてリボソーム機能を阻害する難翻訳配列の探索技術開発に取り組みました。研究チームはまず、1. 難翻訳配列の過剰発現が、リボソーム機能阻害を通じて細胞全体のタンパク質合成を阻害すること、2. 遺伝子発現を制御する難翻訳配列は、その制御対象遺伝子の上流遺伝子読み枠(upstream ORF)に頻出することに着目し、上流ORFについての網羅的評価を実施しました。過剰発現による細胞毒性、翻訳阻害特異的なストレス応答、翻訳停滞を示す合成中間体ぺプチジルtRNAの蓄積の3点を指標として検討した結果、未同定ORF pepNLとnanCLを新規難翻訳配列として同定しました(図1)。
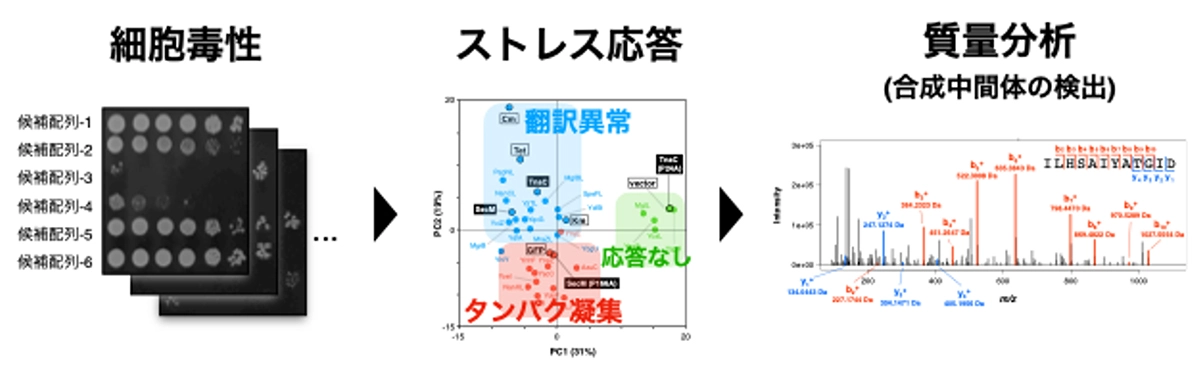
図1. 難翻訳配列を探索する新規スキーム
さらに研究チームは、pepNLを合成することで翻訳機能が阻害されたリボソーム複合体のクライオ電子顕微鏡構造解析を行い、分解能2.9Åでの構造情報取得に成功しました。得られた構造では、本来ならリボソームトンネル出口側を向いているペプチドN末端が、PepNL新生ペプチドでは入り口側に反転し、ヘアピンのような特異な構造を取っていることが明らかとなりました(図2)。この特異な構造が形成されると、後続するPepNL C末端付近のIle13残基が異常な方向に押し出されて翻訳終結因子による翻訳終結反応を阻害、結果リボソーム機能を破綻させる難翻訳配列であることがわかりました。
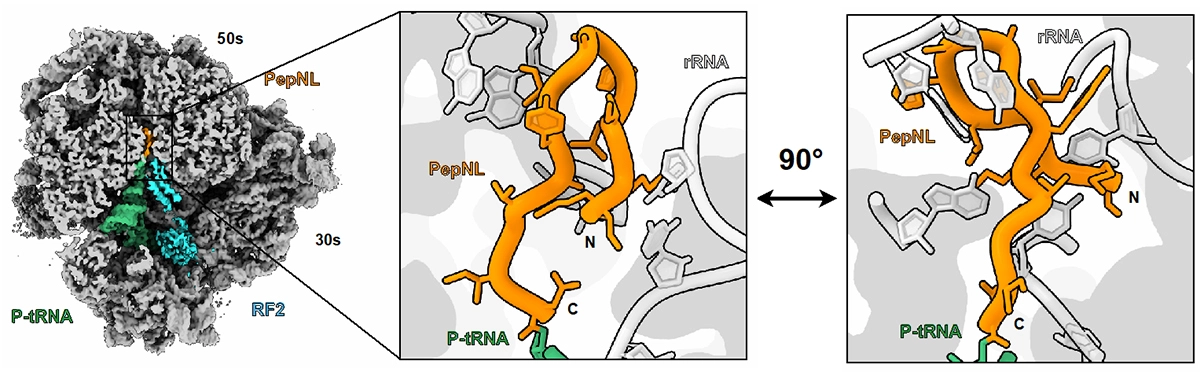
図2.リボソームトンネル内でヘアピン構造を形成する大腸菌PepNL新生ペプチド
(クライオ電子顕微鏡構造解析)
また、PepNLのヘアピン形成はアミノ酸の一種トリプトファンによって阻害されていることもわかりました。これはpepNLの終止コドンが、トリプトファン濃度が十分な状況ではリードスルー(読み飛ばし)されることで、先述したヘアピン形成による翻訳終結阻害を回避することによります。この機構を利用することでpepNLは、アミノ酸濃度に呼応して下流のペプチド分解酵素PepNの合成を制御しているものと考えられます。
社会的な意義
- 1. 本研究で構築した難翻訳配列の評価システム、あるいはその改良版を利用することで、これまで未同定、あるいは見過ごされてきた難翻訳配列を、より簡便に発見できると考えられます。
- 2. 比較構造解析から、翻訳終結を阻害する難翻訳配列(新生ペプチド)は、非常によく似た「歪み」を形成していることが明らかとなりました (図3)。こうした「歪み」が他の普遍的なタンパク質の合成過程でも発生している場合、特定の遺伝子に限定されない、普遍的な遺伝子発現制御メカニズムとして広く波及していく可能性があります。
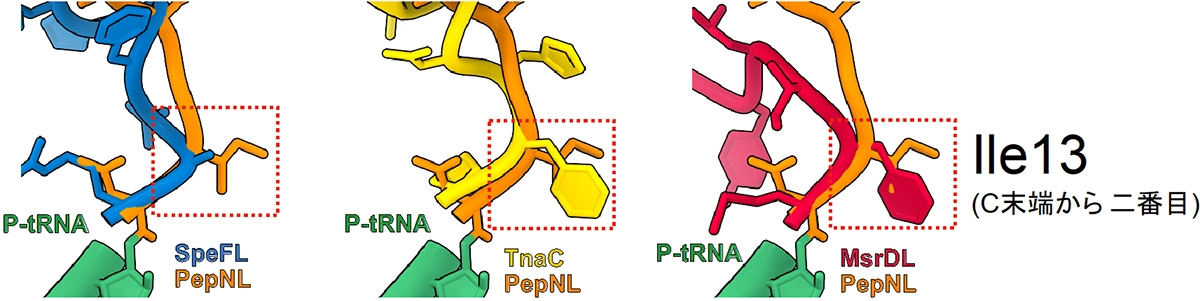
図3.翻訳終結を阻害する難翻訳配列に共通の、「C末端から二番目」のアミノ酸残基の歪み
- 付記
本研究は、日本学術振興会科研費(JP20H05925, 22H02553, JP 23H02410)、創薬等先端技術支援基盤プラットフォームAMED BINDS(3273, 4857)、戦略的創造研究推進事業CREST(JPMJCR20E2)、大隅基礎科学創成財団、日本応用酵素協会、武田科学振興財団、山田科学振興財団、千里ライフサイエンス振興財団の支援を受けて実施しました。
- 用語説明
[用語1] リボソーム:地球上の生命に、普遍的に内在するタンパク質合成装置。DNAにコードされた遺伝情報が写し取られたメッセンジャーRNAをアミノ酸配列へと変換(翻訳)し、ポリペプチド鎖 (タンパク質)を合成する。リボソームは大、小2つのサブユニットから構成され、大サブユニットには新規合成される新生ペプチド鎖が通るトンネル構造がある。
[用語2] 難翻訳配列:合成装置リボソームとの相性から、著しく合成効率が悪いアミノ酸モチーフ。プロリン、正電荷アミノ酸、負電荷アミノ酸などの連続配列が挙げられ、リボソームトンネルとの相互作用、反発からアミノ酸連結反応が起こりづらくなると考えられている。
- 論文情報
| 掲載誌: | Nature Communications |
|---|---|
| タイトル: | A mini-hairpin shaped nascent peptide blocks translation termination by a distinct mechanism |
| 著者: |
Yushin Ando, Akinao Kobo, Tatsuya Niwa, Ayako Yamakawa, Suzuna Konoma, Yuki Kobayashi, Osamu Nureki, Hideki Taguchi, Yuzuru Itoh, and Yuhei Chadani |
| DOI: |
10.1038/s41467-025-57659-z |
関連リンク
- 蛍光型と酵素型の間で可逆的に「変身」する シーソータンパク質を設計|生命理工学系 News
- リボソーム生合成の試験管内再構成に成功|生命理工学系 News
- 分泌タンパク質生合成過程の異常を鋭敏かつ簡便に検出する新しいツールの開発|生命理工学系 News
- 細胞内で発現しにくいタンパク質の合成を促進する翻訳因子を発見|生命理工学系 News
- 熱ショックタンパク質発現制御の新たな仕組みを20年ぶりに発見|生命理工学系 News
- 筋萎縮性側索硬化症と前頭側頭型認知症の新たな治療戦略への期待|生命理工学系 News
- タンパク質合成途上の新生鎖を網羅的に検出する手法の開発|生命理工学系 News
- タンパク質合成過程での中断リスク「リボソームの不安定化」は、原核生物と同様に真核生物でも見られることを発見|生命理工学系 News
- アミロイドの脱凝集メカニズムを解明|生命理工学系 News
- タンパク質の連続的な合成を保証するリボソーム「トンネル」の役割を発見|生命理工学系 News
- 熱ショックタンパク質が自身を増産する新たな仕組みを発見|生命理工学系 News
- 酵母プリオンタンパク質のアミロイド線維形成を直接観察|生命理工学系 News
- 合成途上のタンパク質が故意に合成を中断する現象を発見 ―細胞内の環境変化を感知する新たなしくみ―|生命理工学系 News
- 混ぜるだけで迅速に水溶液中のたんぱく質凝縮に成功―新たな高濃度たんぱく質材料で医薬品開発に期待―|旧・東京工業大学
- 細胞内で「タンパク質の一生」を支える脇役 シャペロンの謎解明に向けさらなるステージへ — 田口英樹|旧・東京工業大学
- 田口 英樹 Hideki Taguchi|研究者検索システム Science Tokyo STAR Search
- 丹羽 達也 Tatsuya Niwa|研究者検索システム Science Tokyo STAR Search
- 細胞制御工学研究センター
- 田口研究室
- 生命理工学院 生命理工学系
- 総合研究院|大学組織一覧|Science Tokyoについて
- 生命理工学院|大学組織一覧|Science Tokyoについて