生命理工学系 News
熱ショックタンパク質発現制御の新たな仕組みを20年ぶりに発見
熱ストレス応答制御因子を「作る前にストップをかける」調節機構
要点
- 熱ストレス応答制御因子の細胞内での存在量を厳密に制御する新たな仕組みを発見。
- 大腸菌の低分子量熱ショックタンパク質が、熱ストレス応答制御因子の生産前の段階でその翻訳を抑制することを確認。
- 細胞のストレス応答を制御する仕組みの1つを解明。
概要
東京工業大学 科学技術創成研究院 細胞制御工学研究センターの三輪つくみ研究員、田口英樹教授(生命理工学コース 主担当)の研究グループは、熱ショックタンパク質(ヒートショックプロテイン:Hsp)[用語1]の一種がストレス応答の制御を行う新たな仕組みを20年ぶりに発見した。
細胞に熱などのストレスがかかると、凝集体と呼ばれるタンパク質でできたゴミが発生する。この凝集体は細胞内に蓄積すると毒性を示すため、どのような生物もタンパク質の凝集を抑制するシャペロンと呼ばれるタンパク質群を備えている。このシャペロンの一種である熱ショックタンパク質(Hsp)は、凝集体の代表的な発生要因である熱ストレスによって合成が促進される。Hspの不必要な合成を防ぐため、その合成を制御する因子の細胞内での存在量は厳密に調節されている。
研究グループは、大腸菌のHspの一種である低分子量Hspが、Hspの合成制御因子σ32の細胞内での存在量を制御する新たな仕組みを発見した。Hspが既に生産されたσ32の安定化や分解によってその存在量を調節する仕組みは、20年以上前の研究で知られていた。しかし今回発見された仕組みは、σ32の生産を抑制することで存在量を調節するもので、より迅速かつ厳密なσ32の存在量制御を可能にする。
この成果は、既に確立したと考えられていたσ32の制御研究に未知の領域が存在することを示すものであり、ストレス応答という生命に普遍的な現象に対する理解をさらに深めるものとも言える。研究成果は7月31日付の米国の学術誌「Proceedings of National Academy of Sciences of United States of America(米国科学アカデミー紀要)」電子版に掲載された。
背景
タンパク質は、細胞内の化学反応の触媒や構造の保持を行うなど、生命活動に必須の生体高分子である。タンパク質が細胞内で機能を発揮するには、DNAに記された遺伝情報のコピーを取る「転写」、コピーされた遺伝情報に基づきアミノ酸をつなぐ「翻訳」、そしてつながったアミノ酸(ポリペプチド鎖)が正しい立体構造を取る「フォールディング」という過程を経る必要がある。
タンパク質は一般に不安定である。熱などのストレスにさらされて立体構造が崩れたり、フォールディングに失敗したりしたタンパク質は、正しい立体構造を取ることができずに、タンパク質凝集体と呼ばれる分子集合体を形成する。身近な例では、透明な卵白を高温にすると白く固まる、つまり、ゆで卵になるのは、卵白内のタンパク質が熱で変性して凝集した結果、固まりになるからである。タンパク質が凝集体になると機能を失うだけでなく、細胞にとって有害になることもある。そのため、どのような生物もタンパク質凝集体ができないようにするシャペロンというタンパク質群を備えている。
タンパク質が凝集してしまう代表的な要因が熱ストレスである。そのため、生物は熱ストレスにさらされることで合成が増進する熱ショックタンパク質(Hsp)をシャペロンとして機能させることで、タンパク質凝集体に対処している。
低分子量Hspは、バクテリアからヒトまであらゆる生物種に普遍的に存在するHspで、タンパク質凝集体を細胞内で隔離し、さらにはその分解を補助するシャペロンの一種である。さらに研究グループの以前の研究により、この低分子量Hspは自らの翻訳を抑制し、ネガティブフィードバック機構[用語2]を介して、Hsp自体の細胞内での存在量を厳密に制御する機能も有することが分かっている。
Hspをコードする遺伝子は、熱にさらされることで転写が促進されることが知られており、その転写は熱ショック転写因子σ32によって制御されている。このσ32による大腸菌Hspの発現制御の仕組みは、初期のシャペロン研究の主要テーマの1つであり、1990〜2000年頃に盛んに研究された。その結果、20年ほど前には、DnaKやFtsHといった他のHspを介したσ32の安定化や分解の制御によって、σ32の細胞内での存在量が調節される仕組みが明らかにされている。
研究成果
本研究では、低分子量Hspの翻訳抑制機能が熱ショック転写因子σ32に対しても働くことを見つけ、この抑制機能が、転写因子σ32の不必要な環境下での生産を防ぐことを明らかにした(図1)。
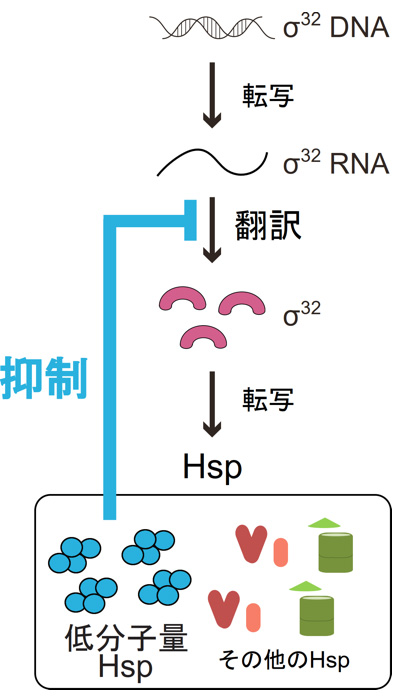
図1. 低分子量Hspによる熱ショック転写因子σ32の制御。
熱ショック転写因子σ32は分解されることによって存在量が制御されることが知られていた。しかし、本研究によって、大腸菌の低分子量Hspはσ32の翻訳を抑制することでσ32が作られる前段階を制御する仕組みがあることも分かった。
具体的には、低分子量Hspを過剰に発現する大腸菌細胞内では、他のHspの発現が減少することを発見した。さらに詳しく調べたところ、低分子量Hspは種々のHspの転写を制御する転写因子σ32の翻訳を抑制していることが分かった。一方、低分子量Hspを持たない大腸菌では、熱ストレス後に余剰となったσ32の抑制が遅れ、細胞の生育を悪化させていた。このことは、低分子量Hspによるσ32の翻訳抑制は、ストレス応答やストレス後の細胞の生存に重要な役割を果たすことを示している。
今回の発見により、低分子量Hspには、ストレスのないときはσ32の翻訳を抑え、ストレス時には促進する役割があることが分かった。こうした低分子量Hspによる翻訳抑制は、既に知られている制御機構とは根本的に異なる仕組みだと言える。以前より知られている他のHspを介したσ32の制御では、既に生産された多くのσ32を分解することで存在量を減らす必要がある。これに対して、低分子量Hspによる翻訳抑制を介した制御は、σ32の不必要な生産を抑える仕組みであり、この違いが迅速なσ32抑制に役立っていると考えられる(図2)。
実際に研究グループは、低分子量Hspがない細胞ではσ32の抑制が通常よりも遅れることを示した。また、低分子量Hspは凝集しそうなタンパク質と相互作用し、自ら凝集体に巻き込まれる性質がある。そのため、細胞にストレスがかかりタンパク質凝集体が発生すると、低分子量Hspは即座にタンパク質凝集体に引き寄せられ、σ32は翻訳抑制から解放される。つまり低分子量Hspによる翻訳抑制は、σ32が必要となったときに即座に多量に生産できるようにする制御機構であると言える。
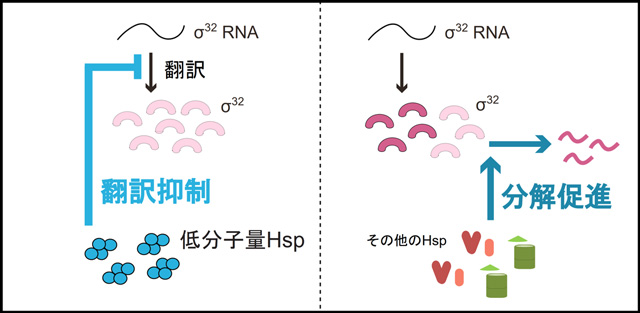
図2. σ32の存在量制御。
今回発見された低分子量Hspによる制御機構(左)は、σ32が生産される前の翻訳段階における制御である。一方、他のHspによる制御(右)では、既に生産されたσ32を分解することで存在量を制御する。
社会的インパクト
転写によるHspの発現制御は、バクテリアからヒトまであらゆる生物種が共通して持つ仕組みである。ヒトでは、細胞内タンパク質の恒常性の破綻がさまざまな疾患に関与することが知られている。今回バクテリア(大腸菌)で発見した低分子量Hspによる熱ストレス応答の制御がヒトなど真核生物でも起こっていれば、この制御機構のさらなる研究が疾患の分子機構の解明、ひいては創薬や治療戦略などに役立つ可能性がある。
今後の展開
低分子量Hspを含むシャペロンは、変性したタンパク質に結合して凝集を防ぐのが共通の役割であるが、本研究によって、低分子量HspがメッセンジャーRNA(mRNA)に結合して翻訳を抑制していることも明らかとなった。しかしシャペロンがどのようなメカニズムでタンパク質とmRNAの両方に作用するのかは未解明であり、シャペロンの新たな役割を明らかにしていく上で興味深い課題である。
- 付記
本研究は、文部科学省科学研究費助成事業(田口英樹:JP26116002、JP18H03984、三輪つくみ:JP21K20631、JP22K14860)などの支援を受けて行われた。
- 用語説明
[用語1] 熱ショックタンパク質(ヒートショックプロテイン:Hsp) : 細胞が熱や化学物質などのストレスにさらされた際に、発現が上昇してタンパク質の凝集を防ぐタンパク質の一群。
[用語2] ネガティブフィードバック機構 : タンパク質や代謝産物などが上流タンパク質の発現や活性を抑制することで、増えすぎないように自己制御する仕組み。
- 論文情報
| 掲載誌 : | Proceedings of the National Academy of Sciences of the United States of America (米国科学アカデミー紀要) |
|---|---|
| 論文タイトル : | Escherichia coli small heat shock protein IbpA plays a role in regulating the heat shock response by controlling the translation of σ32 (大腸菌の低分子量熱ショックタンパク質IbpAはσ32の翻訳を制御することにより、熱ショック応答を制御する) |
| 著者 : | Tsukumi Miwa and Hideki Taguchi |
| DOI : | 10.1073/pnas.2304841120 |
- 筋萎縮性側索硬化症と前頭側頭型認知症の新たな治療戦略への期待|生命理工学系 News
- タンパク質合成途上の新生鎖を網羅的に検出する手法の開発|生命理工学系 News
- タンパク質合成過程での中断リスク「リボソームの不安定化」は、原核生物と同様に真核生物でも見られることを発見|生命理工学系 News
- アミロイドの脱凝集メカニズムを解明|生命理工学系 News
- タンパク質の連続的な合成を保証するリボソーム「トンネル」の役割を発見|生命理工学系 News
- 熱ショックタンパク質が自身を増産する新たな仕組みを発見|生命理工学系 News
- 酵母プリオンタンパク質のアミロイド線維形成を直接観察|生命理工学系 News
- 合成途上のタンパク質が故意に合成を中断する現象を発見 —細胞内の環境変化を感知する新たなしくみ—|生命理工学系 News
- タンパク質合成過程における「緩急のリズム」を実証—大腸菌遺伝子産物の中間状態を網羅的に解析—|生命理工学系 News
- 細胞内で「タンパク質の一生」を支える脇役 シャペロンの謎解明に向けさらなるステージへ — 田口英樹|研究ストーリー|研究
- 【研究室紹介】 田口研究室|生命理工学系 News
- 田口研究室
- 田口英樹 Hideki Taguchi|研究者検索システム 東京工業大学STARサーチ
- 三輪つくみ Tsukumi Miwa|研究者検索システム 東京工業大学STARサーチ
- 細胞制御工学研究センター
- 科学技術創成研究院(IIR)
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
教授 田口英樹
E-mail : taguchi@bio.titech.ac.jp
Tel / Fax 045-924-5785