生命理工学系 News
リボソーム生合成の試験管内再構成に成功
細胞内のタンパク質合成工場を試験管で再現
ポイント
- 遺伝子を使ってリボソーム[用語1]を試験管内で合成すること(リボソーム生合成)に成功
- リボソーム生合成は、約200種の因子を必要とする極めて複雑なものであり、試験管内での再構成は困難だった
- 「生体内環境を試験管内で模倣する」ことを指針に、それら200種の因子を適切な環境で組み合わせることで、リボソーム生合成の試験管内再構成[用語2]に成功
- 多様な非天然ペプチド・タンパク質[用語3]を効率的に合成できる人工リボソームを創出可能になると期待
概要
東京科学大学 総合研究院 細胞制御工学研究センターの丹羽達也助教(生命理工学コース 主担当)と田口英樹教授(生命理工学コース 主担当)は、大阪大学 大学院工学研究科の青木航教授らの研究グループと共同で、遺伝子を出発物質としてリボソームを合成するプロセス(リボソーム生合成)を試験管内で再構成することに世界で初めて成功しました。
リボソームとは、20種類のアミノ酸を遺伝コードに従ってつなげることでペプチド・タンパク質を合成する分子機械です。もしリボソームを改変できれば、多様な非天然ペプチド・タンパク質を合成可能になるため、優れた医薬や産業用酵素の創出が可能になると期待されています。しかし、リボソームは生命の必須因子であるため、これを改変しようとすると細胞にとって有害な影響(細胞毒性)が発生します。そのため、リボソームの改変は困難でした。
今回、研究グループが開発した試験管内リボソーム生合成は、遺伝子を出発物質として試験管内でリボソームを合成できます。そのため、細胞毒性を考慮する必要なく、原理的にはあらゆる変異をリボソームに導入できると考えられます。
本技術を応用することで、多様な非天然ペプチド・タンパク質を効率的に重合できる人工リボソームを創出できるようになると期待されます。
本研究成果は、1月8日に、英国科学誌「Nature Communications」に公開されました。
※2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。

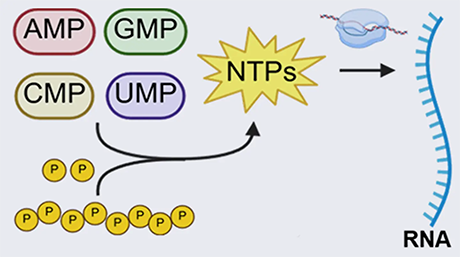
図1. 試験管内リボソーム生合成
背景
リボソームとは、遺伝コードに従って20種類のアミノ酸をつなげてタンパク質を作る分子機械です。この分子機械を改変し、多様で自然界にはない新しい材料(非天然モノマー)を使ってタンパク質を作れるようになれば、人類が利用可能なペプチド・タンパク質の多様性を大幅に拡張できるため、優れた中分子医薬や産業用酵素の創出が可能になると期待されます。
しかし、リボソームを改変して非天然モノマーを効率的に使うことはいまだ難しい課題です。先行研究では、リボソーム以外の関連する分子を改変し、リボソームに非天然モノマーを使わせる試みが行われてきました。その結果、例えばD-アミノ酸を使って最大10連続程度の重合が可能になっています。
非天然モノマーの重合効率をさらに改善するためには、リボソーム自体を改変することが必須です。近年の結晶構造解析などにより、リボソームの活性中心はL-α-アミノ酸に最適化されており、それ以外の非天然モノマーは効率的に重合できないことが示されています。しかし、生命の必須因子であるリボソームを改造すると細胞に有害な影響(細胞毒性)が出るため、改造は困難でした。
そこで研究グループは、リボソームを試験管内で合成可能とすることで、細胞毒性を考慮する必要なく、自由自在なリボソームエンジニアリングを実現しようと試みてきました。
研究成果
リボソーム生合成は極めて複雑なプロセスです。例えば大腸菌のリボソームは、57種の構造因子から成り、その内訳は、3種のリボソーマルRNA(rRNA)と54種のリボソームタンパク質(r-protein)です。これらの構造因子は、rRNAのプロセシングや転写後修飾、r-proteinの翻訳後修飾、リボソームのフォールディングをサポートする100種近くのアクセサリタンパク質のサポートのもとアセンブリし、新たなリボソームを形成します。つまりリボソーム生合成とは、約200種類もの因子が協調的に働くことで成立する、最も複雑な生命現象のひとつと言えます。
このように極めて複雑な反応を試験管内で再構成するためには、ただ闇雲にトライアル&エラーを試みるわけにはいかず、何らかの大きな指針を立てることが必要でした。そこで青木教授らのグループは、「生体内環境を徹底的に模倣すれば、リボソーム生合成を試験管内で再現できるのではないか?」という仮説を立てました。この仮説を検証するために、生体内を模倣した反応場の構築を進めました。具体的には、リボソーム生合成に必要な100種のアクセサリタンパク質を含む反応場として、大腸菌のS150破砕液を準備しました。S150破砕液とは、大腸菌の破砕液を150,000 gで遠心した後の上清画分であり、リボソーム生合成をサポートするアクセサリタンパク質をすべて含むと考えられます。そのS150破砕液の化学的環境を生体内に近づけるために、大腸菌に多く含まれる各種低分子化合物(グルタミン酸カリウム・グルタミン酸マグネシウム・グルタミン酸アンモニウム・スペルミジン・プトレシンなど)を添加しました。次に、rRNAやr-proteinの転写・翻訳に必要とされる50種ほどの因子(NTP・アミノ酸・tRNA・CoA・NADなど)をそれぞれ適切な濃度で添加しました。最後に、リボソーム生合成のプロセスをスタートさせるために、天然リボソーム・RNAポリメラーゼ・3種のrRNA遺伝子・54種のr-protein遺伝子を添加しました。青木教授らのグループは、反応条件の最適化を繰り返すことで、リボソーム生合成の試験管内再構成に世界で初めて成功しました。
社会的インパクト
本研究成果は、2つの観点から次世代のペプチド・タンパク質工学に資する技術になると期待されます。第一に、リボソームの触媒メカニズムの理解を深めることができると考えられます。リボソームはなぜ20種類の天然アミノ酸を効率的に重合できるのか?なぜ非天然モノマーの重合効率は低いのか?という問いは、まだ正確には明らかになっておりません。本研究は、これまで実現が難しかった多様なリボソーム変異体の構築・評価を可能とすることで、リボソームの触媒メカニズムの理解に大きく貢献すると期待されます。
第二に、人類が利用可能なペプチド・タンパク質の多様性を大きく拡張すると期待されます(図2)。人工リボソームを設計し、天然アミノ酸とは性質が異なる非天然モノマーを効率的に重合可能とすることで、経口投与性や細胞膜透過性に優れた次世代中分子医薬が創出できるようになります。また、D-アミノ酸を効率的に重合可能となれば、鏡像タンパク質工学の実現にも近づくでしょう。D-タンパク質は、L-タンパク質が触媒する反応のキラリティを反転可能という特徴、また、プロテアーゼ耐性が高く分解されにくいという特徴を持ち、安定性の高い産業用酵素や消化管へ投与可能なタンパク質医薬として活躍すると期待されます。
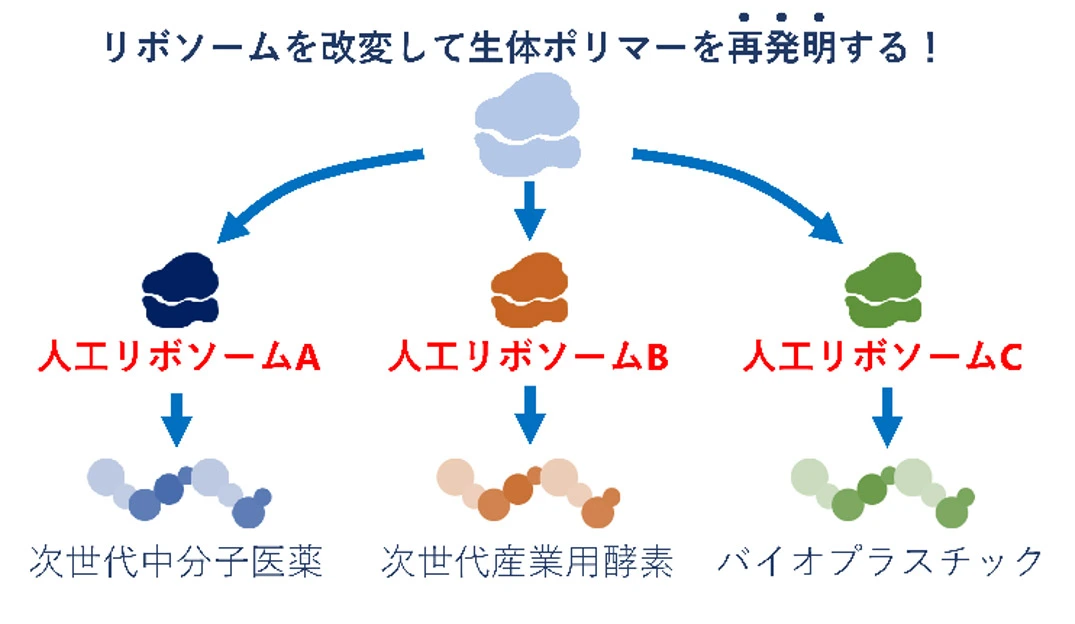
図2. 人工リボソームによる生体ポリマーの再発明
研究者のコメント
大阪大学大学院工学研究科 青木航教授
本研究では、最も複雑な生物学的システムのひとつである「リボソーム生合成」を試験管内で再構成することに成功しました。この試験管内リボソーム生合成では、細胞毒性を考慮することなく、原理的にはあらゆる変異をリボソームに導入できると考えられます。将来的には、触媒活性を改変した人工リボソームを設計することで、さまざまな産業に資する非天然ペプチド・タンパク質が合成可能になると期待されます。
- 付記
本研究は、科研費・JST創発的研究推進事業・JST大学発新産業創出プログラム・JST革新的GX技術創出事業・ExCELLSプロジェクト研究などの一環として行われ、東北大学 多元物質科学研究所 福山真央准教授・東京科学大学 総合研究院 田口英樹教授・熊本大学 大学院生命科学研究部 富澤一仁教授・京都大学 大学院農学研究科 菅瀬謙治教授・京都大学 成長戦略本部 植田充美特任教授の協力を得て行われました。
- 用語説明
[用語1] リボソーム:リボソームは、細胞内でタンパク質合成を行うための工場のようなものである。具体的には、リボソームは、遺伝情報に基づいて20種類のアミノ酸を重合することでペプチド・タンパク質を合成する。
[用語2] 試験管内再構成:試験管内再構成とは、細胞内で起こる複雑な生命現象を、試験管内で人工的に再現する実験手法である。試験管内再構成に成功すると、1. 生命現象に関わる最小限の構成要素を特定できる、2. 特定の分子の役割や機能を詳細に解析できる、3. 細胞内では観察が難しい反応を直接観察・操作できるなどの利点が生じる。
[用語3] 非天然ペプチド・タンパク質:天然のペプチド・タンパク質は、20種の天然アミノ酸により構成される。天然には存在しない非天然モノマーを含むリボソームで効率的に重合できるようになれば、さまざまな特殊機能をペプチド・タンパク質に付与できると期待される。
- 論文情報
| 掲載誌: | Nature Communications |
|---|---|
| 論文タイトル: | Autonomous ribosome biogenesis in vitro |
| 著者: | Yuishin Kosaka, Yumi Miyawaki, Megumi Mori, Shunsuke Aburaya, Chisato Nishizawa, Takeshi Chujo, Tatsuya Niwa, Takumi Miyazaki, Takashi Sugita, Mao Fukuyama, Hideki Taguchi, Kazuhito Tomizawa, Kenji Sugase, Mitsuyoshi Ueda, Wataru Aoki |
| DOI: | 10.1038/s41467-025-55853-7 |
関連ページ
- 分泌タンパク質生合成過程の異常を鋭敏かつ簡便に検出する新しいツールの開発|生命理工学系 News
- 細胞内で発現しにくいタンパク質の合成を促進する翻訳因子を発見|生命理工学系 News
- 熱ショックタンパク質発現制御の新たな仕組みを20年ぶりに発見|生命理工学系 News
- 筋萎縮性側索硬化症と前頭側頭型認知症の新たな治療戦略への期待|生命理工学系 News
- タンパク質合成途上の新生鎖を網羅的に検出する手法の開発|生命理工学系 News
- タンパク質合成過程での中断リスク「リボソームの不安定化」は、原核生物と同様に真核生物でも見られることを発見|生命理工学系 News
- アミロイドの脱凝集メカニズムを解明|生命理工学系 News
- タンパク質の連続的な合成を保証するリボソーム「トンネル」の役割を発見|生命理工学系 News
- 光合成における新しい電子伝達タンパク質を発見|生命理工学系 News
- 熱ショックタンパク質が自身を増産する新たな仕組みを発見|生命理工学系 News
- 酵母プリオンタンパク質のアミロイド線維形成を直接観察|生命理工学系 News
- 合成途上のタンパク質が故意に合成を中断する現象を発見 ―細胞内の環境変化を感知する新たなしくみ―|生命理工学系 News
- タンパク質合成過程における「緩急のリズム」を実証―大腸菌遺伝子産物の中間状態を網羅的に解析―|旧・東京工業大学
- 細胞内で「タンパク質の一生」を支える脇役 シャペロンの謎解明に向けさらなるステージへ — 田口英樹|旧・東京工業大学
- 平成30年度手島精一記念研究賞 授与式を挙行|生命理工学系 News
- 丹羽達也 Tatsuya Niwa|研究者検索システム Science Tokyo STAR Search
- 田口英樹 Hideki Taguchi|研究者検索システム Science Tokyo STAR Search
- 田口研究室
- 細胞制御工学研究センター
- 生命理工学院 生命理工学系
- 総合研究院|大学組織一覧|Science Tokyoについて
- 生命理工学院|大学組織一覧|Science Tokyoについて
お問い合わせ
大阪大学 大学院工学研究科
教授 青木航
Tel 06-6879-7439
Email aoki.wataru@bio.eng.osaka-u.ac.jp
東北大学 多元物質科学研究所
准教授 福山真央
Tel 022-217-5396
Email mao.fukuyama.b2@tohoku.ac.jp