生命理工学系 News
細胞内で分子カプセルとサイコロ状タンパク質結晶を融合
タンパク質カプセルを表層に集積した複合結晶の迅速合成
要点
- サイコロ状とカプセル状という全く異なる形状と性質を持つタンパク質集合体を、1つの細胞の中で個別に同時合成することに成功。
- 合成した集合体の複合結晶を細胞内で自発的に合成し、製造プロセスの大幅な簡素化を実現。
- 薬物輸送材料やワクチン、生体センサーなど、新たな生体固体材料への応用に期待。
概要
東京工業大学 生命理工学院 生命理工学系のファン・タック・トアン大学院生と安部聡助教(生命理工学コース 主担当)、上野隆史教授(生命理工学コース 主担当)のグループは、細胞内タンパク質結晶化反応[用語1]を用いて、カプセル状タンパク質フェリチン[用語2]をサイコロ状のタンパク質結晶である多角体[用語3]に固定化し、複合結晶を合成する技術を開発した。
近年、タンパク質を集合化させ、ナノサイズの構造体を合成する研究が世界中で活発に行われている。その背景には、人工的な物質を用いず、体に負担をかけない持続可能な材料として、生体親和性の高いタンパク質を原料とする薬物輸送材料やワクチン、生体センサーが注目され始めたことがある。
本研究では、フェリチンと多角体という、全く異なる形状と性質を持つタンパク質集合体を、1つの細胞の中で個別に同時合成することに成功した。さらに、分子タグ[用語4]を用いることで、細胞内での多角体表面にフェリチンが結合した複合結晶の合成も実現した。
合成した複合結晶は、多角体表面のフェリチンに望みの分子を取り込んで、特定の場所でpH刺激によってそのフェリチンを放出する材料として機能できる。また、この複合結晶は細胞内で自発的に合成されるため、短時間で大量の目的物を得られることから、タンパク質材料化で長年課題とされてきた精製過程の簡素化を実現し、従来のタンパク質エンジニアリングの概念を大きく変えると期待される。こうしたことから、今回開発した手法は、生物プロセスを活用した新たな固体材料合成手法として、環境材料から医療応用まで幅広い分野への拡張が期待される。
本成果は、ナノ科学分野において権威のある学術誌「ナノレターズ(Nano Letters、アメリカ化学会出版社)」のオンライン版で11月13日(現地時間)に公開された。
背景
タンパク質集合体は、ナノサイズのタンパク質が規則的に自己集積することで形成される、さまざまな形状とサイズを有する構造体であり、世界中で活発に研究されている。その構造特性を利用した機能材料創成を目指して、タンパク質集合体を用いた広範囲のバイオ応用が国内外で展開されている。しかしながら、これまでのタンパク質集合体の人工機能化研究では、単一のタンパク質をビルディングブロックとする分子設計が主流であり、異なるタンパク質集合体を複合化した機能拡張には至っていない。そこで、細胞内での異なる集合体の自発的な合成と、その集合体の複合化の手法を確立できれば、望みの機能を有する材料合成につながる。
研究グループは、タンパク質の自己集合体の一つであるタンパク質結晶に着目した。タンパク質結晶は、タンパク質の自己集積化反応により、分子の位置や配向が三次元に精密に制御された固体状態の集合体である。この特異な規則性が、高い安定性を有するバイオマテリアル素子としての可能性を開くと期待されている。これまでの研究では、金属クラスターや金属錯体、酵素などを結晶の内部空間に固定化することによる機能材料合成が行われてきた。研究グループも、サイコロ状のタンパク質結晶であり、細胞内で結晶化する多角体を用いて、酵素を細胞内で多角体タンパク質と共発現させることで結晶内に内包した機能化結晶を合成してきた。しかし、タンパク質カプセルやチューブなどのタンパク質集合体を固定化する効率的な手法はこれまで確立されていなかった。
研究成果
フェリチンは、モノマーが24個集積したカプセル状タンパク質集合体である。本研究では、これまで困難とされていた、1つの細胞内でフェリチンと多角体結晶という全く異なる形状と性質を持つタンパク質集合体の同時合成と、多角体結晶の表面にフェリチンが結合した複合結晶の合成に成功した(図1)。
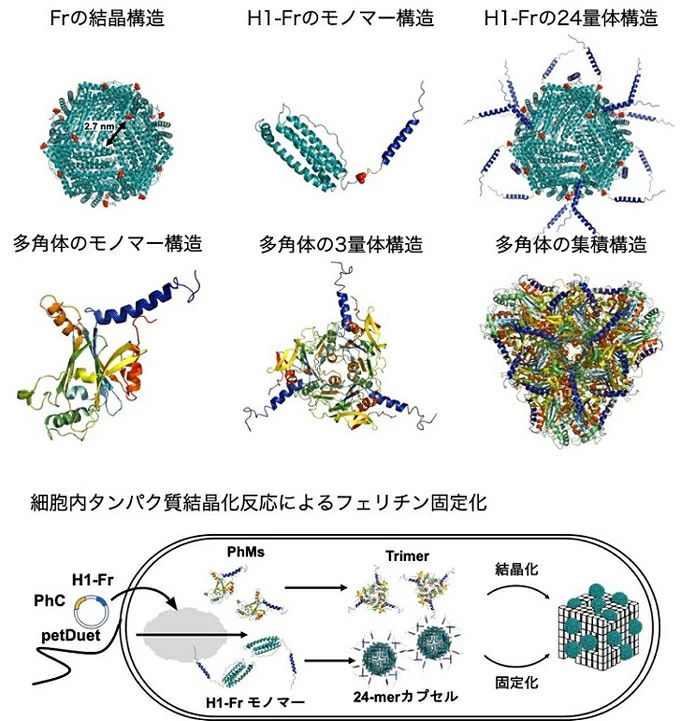
図1. H1-Fr/PhC複合結晶の合成法
多角体とフェリチンの複合結晶の合成は、多角体と結合する分子タグをフェリチンの表面に露出させることにより可能になった。具体的には、フェリチンのN末端に、多角体結晶への取り込みを促進する構造体(H1)を分子タグとして融合することで、多角体表面にフェリチンが結合した結晶(H1-Fr/PhC)を合成した。H1を融合していない野生型のフェリチンと多角体タンパク質との共発現では、フェリチンは固定化されなかった。また、タンパク質モノマーであるH1-sfGFPを共発現した場合と比較して、合成した結晶ではモノマーあたり270倍もの固定化量があることがわかった。このことは、24個のH1がフェリチン外部に露出することで、多角体タンパク質との多点的な相互作用により、効率的な多角体への固定化を促進していることを示している。
合成した複合結晶内のフェリチンの構造を検討するため、小角X線散乱(SAXS)測定を行った。その結果、カプセル構造を示す散乱ピークと、結晶性を示すブラッグピークが観測された(図2上)。さらに、複合結晶をpH3の緩衝溶液で溶解させた上清のSAXSや電子顕微鏡測定では、結晶から放出されたH1-Frはカプセル状構造を維持していることが示された。また、溶け残った結晶のSAXS測定では、H1-Frに由来する散乱ピークが消失し、多角体結晶の結晶性を示すBragg peakを示すことが示された(図2下)。複合結晶表面の高速原子間力顕微鏡像からは、H1-Frに由来するケージ構造が結晶表面に観察された。これらの実験結果から、H1-Frは複合結晶の表面に集積していること、そしてH1-FrはpH刺激によって複合結晶表面から放出されることも示された(図2下)。
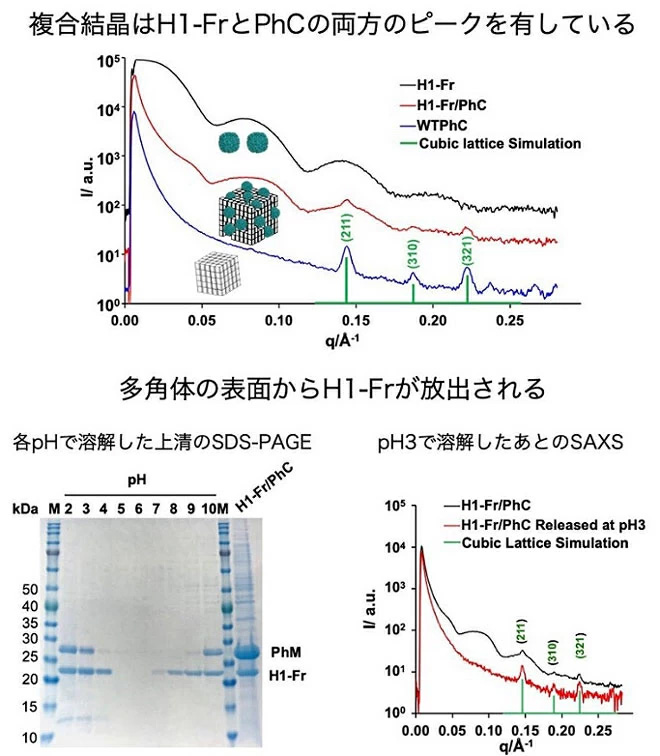
図2. H1-Fr/PhCのSAXSと溶解後の結晶
フェリチンは、カプセル構造の内部に小分子や金属化合物を取り込む(内包する)ことが知られている。本研究でも実際に複合結晶表面のフェリチン内部への蛍光分子内包が起こっていることを確認した。この分子を内包したフェリチンは、pH刺激によって結晶表面から放出される。このことは、望みの分子を内包したフェリチンを固定化した多角体に対してpHなどの適切な刺激を与えれば、特定の場所でそのフェリチンを放出できることを示している。
今後の展開
タンパク質カプセルの機能化研究は、国内外で盛んに展開されている。本研究で実現した、タンパク質カプセルを結晶へ固定化する技術は、鋳型結晶の物質輸送や外部刺激分解によるタンパク質カプセルの活性化など、固体材料機能を融合した機能創成において大きな可能性を秘めている。さらに本手法では、H1-FrとPhCを細胞内で共発現するだけで、複合結晶として直接合成することができる。今後はこの手法を用いることで、タンパク質を用いた材料の迅速大量合成が可能となり、これまでのタンパク質を用いた材料開発の大きな課題であった、精製過程の大幅な簡素化につながると期待される。
社会的インパクト
今回の研究成果である、フェリチンカプセルを結晶表面に固定化した複合結晶の合成手法は、タンパク質集合体の精製や結晶材料への固定化といった煩雑な操作が不要なため、不安定タンパク質やワクチン標的タンパク質の合成・精製・保存を細胞内で完結することができる。そのためさまざまなタンパク質集合体の固定化が可能であり、ウイルス様粒子やウイルス構成タンパク質の結晶内包と保存、放出などを通して、次世代ワクチン製造法への応用などの社会実装への展開も期待される。したがって本手法は、生物プロセスを活用した新たな固体材料合成手法として、触媒やドラッグデリバリー、センシングなど、環境材料から医療応用まで幅広い分野への拡張が見込まれることから、大きな社会的インパクトを持つと言える。
- 付記
本成果は、文部科学省科学研究費助成事業(JP19H02830、JP22H00347、JP18H05421、 JP22K19266)の支援によるものである。
- 用語説明
[用語1] 細胞内タンパク質結晶化反応 : タンパク質結晶は一般的に、タンパク質と、結晶化を促進する沈殿剤を混合することで結晶化させる。一方、細胞内タンパク質結晶は、細胞内で自発的に結晶を形成し、タンパク質自身の安定化や、細胞内分子の貯蔵や運搬機能を有する。こうした結晶化反応は1960年代から確認されているものの、細胞内での詳細な結晶化機構はいまだ明らかになっていない。
[用語2] フェリチン : 24個の単量体から構成される外径8 nmのカプセル状タンパク質であり、天然ではその内部空間に鉄を貯蔵する役割がある。一般的なタンパク質は熱やpH変化に弱いとされているが、フェリチンは、100℃程度の温度や2-10のpH帯でも構造や機能が大きく変化しない安定な物質である。近年、フェリチンカプセルの中に、鉄以外の天然に存在しない金属化合物を集積させ、化学反応に利用する研究が進められている。
[用語3] 多角体 : 細胞質多角体病ウイルスの感染後期に合成される多角体タンパク質が自発的に集合して結晶化した、タンパク質の結晶構造体。水中や有機溶媒中でも溶解しない高い安定性を有している。細胞内タンパク質結晶化反応で、研究対象として最も広く利用されているタンパク質結晶の一つ。
[用語4] 分子タグ : この研究では、多角体タンパク質に結合する分子タグとして、多角体タンパク質のN末端領域のH1ヘリックスを利用した。これをフェリチン24量体の外表面に融合させることにより、多角体への取り込みを促進させることができる。
- 論文情報
| 掲載誌 : | Nano Letters |
|---|---|
| 論文タイトル : | Displaying a Protein Cage on a Protein Crystal by In-Cell Crystal Engineering |
| 著者 : | Thuc Toan Pham, Satoshi Abe, Koki Date, Kunio Hirata, Taiga Suzuki, and Takafumi Ueno |
| DOI : | 10.1021/acs.nanolett.3c02117 |
- 半分天然、半分人工の固体光合成材料を開発|生命理工学系 News
- 無細胞タンパク質合成を用いた迅速なタンパク質結晶の合成|生命理工学系 News
- 動画で見る東工大研究「タンパク質でつくる―次世代スマート材料」|生命理工学系 News
- 金属錯体が生まれ変わる分子のカゴ|生命理工学系 News
- 動いて並んでつながって。タンパク質が幾何学模様に!|生命理工学系 News
- 細胞が分子の3Dプリンターに?!|生命理工学系 News
- 7大学参加の研究グループ「コロナ制圧タスクフォース」発足|生命理工学系 News
- タンパク質分子の彫刻を創る|生命理工学系 News
- タンパク質カゴの中で踊る金原子を観る―タンパク質結晶を使った金属イオン集積過程の観察―|生命理工学系 News
- タンパク質用いて細胞内分子フィルターを開発―細胞内の解毒、細胞内在分子の構造解析への応用に期待―|生命理工学系 News
- 結晶の鎧まとう酵素?!―酵素の簡便な合成と長期保存を一挙に実現―|東工大ニュース
- 光で働く細胞内のカゴ状スイッチ―炎症抑制効果をもつたんぱく質の活性化とCOの関係を解明―|東工大ニュース
- 分子のカゴで毒を薬に ―癌の簡便な治療薬の開発につながる成果―|東工大ニュース
- 平成29年度「東工大挑戦的研究賞」授賞式を実施-独創性豊かな若手研究者に-|東工大ニュース
- 平成28年度手島精一記念研究賞授与式|生命理工学系 News
- 動く!並ぶ!つながる!みずからナノ模様をつくるタンパク質|YouTube
- 安部聡 Satoshi Abe|研究者検索システム 東京工業大学STARサーチ
- 上野隆史 Takafumi Ueno|研究者検索システム 東京工業大学STARサーチ
- 上野研究室
- 生命理工学院 生命理工学系
- 研究成果一覧