生命理工学系 News
【研究室紹介】 中村・岡田研究室
有機合成の力で生命機能を探る・操る・そして創薬へ

主担当 人間医療科学技術コース
副担当 生命理工学コース/ライフエンジニアリングコース
教授 中村浩之![]()

主担当 人間医療科学技術コース
副担当 生命理工学コース/ライフエンジニアリングコース
准教授 岡田智![]()
| キーワード | 有機化学、創薬化学ケミカルバイオロジー、がん治療、生体関連化学、分子イメージング、ケミカルバイオロジー |
|---|---|
| Webサイト | 中村・岡田研究室 |
研究紹介
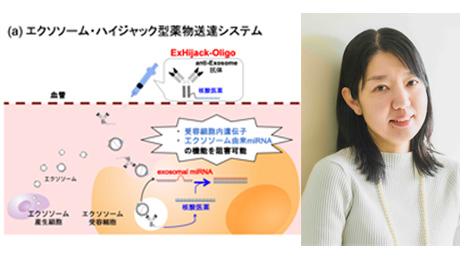
生体内微小環境で化学反応・生物応答を制御
私たちの研究室では、有機合成化学をベースに、新しいがん治療を目指した創薬研究、ケミカルバイオロジー研究分野における技術革新を目指した研究を展開しています。特に、がん細胞の低酸素環境や局所環境下での核反応などの生体内微小環境に着目した研究や、タンパク質表面での局所環境下で選択的に機能するタンパク質分子修飾法の開発等に取り組んでいます。中村・岡田研の研究は、金属触媒化学に立脚した新合成方法論開拓をはじめ、創薬科学、ケミカルバイオロジーといった境界領域の研究分野、さらに応用展開型研究として中性子捕捉療法を展開しており,それぞれの研究テーマは共通して有機合成化学によるものづくりから始まっています。
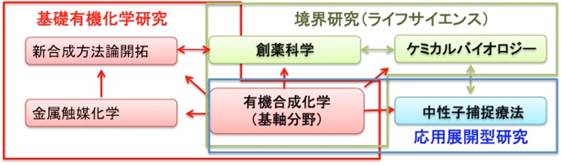
図1. 中村・岡田研の研究戦略
生物活性化合物や機能性分子をデザイン、有機合成し、得られた分子は自分たちの研究室で評価することによって、より優れた分子のデザインにフィードバックするといったスタイルで研究を展開しています。望みの化合物を有機合成するだけに留まらず、機能・活性評価の結果を有機化学的な視点によって考察する力を養うことで、有機合成を基盤とした革新的な研究技術・疾患治療戦略につながる研究を展開することを目指しています。
中村・岡田研究室は2013年9月に新しく立ち上がった研究室です。研究室では、向上心さえあれば、分子のデザイン・合成から、評価、新規な活性・機能性分子の創製に至るまでの研究課題を個人で遂行できるような研究・教育環境があります。有機化学と生物学の境界領域で、世界に先駆けた研究を一緒に展開してみませんか?
低酸素誘導因子(HIF)の阻害剤開発
正常組織においては、発達した血管網によって十分な酸素、栄養が供給されている一方で、固形腫瘍組織内では、酸素・栄養が不足していることから、血管網形成のために低酸素誘導因子(HIF: hypoxia inducible factor)- 1αによる血管新生因子の産生が強く亢進されています。このような経路を介してがん細胞の増殖や浸潤・転移を促進することから、低酸素下で誘導されるHIF-1αをがん分子標的とした阻害剤の研究開発が最近注目されており、私たちの研究室ではこのHIF-1α転写活性の阻害剤開発を目指した創薬化学研究を行っています。具体的には私たちが見出したHIF-1α阻害活性を持つ化合物をリードに、有機合成化学による構造展開を行い、自らで合成した化合物の活性評価をタンパク質・細胞レベルで解析します。得られた構造活性相関の情報を化合物デザインにフィードバックし、より高い活性化合物の創製を目指しています。また、活性化合物の細胞内標的をケミカルバイオロジーによる研究手法によって明らかにし、化合物が細胞内でどのような、相互作用、生物応答を引き起こすのかを解明しようとしています。
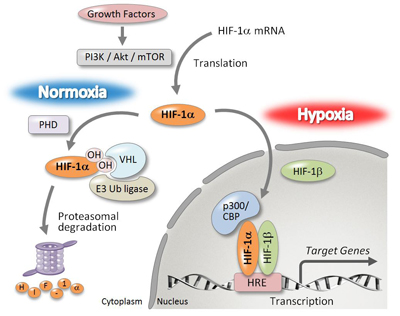
図2. HIF- 1αによる血管新生因子産生亢進メカニズム
これまでにも、がんの増殖に深く関与するHIF-1αの阻害剤研究は広く行われており、数多くの阻害剤が開発されていますが、作用メカニズムが不明なものも多く、また、細胞内でHIF-1αの機能を制御するタンパク質相互作用の全貌は未だ明らかになっていません。
その中で、中村・岡田研では、合成化合物の中で最強クラスの活性を示す化合物の創製、阻害剤作用機構の解明研究を進めています。現在までに世界的にもほとんど報告例のない、分子シャペロンHsp60の阻害剤や脱SUMO化酵素SENP1の阻害剤を見出し、これらのタンパク質のHIF-1α機能制御への関与を示すことにも成功しています。
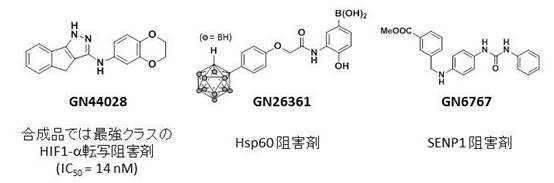
図3. 我々が開発したHIF-1α阻害剤
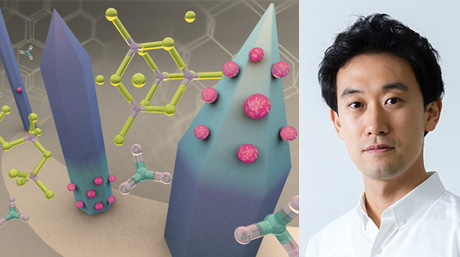
ホウ素中性子捕捉療法における次世代ホウ素ナノキャリアの開発
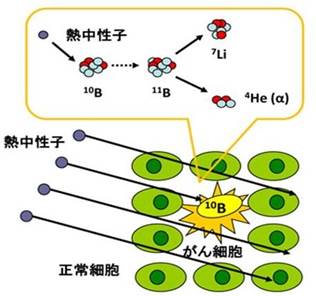
図4. ホウ素中性子捕捉療法の原理
ホウ素中性子捕捉療法(Boron Neutron Capture Therapy; BNCT)とは人体には無害の低エネルギー熱中性子をホウ素薬剤により捕捉させ、熱中性子とホウ素10(10B)との反応により、一細胞内の微小環境でリチウムとα線を発生させてがん細胞を破壊する新しいがん治療法です。
低エネルギーの熱中性子はエネルギーの高い高速中性子とは異なり、人体には無害ですが、熱中性子と10Bとの反応は、リチウムとヘリウム原子核(α線)を生じ、これらのエネルギーは2.4 MeVとおよそ1つの細胞を破壊するのに十分なエネルギーです(式1)。
10B + 1n → 7Li + 4He + 2.4 MeV (1)
がん治療の理想的な方法とは、正常組織に重大な障害を与えることなく、がん細胞を殺すことであり、BNCTによって有効な治療効果を得るためにはホウ素薬剤をがん細胞選択的にデリバリーする必要があります。
BNCTによるがん治療の概念
血管形成が未熟な腫瘍組織周辺にリポソームなどの微粒子が蓄積しやすいという効果(EPR効果)に基づき、腫瘍組織へのドラッグデリバリーシステムを活用しています。また、BNCTの臨床実用における大きな障害として、高濃度のホウ素薬剤をがん細胞に集積させる技術開発が挙げられます。そこで、私たちは高濃度の10Bをがん細胞に集積させるため、ホウ素含有リポソームを開発しています。
これまでに、マウスを用いた腫瘍モデルにおいては優れた治癒効果、延命効果を得ることに成功しています。その他にもアクティブターゲッティング法や、生体高分子のホウ素クラスター修飾に基づいた次世代ホウ素ナノキャリアの開発も行っています。
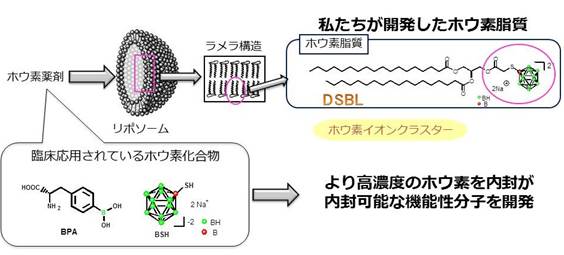
図5. ホウ素リポソーム開発の戦略とBNCT抗腫瘍効果
生体情報を可視化する磁性薬剤の開発
画像診断法であるMRIを用いると、生体深部を高い時空間分解能で可視化できます。さらに、MRI造影剤を有機化学的・生物工学的に改良し、分子プローブとして生体に投与すると、特定の生体分子を検出することもできます。我々は、基本骨格に刺激応答性ポリマーを有するMRIプローブが、立体構造に応じたユニークな機能を発現することを見出しました。これにより、投与量に依らず生体情報を定量可能なプローブの開発に成功しました。
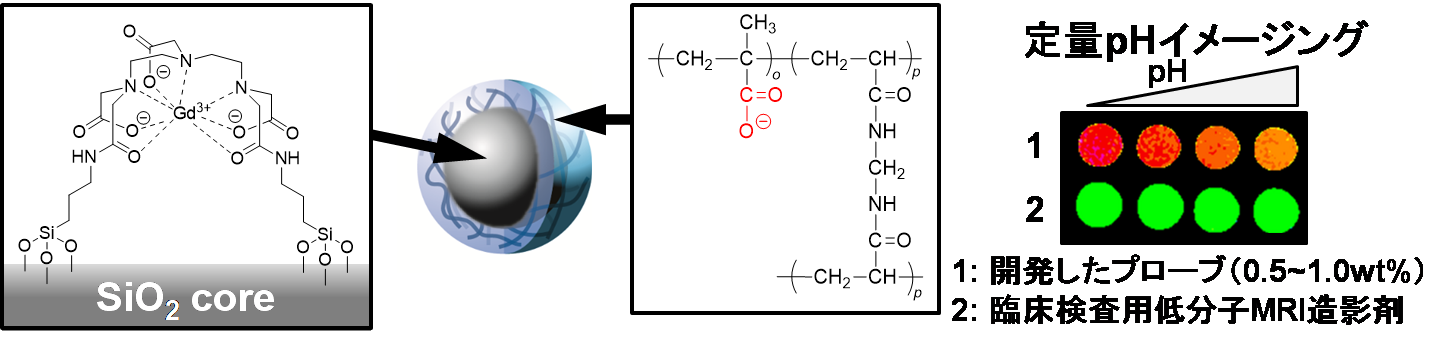
図6. 定量MRIプローブとpHイメージング
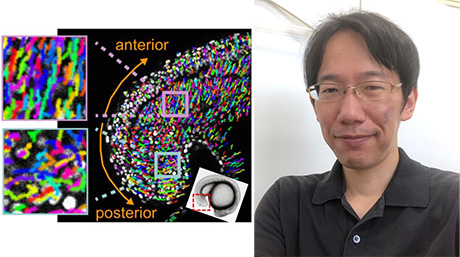
神経伝達物質のイメージングプローブは、高次脳機能の解明や神経疾患の治療法を確立する上で極めて有用なツールです。我々は、磁性ナノ粒子と組換えタンパク質の相互作用を利用し、カルシウムイオン、ドーパミン、セロトニンなどのシグナル伝達物質の動態をMRI信号へ変換するプローブを開発してきました。実際にプローブをモデル実験動物へ投与し、生きた脳内でカルシウムイメージングを達成しました。
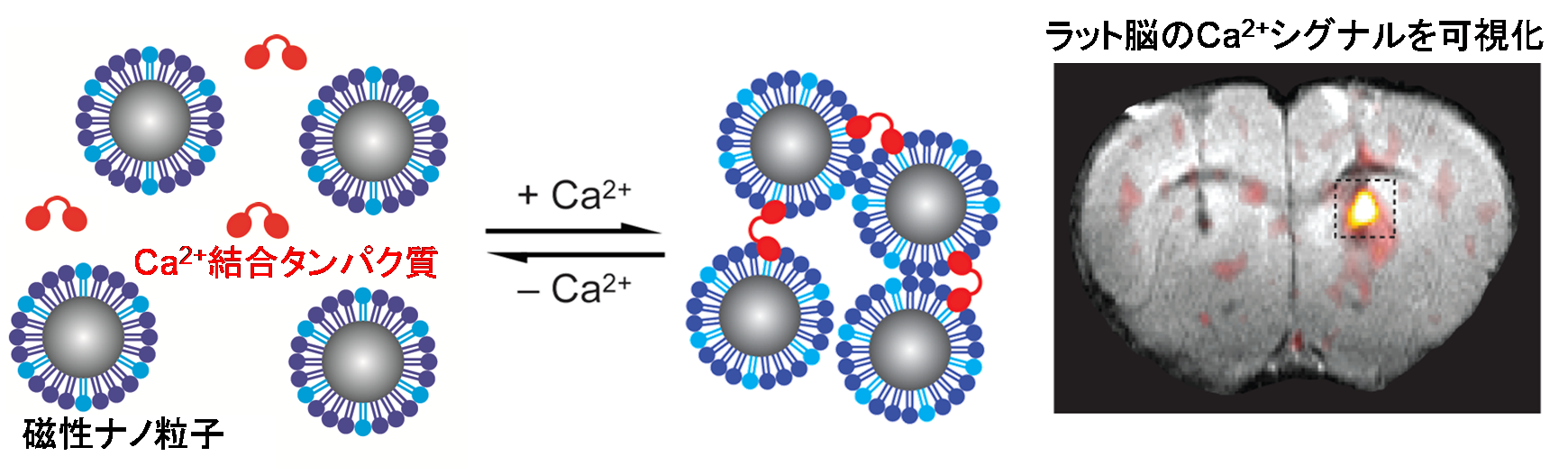
図7. カルシウムプローブによる脳内カルシウム動態のイメージング
ラジカル反応制御に立脚した局所的タンパク質分子修飾法の開発
私たちは短寿命のラジカル種をタンパク質分子修飾に応用する研究を展開しています。局所的な環境下においてラジカル反応を制御することで、タンパク質混合物の中から、目的のタンパク質を選択的にラベル化するという反応を開発しています。ケミカルバイオロジー研究分野における技術革新を狙った研究です。
タンパク質の分子修飾は生命科学の研究において有用な手法であるにもかかわらず、現在汎用されている手法はLys、 Cysといった求核性アミノ酸残基を求電子的な試薬により反応させて化学修飾させるといった方法に限られ、求電子的な反応以外の方法で天然のアミノ酸残基と特異的に効率良く変換を起こす反応の開発は挑戦的な課題であります。そのような背景の中で私たちはこれまで、化学修飾が難しいとされているアミノ酸残基への新規化学修飾法を開発すべく、ラジカル反応の制御という新たな切り口で取り組んでいます。また、私たちはこの化学修飾法をケミカルバイオロジー研究における低分子化合物の標的タンパク質同定にも応用することを目的に研究を展開しています。
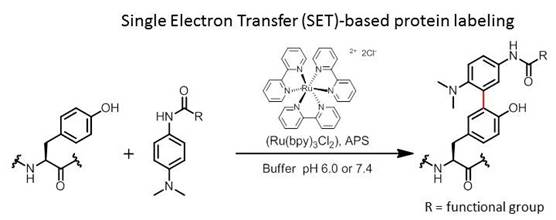
図8. Ru(bpy)3錯体を一電子酸化触媒として用いたTyr残基の化学修飾法
現在までに光触媒であるRu(bpy)3錯体を用いた一電子移動型の反応により、芳香族アミノ酸Tyrosine残基に対する修飾法開発に成功しています。N,N-dimethylamino-N'-acyl phenylenediamine構造がTyr残基と光触媒の活性化条件において効率的に縮合反応を起こすことを見出し、タンパク質のラベル化にも適用可能なチロシン残基の化学修飾法を開発しています。
また、一電子酸化触媒であるRu(bpy)3錯体にタンパク質親和性リガンドを共役させることで、この触媒はタンパク質の混在系においてもリガンドが標的とするタンパク質に選択的に結合し、その周辺でのみラジカル的なラベル化反応を触媒できることを明らかにしました。本研究の独創性の高い点は、タンパク質の混在系の中で任意のタンパク質上のアミノ酸残基にラジカル種を発生させ、制御できるといった点にあります。現在は、本技術によって得られたタンパク質のラジカル応答における興味深い挙動を対象とした研究を開始しています。
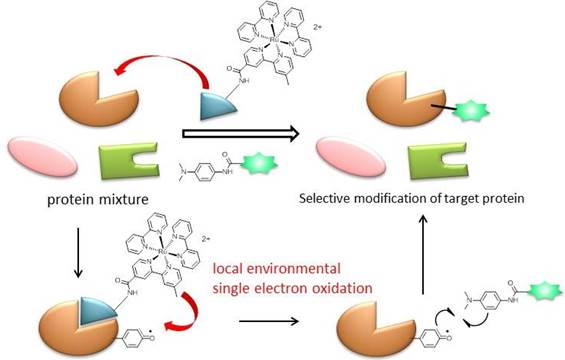
図9. リガンド結合型Ru光触媒による標的タンパク質選択的ラベル化法
研究成果
代表論文
最新の研究成果は、研究室サイト![]() をご参照ください。
をご参照ください。
- [1] "Site-Selective Protein Chemical Modification in Exposed Tyrosine Residues Using Tyrosine Click Reaction" S. Sato, M. Matsumura, T. Kadonosono, S. Abe, T. Ueno, H. Ueda, H. Nakamura, Bioconjugate Chem. accepted DOI: 10.1021/acs.bioconjchem.0c00120
 (2020).
(2020). - [2] “N-Methylated Peptide Synthesis through Acyl N-Methylimidazolium Cation Generation Accelerated by a Bronsted Acid” Y. Otake, Y. Shibata, Y. Hayashi, S. Kawauchi, H. Nakamura, S. Fuse, Angew. Chem. Int. Ed. accepted DOI: 10.1002/anie.202002106

- [3] "Rhodium(III)-Catalysed Carboxylate-Directed C-H Functionalizations of Isoxazoles with Alkynes" S. Yugandar, H. Nakamura, Chem. Commun. 55 (58), 8382-8385 (2019).
- [4] "Neurotransmitter-Responsive Nanosensors for T2-Weighted Magnetic Resonance Imaging" V. Hsieh, S. Okada, H. Wei, I. Garcia-Alvarez, A. Barandov, S. R. Alvarado, R. Ohlendorf, J. Fan, A. Ortega, A. Jasanoff, J. Am. Chem. Soc. 141 (40), 15751-15754 (2019).
- [5] "Gold(I)-Catalyzed Intramolecular SEAr Reaction: Efficient Synthesis of Isoxazole-Containing Fused Heterocycles" T. Morita, S. Fukuhara, S. Fuse, H. Nakamura, Org. Lett. 20 (2), 433-436 (2018).
- [6] "Calcium-Dependent Molecular FMRI Using a Magnetic Nanosensor" S. Okada, B. B. Bartelle, N. Li, V. Breton-Provencher, J. J. Lee, E. Rodriguez, J. Melican, M. Sur, A. Jasanoff, Nat. Nanotech. 13 (6), 473-477 (2018).
- [7] "Horseradish-Peroxidase-Catalyzed Tyrosine Click Reaction" S. Sato, K. Nakamura, H. Nakamura, ChemBioChem. 18 (5), 475-478 (2017).
- [8] "The Life of Pi Star: Exploring the Exciting and Forbidden Worlds of the Benzophenone Photophore" G. Dorman, H. Nakamura, A. Pulsipher, G. D. Prestwich, Chem. Rev. 116 (24), 15284-15398 (2016).
- [9]"Total Synthesis of Feglymycin based on a Linear/Convergent Hybrid Approach using Micro-flow Amide Bond Formation" S. Fuse, Y. Mifune, H. Nakamura, H. Tanaka, Nat. Commun. 7, 13491 (2016).
- [10] "Generation of 4-Isoxazolyl Anion Species: Facile Access to 4-Substituted Isoxazoles" T. Morita, S. Fuse, H. Nakamura, Angew. Chem. Int. Ed. 55 (43), 13580-13584 (2016).
- [11] "Maleimide-Functionalized closo-Dodecaborate Albumin Conjugates (MID-AC): The Unique Ligation at both Cysteine and Lysine Residues Enabling to Efficient Boron Delivery to Tumor for Neutron Capture Therapy" S. Kikuchi, D. Kanoh, S. Sato, Y. Sakurai, M. Suzuki, H. Nakamura J. Control. Release (237), 160-167 (2016).
- [12] "Synthesis of 2-Indolyltetrahydroquinolines by Zinc(II)-Catalyzed Intramolecular Hydroarylation-Redox Cross-Dehydrogenative Coupling of N-Propargylanilines with Indoles" G. Li, H. Nakamura, Angew. Chem. Int. Ed. 55 (23), 6758-6761 (2016).
- [13] "Hypoxia-Inducible Factor Inhibitors: A Patent Review (2011-2015)" S. Ban, Y. Uto, M. Won, H. Nakamura Exp. Opin. Ther. Pat. 26 (3), 309-322 (2016).
- [14]"Tyrosine-Specific Chemical Modification with in situ Hemin-Activated Luminol Derivatives" S. Sato, K. Nakamura, H. Nakamura, ACS Chem. Biol. 10 (11), 2633-2640 (2015).
- [15] "Methyl 3-((6-methoxy-1,4-dihydroindeno[1,2-c]pyrazol-3-yl)amino) benzoate (GN39482) as a Tubulin Polymerization Inhibitor Identified by MorphoBase and ChemProteoBase Profiling Methods" H. Minegishi, Y. Futamura, S. Fukashiro, M. Muroi, M. Kawatani, H. Osada, H. Nakamura, J. Med. Chem. 58 (10), 4230-4241 (2015).
- [16] "Boron-Based Drug Design" H. S. Ban and H. Nakamura, Chem. Rec. 15 (3), 616-635 (2015)
- [17] "Ligand-directed Selective Protein Modification Based on Local Single Electron Transfer Catalysis" S. Sato, H. Nakamura, Angew. Chem. Int. Ed. 52 (33) 8681-8684 (2013).
- [18] "Zinc(II)-Catalyzed Redox Cross-Dehydrogenative Coupling of Propargylic Amines and Terminal Alkynes for Synthesis of N-Tethered 1,6-Enynes" T. Sugiishi, H. Nakamura, J. Am. Chem. Soc. 134 (5) 2504-2507 (2012).
- [19] "Identification of HSP60 as a Primary Target of ortho-Carboranylphenoxyacetanilide, an HIF-1α Inhibitor" H. S. Ban, K. Shimizu, H. Minegishi, H. Nakamura, J. Am. Chem. Soc. 132 (34), 11870-11871 (2010).
- [20] “Copper(I)-Catalyzed Substitution Reactions of Propargylic Amines: Importance of Csp-Csp3 Bond Cleavage in Generation of Iminium Intermediates” T. Sugiishi, A. Kimura, H. Nakamura, J. Am. Chem. Soc. 132, 5332-5333 (2010).
教員紹介
中村浩之 教授 博士(理学)
- 学歴
| 1991年3月 | 東北大学 理学部化学科 卒業 |
|---|---|
| 1993年3月 | 東北大学 大学院理学研究科 化学専攻 博士前期課程 修了 |
| 1993年4月 | 日本学術振興会 特別研究員 |
| 1995年2月 | 東北大学 大学院理学研究科 化学専攻 博士後期課程2年 中退 |
| 1996年9月 | 博士(理学)取得(東北大学) |
- 職歴
| 1995年3月 | 東北大学 大学院理学研究科 化学専攻・助手 |
|---|---|
| 1995年4月 | 九州大学 有機化学基礎研究センター・助手(流動部門) |
| 1997年4月 | 東北大学 大学院理学研究科 化学専攻・助手 |
| 2000年4月 | 文部省在外派遣研究員(米国Pittsburgh大学・D.P.Curran教授) |
| 2002年4月 | 学習院大学 理学部化学科 助教授 |
| 2006年4月 | 学習院大学 理学部化学科 教授 |
| 2008年4月 | 学習院大学 大学院自然科学研究科 生命科学専攻 教授(兼任) |
| 2013年9月 | 東京工業大学 資源化学研究所 教授 |
| 2015年10月 | 日本中性子捕捉療法学会 会長就任 |
| 2016年4月より | 東京工業大学 科学技術創成研究院 化学生命科学研究所 教授 |
- 受賞
| 1999年3月 | 日本化学会進歩賞 |
|---|---|
| 2007年7月 | がん分子標的治療学会奨励賞 |
- 所属学会
- 日本化学会、日本薬学会、有機合成化学協会、日本中性子捕捉療法学会、日本がん分子標的治療学会、アメリカ化学会、日本複素環化学会、日本DDS学会、日本ケミカルバイオロジー学会、がんとハイポキシア研究会
岡田智 准教授
- 学歴
| 2007年3月 | 大阪大学 工学部応用自然科学科 卒業 |
|---|---|
| 2009年3月 | 大阪大学 大学院工学研究科 生命先端工学専攻 博士前期課程 修了 |
| 2012年3月 | 大阪大学 大学院工学研究科 生命先端工学専攻 博士後期課程 修了 博士(工学)取得 |
- 職歴
| 2010年4月 | 日本学術振興会 特別研究員(DC2) |
|---|---|
| 2012年4月 | 米国MIT 生物工学科 博士研究員 |
| 2012年4月 | 上原記念生命科学財団 ポストドクトラルフェロー |
| 2013年4月 | 日本学術振興会 海外特別研究員 |
| 2018年4月 | 産業技術総合研究所 生命工学領域 健康工学研究部門 研究員 |
| 2018年10月 | 科学技術振興機構 さきがけ研究員(兼任) |
| 2020年4月より | 東京工業大学 科学技術創成研究院 化学生命科学研究所 准教授 |
- 受賞
| 2016年 | World Molecular Imaging Congress 2016 Travel Stipend Award |
|---|---|
| 2017年 | 第12回日本分子イメージング学会総会・学術集会 FASMI Young Investigator Travel Award |
| 2017年 | The Federation of Asian Societies for Molecular Imaging 2017 優秀発表賞 |
| 2019年 | 日本化学会第99春季年会 優秀講演賞(学術) |
- 所属学会
- 日本化学会、日本ケミカルバイオロジー学会、日本分子イメージング学会、日本神経科学学会、日本分子生物学会
教員からのメッセージ
- 中村教授より
-
現在、がんをはじめまだ特効薬のない病気があり、21世紀の医薬開発における生理活性分子の創製には、従来の研究とは異なるアプローチが必要です。我々の研究室では、医薬素材として生体内に存在しないホウ素元素に着目し、これを導入した新しい生理活性分子の創製を目的として研究を進めています。また、標的タンパクに特異的に作用する生理活性分子を設計・合成するだけでなく、合成した化合物の標的タンパクへの相互作用についても分子生物学的手法を用いて調べ、構造活性相関を解明し、さらなる分子設計を行っています。本研究室では有機化学を基軸として分子生物学との境界領域に挑戦しており、「新薬創製」という大きな夢に向かって日夜研究に励んでいます。
- 岡田准教授より
-
生命医学研究において、生体を可視化する技術は、シンプルでありながら最も説得力のある研究手法です。我々の研究室では、有機化学に生物工学的なアプローチを加え、生体分子の動きを可視化・制御する薬剤を開発しています。合成した化合物は、我々自らの手で生物実験により評価し、より強固な機能を持たせることで、基盤技術としての普及を目指します。基礎開発から生物応用までを一貫して行える充実した研究環境のもと、自分オリジナルの分子で新たな世界を切り拓いてみませんか?
研究室メンバー
- 研究室と研究テーマ
- 副反応を起こしやすいアミノ酸を迅速かつクリーンに連結|生命理工学系 News
- 中性子捕捉療法のための有望なホウ素薬剤を開発|生命理工学系 News
- 東京工業大学 科学技術創成研究院 化学生命科学研究所
お問い合わせ先
教授 中村浩之
すずかけ台キャンパス R1棟 914号室
E-mail : hiro@res.titech.ac.jp
准教授 岡田智
すずかけ台キャンパス R1棟 913号室
E-mail : sokada@res.titech.ac.jp
※この内容は掲載日時点の情報です。最新の研究内容については研究室サイト![]() をご覧ください。
をご覧ください。
※ 2025年5月1日:一部最新の情報に更新しました。