生命理工学系 News
中性子捕捉療法のための有望なホウ素薬剤を開発
マウスのがんで、高い治療効果を確認
要点
- 生理的条件下でタンパク質のシステイン残基だけでなくリジン残基に結合するホウ素クラスター結合マレイミドを開発。
- がん集積性タンパク質である血清アルブミンやトランスフェリンにホウ素クラスターを導入。
- 患者の血清アルブミンやトランスフェリンをホウ素キャリヤに使用可能。
概要
東京工業大学 科学技術創成研究院 化学生命科学研究所の中村浩之教授(ライフエンジニアリングコース主担当)らは、ホウ素中性子捕捉療法(BNCT)[用語1]において、多量のホウ素分子を腫瘍内に簡便に導入する手法「ホウ素クラスター結合マレイミド(MID)」[用語2]を開発した。MIDがこれまで知られていたタンパク質のシステイン残基のSH基[用語3]だけでなく、リジン残基[用語4]にも結合することを見出して実現した。
この発見により、がん集積性タンパク質である血清アルブミン[用語5]や、鉄輸送タンパク質であり多くのがん細胞でその受容体が高発現しているトランスフェリン[用語6]に対して、多量のBNCT用ホウ素薬剤を容易に導入できるようになった。
MIDを結合させた血清アルブミンは皮下腫瘍移植マウスにおいて脾臓、肝臓、腎臓などの臓器には低濃度で集積するのに対し、腫瘍内に非常に高濃度で集積することを確かめた。BNCTによる次世代がん治療の発展に貢献すると期待される。本研究成果は、7月12日発行のJournal of Controlled Releaseオンライン版に掲載された。
研究成果
これまでのマレイミド化合物はシステイン残基のSH基に選択的に結合することが知られているが、東工大の中村教授らが開発したホウ素クラスター結合マレイミドは生理的条件下で、リジン残基にも結合することを見出した。これより、がん集積性タンパク質である血清アルブミン(フリーのシステイン残基は1つ)や、鉄輸送タンパク質であり多くのがん細胞でその受容体が高発現しているトランスフェリン(システイン残基を持たない)に対して、ホウ素クラスターを導入することに成功した。
この技術を用いれば、患者から採取した血清アルブミンやトランスフェリンに容易にMIDの導入が可能となり、血液製剤が持つ血友病などの危険性もなく治療の操作や扱いなどが簡便化し、使い勝手が良くなる。それだけでなく、単回投与が可能であり薬剤投与量も削減できるため、患者にとっても経済的ならびに身体的な負担が軽減されることが期待される。
MID-アルブミンコンジュゲート[用語7]は、一度の注射によって腫瘍内へ十分な量のホウ素を導入可能なため、30分程度の中性子照射時間において、腫瘍内ホウ素濃度が維持できる。その結果、bioavailability(バイオアベイラビリティ=生物学的利用能)が向上し、ホウ素薬剤の投与量が削減できる。さらに生体内分布をより正確に把握できるため、その優位性は非常に高く、BPA[用語8]に非感受性がん患者に対するNCT適応疾患拡大の実現が期待される。
実際に、MID-アルブミンコンジュゲートを大腸がん皮下移植マウスに投与したところ、腫瘍内に非常に高選択性・高濃度でホウ素が集積することが分かった。さらに京都大学原子炉実験所の鈴木実教授、櫻井良憲准教授との共同研究で熱中性子照射実験を行った結果、非常に高い治療効果を見出した。
研究の背景
固形がんの治療では外科手術、放射線治療、化学療法を複合することにより個々の患者に合った治療が行われている。開腹手術といった高侵襲の治療が必要な場合は、患者は長期間の入院を余儀なくされ、体力的負担、生活の質(QOL)の低下が問題となる。低侵襲な治療法の開発は社会あるいは日常生活への速やかな復帰を促進することに繋がり、2人に1人ががんを患う高齢化社会の日本において国民が健康で充実したQOLの高い生活を送り、また医療費の抑制のために大きな貢献をもたらすと期待される。
新しい低侵襲治療法の1つであるBNCTは、低エネルギーである熱・熱外中性子がホウ素との核反応により生ずる強力な粒子線を用いるものであり、がん部位へホウ素デリバリーと中性子線のダブルターゲティングが可能である。
低毒性のホウ素化合物を用いるため化学療法や放射線療法に比べ、正常組織へのダメージがきわめて低い。これまで、ホウ素薬剤ボロカプテイト(Na2B12H11SH:BSH)およびアミノ酸誘導体であるホウ素薬剤パラボロノフェニルアラニン(BPA)が、照射治療計画用PET診断には18F-BPAが用いられてきた。
これまで、熱中性子は原子炉から得ていたため、BNCT普及の障害となっていたが、2010年に世界初のBNCT用加速器が我が国で開発されてから、一般的治療法の1つとして可能性が期待され、ホウ素薬剤BPAを用いた脳腫瘍ならびに頭頚部腫瘍の第2相臨床試験が現在進められている。
研究の経緯
BNCTはがん細胞選択的に効果的濃度のホウ素薬剤を送り込むかが治療効果のカギとなる。BNCTは中性子照射台に20~30分横たわっているだけで治療できる非常に低侵襲でQOLの高い細胞選択的な放射線療法である。BNCT用の加速器は非常に小型であり、現在臨床試験が進められている加速器BNCTが実現できれば、患者や医療関係者はわざわざ原子炉に行く必要がなく、大都市の病院内でも治療が受けられるようになる。現在臨床試験中のBPAは血中滞留性が低いため、医療現場では照射中の持続投与が採用されているのが現状である。
一方、血清アルブミンに抗がん剤を結合させた薬剤開発が精力的に行われてきた。実際に抗がん剤であるパクリタキセルを結合させたナノ粒子「Abraxane」が、2005年に転移性乳がん治療薬として米国で認可され(日本は2010年に認可)、さらに難治性がんである再発胃がんや進行性非小細胞肺がん、膵臓がん治療にも用いられている(ASCO 2009)。また、血清アルブミンは脳腫瘍にも選択的に取り込まれることから、脳腫瘍の外科的手術のナビゲーション治療用に、蛍光ラベル化アルブミン薬剤が臨床試験中である(J.Clin. Pharmacol. 2011)。
今回の研究では、こういった血清アルブミンのがん集積性を利用した低毒性で血中滞留性の高いホウ素薬剤を医療現場に提供することを目的に、単回投与が可能であり薬剤投与量の軽減可能な次世代ホウ素薬剤を開発した。
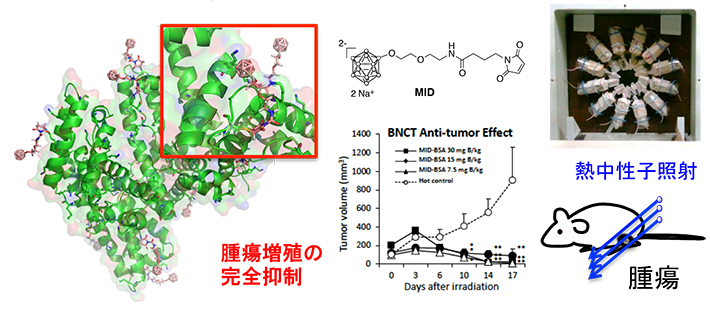
図. MID-アルブミン製剤による高いBNCT抗腫瘍効果
今後の展開
血清アルブミンに抗がん剤を結合させた薬剤が、転移性乳がんや膵臓がん治療薬、あるいは脳腫瘍の外科的手術のナビゲーション治療用に用いられてきた。このことから、本研究で開発したMID-アルブミンコンジュゲートは、難治性がんの1つである脳腫瘍あるいは膵臓がんに適応可能かどうか、疾患モデルマウスを用いて検証していく。
用語説明
[用語1] ホウ素中性子捕捉療法(BNCT) : 低エネルギーである熱・熱外中性子がホウ素との核反応により生ずる強力な主にα線によりがんを殺傷する放射線治療法の1つであり、がん部位へホウ素デリバリーと中性子線のダブルターゲティングが可能である。
[用語2] ホウ素クラスター結合マレイミド(MID) : マレイミドはタンパク質のシステイン残基がもつSH基に生理的条件下で結合するが、ホウ素12個からなる2価の負電荷をもつホウ素クラスターに化学結合させた「ホウ素クラスター結合マレイミド(MID)は、通常生理的条件下では反応しないリジン残基にも結合することを今回見出した。
[用語3] タンパク質のシステイン残基のSH基 : タンパク質内に含まれるシステイン残基は、S−S結合を形成してタンパク質の三次元構造に寄与しているものとフリーのSH基を持つものがある。
[用語4] リジン残基 : 通常の生理的条件下ではプロトン化されており正電荷を帯びておるため、マレイミドとは反応しない。
[用語5] 血清アルブミン : 血清中に存在するタンパク質の一つで、分子量約66,000。血清アルブミンは血清中タンパク量の約50~65%を占める。
[用語6] トランスフェリン : 血漿に含まれるタンパク質の一つで、鉄イオンを結合しその輸送を担っている。がん細胞の多くは、このトランスフェリン受容体が過剰発現している。
[用語7] MID-アルブミンコンジュゲート : ホウ素クラスター結合マレイミド(MID)を中性条件下で血清アルブミンと化学結合させたもの。腫瘍内に非常に高濃度で集積することを今回見出した。
[用語8] BPA : パラボロノフェニルアラニンの略名。現在我が国では、BPAを用いて、加速器BNCTの脳腫瘍ならびに頭頚部腫瘍の第2相臨床試験が進められている。
論文情報
| 掲載誌 : | Journal of Controlled Release |
|---|---|
| 論文タイトル : | Maleimide-Functionalized closo-Dodecaborate Albumin Conjugates (MID-AC): The Unique Ligation at both Cysteine and Lysine Residues Enabling to Efficient Boron Delivery to Tumor for Neutron Capture Therapy |
| 著者 : | S. Kikuchi, D. Kanoh, S. Sato, Y. Sakurai, M. Suzuki, H. Nakamura* |
| DOI : | 10.1016/j.jconrel.2016.07.017 |
問い合わせ先
東京工業大学 科学技術創成研究院 化学生命科学研究所
教授 中村浩之
Email : hiro@res.titech.ac.jp
Tel : 045-924-5244 / Fax : 045-924-5976(研究所事務室)