生命理工学系 News
酵素断片の「トラップ&リリース」に基づく抗原依存的酵素スイッチ
任意の分子によるタンパク質機能の自由自在な制御を目指して
ポイント
- 抗原依存的に酵素活性が上昇する酵素断片融合抗体「Switchbody」を開発
- 酵素断片が抗体にトラップされ抗原結合でリリースする機構を解明
- 細胞生理機能の自在制御が可能になり、生命現象の解明や医療応用、バイオプロセスの精密化へ
概要
東京科学大学(Science Tokyo)総合研究院 化学生命科学研究所の北口哲也准教授(人間医療科学技術コース 主担当)と安田貴信助教(人間医療科学技術コース 主担当)らの研究チームは、東北大学 多元物質科学研究所の田口真彦助教、理化学研究所の木川隆則博士、信州大学の新井亮一教授と共同で、抗体に酵素の断片を融合させることにより、抗原に応答して活性が上昇する酵素スイッチ「Switchbody」 を開発しました。
タンパク質は多様な機能を持ち、さまざまな生命現象に関与しています。その中でも、外的刺激に応答してオン・オフのスイッチとして機能するタンパク質は、細胞生理機能を動的に制御する上で重要な役割を果たします。このスイッチ機能を人工的に設計・構築できれば、生命現象の分子メカニズムの解明だけでなく、病気の治療やバイオプロセスの精密制御といった幅広い分野への応用が期待できます。
本研究では、スイッチ機能を追加するモデルタンパク質として生物発光酵素NanoLuc[用語1]を採用し、任意の分子の添加で酵素活性を上昇させることを試みました。具体的には、NanoLuc由来の11残基のアミノ酸断片を抗体の抗原結合部位の近くに融合し、抗原を酵素活性で検出できる設計としました。抗原が結合すると、抗体にトラップされていた酵素断片がリリースされ、このときにNanoLucから11アミノ酸断片を切り出した後に残った断片が存在すると、断片同士の相互作用によって酵素が再構成して活性が上昇する仕組みです。さらに、この仕組みを利用した免疫測定法の開発にも成功しました。また、この酵素断片の"トラップ&リリース"機構の詳細をELISA[用語2]やX線結晶構造解析[用語3]、NMR解析[用語4]、MDシミュレーション[用語5]で多角的に明らかにし、Switchbodyの合理的設計に関する手掛かりを得ました。将来的に、細胞内シグナルに関わる酵素とさまざまな抗体からSwitchbody を作製し、化学遺伝学ツール[用語6]として多様な抗原による複数の細胞生理機能の同時操作を目指します。
本成果は、2025年9月15日付(現地時間)の「Advanced Science」誌にオンライン掲載されました。
背景
生体内の特定のタンパク質は、リガンドとの結合や膜電位、pH、温度などの外部環境に応答して、細胞内および細胞間のシグナル伝達を制御し、代謝、免疫応答、細胞増殖、神経活動など、さまざまな生命現象に深く関与しています。従って、タンパク質の機能を自在に制御できれば、生命現象に対する理解の深化につながるだけでなく、破綻した細胞生理機能を回復することで病気の治療に貢献したり、発酵や細胞培養などのバイオプロセスを精密に制御し、工業的応用にも大きく役立てたりすることができます。
これまでにもDREADD[用語7]という人工のリガンドで機能を制御できる人工の細胞膜受容体を利用したタンパク質スイッチが開発されており、化学遺伝学ツールとして生命現象の解明に大きく貢献しています[参考文献1]。このツールを活用すれば、細胞生理機能の操作にとどまらず、マウスやサルなどの個体における食欲や運動量などの行動をコントロールできることも報告されています[参考文献2]。しかしながら、DREADDには人工リガンドの種類が限られていることや、制御可能な細胞内シグナル分子が限定的であることなど、いくつか課題が挙げられていました。
研究成果
本研究では、抗体に酵素断片を融合させることで、抗原に応答して活性が上昇する酵素スイッチ「Switchbody」を開発しました。スイッチの入力部分に相当する分子認識部位に抗体を利用することで、任意の分子を用いた酵素活性の制御が可能であり、さらに、制御する酵素を取り換えることで、注目する細胞内シグナル分子や代謝分子の合成を通じて、細胞生理機能を自在に操作できるため、拡張性の高い技術として期待されます。
Switchbodyとして、発光酵素NanoLuc由来の11アミノ酸断片であるHiBiT[参考文献3]を、抗体KTM219の一本鎖抗体断片scFvのN末端側に融合させたタンパク質を設計し、酵素活性で抗原を検出できるかどうかを検討しました。KTM219は、骨粗鬆症のマーカーであるオステオカルシン(BGP)のC末端の7アミノ酸BGP-C7(アミノ酸配列:RRFYGPV)を抗原として認識する抗体です。この酵素断片融合抗体の分子デザインは、私たちがこれまでに開発してきた蛍光免疫センサーQ-bodyに着想を得ています。Q-bodyは抗体のN末端側に蛍光色素を修飾することで作製されます。この蛍光色素は抗原結合部位近傍でトラップされ消光状態となりますが、抗原の結合に伴ってリリースされることで蛍光を発します[参考文献4]。この原理に倣い、Switchbodyでは抗体に融合した酵素断片がトラップされますが、抗原との結合によりリリースされると、残りの酵素断片と相互作用することで酵素が再構成されて活性を示すことを想定しました(図1A)。
実際にSwitchbodyを大腸菌で発現させたあと精製し、NanoLuc由来のもう一方の酵素断片であるLgBiTと基質であるフリマジンの存在下で発光強度を測定したところ、抗原濃度依存的にシグナルの増大が確認されました(図1B)。この増大は市販のカメラでも明瞭に検出できるほど顕著であり、Switchbodyが簡便に利用できる生物発光免疫センサーとして、応用展開し得ることが示されました(図1C)。
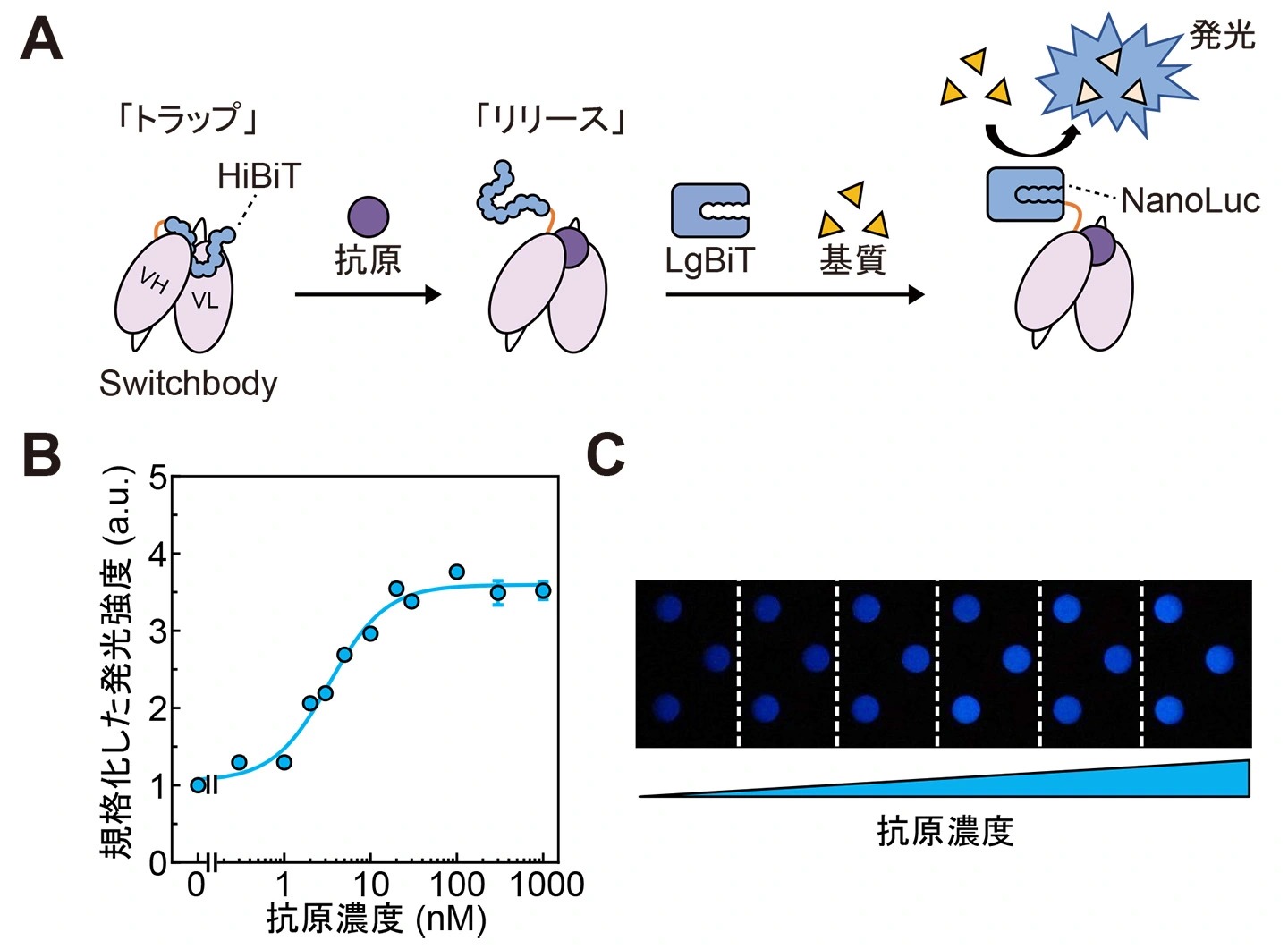
図1.
(A)Switchbodyの模式図(B, C)抗原を添加したときのSwitchbodyの発光強度変化(DOI:10.1002/advs.202508422![]() より一部改変)
より一部改変)
続いて、Switchbodyが想定通りの作動原理で機能しているかどうかを検証するため、LgBiTを固相化したELISAを実施しました(図2)。抗原濃度依存的なシグナルの増加が確認され、抗原が存在すると抗体に融合されたHiBiTが固相化されたLgBiTと相互作用しやすくなると考えられました。すなわち、抗体にトラップされていた酵素断片が抗原結合によってリリースされるという、想定した作動原理が実際に機能していることを支持する結果となりました。さらに、X線結晶構造解析の結果、抗体に融合されたHiBiT由来の電子密度の分布が確認できなかったことから、抗体の特定の部位ではなく複数の部位と相互作用していること、また、NMR測定の結果からは、抗原存在下でHiBiTの運動性が顕著に高まることが示唆されました。
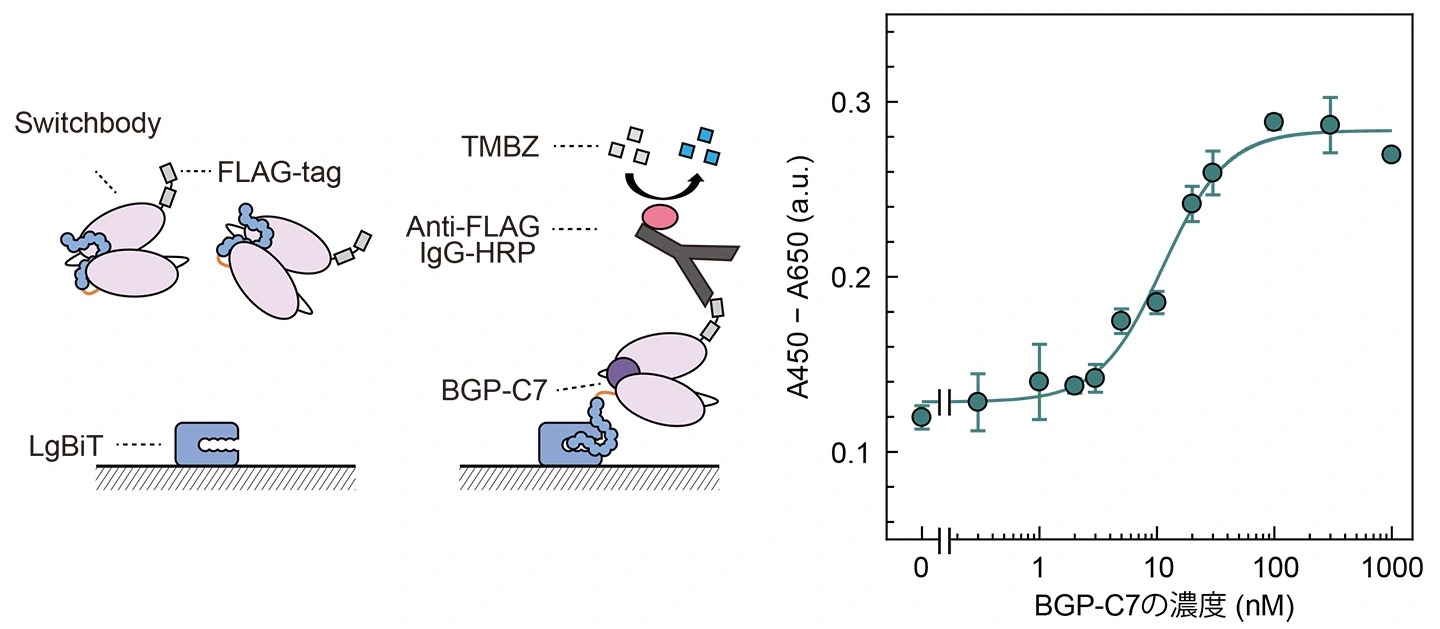
図2.
固相化されたLgBiTに対するSwitchbodyの結合の模式図と、抗原を添加したときの結合の変化(DOI:10.1002/advs.202508422![]() より一部改変)
より一部改変)
HiBiTの抗体へのトラップについて、具体的にどのような相互作用でトラップが引き起こされているかを調べるためにMDシミュレーションを実施し、抗原非存在下でscFvのアミノ酸残基のうちHiBiTと高頻度で接近する残基を8カ所予測しました。この8つのアミノ酸をそれぞれアラニン(Ala)に置換したSwitchbodyを作製してLgBiTを固相化したELISAで評価することで、変異導入前と比較してシグナルが有意に高い、すなわち変異導入によりHiBiTのscFvへのトラップが弱まっていると考えられる5つの変異体を選択しました。その中でも、抗体の重鎖の52番目のアスパラギン酸(Asp52H)をAlaに置換した変異体は、変異導入前や他の変異体と比較して、抗原非存在下で最も高い発光強度を示したことから(図3A)、Alaへの置換によってHiBiTの9番目のリシン(Lys9)との静電相互作用(図3B)が解消されることでトラップが弱まったと考えられました。一方、抗原存在下でSwitchbodyの発光強度が増大する理由としては、抗原がAsp52Hと相互作用することで、Lys9の静電相互作用の相手が失われて、HiBiTがリリースされるためと推測されました(図3C)。これらの知見は、抗原結合によって活性がオンになるタンパク質スイッチを自在に作製する技術を確立するための重要な手掛かりとなると期待されます。
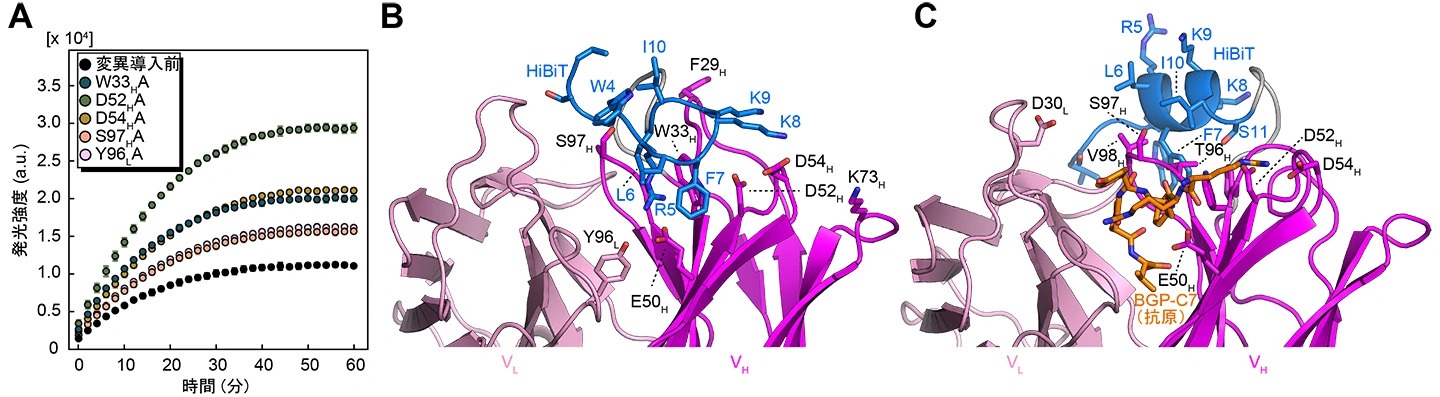
図3.
(A)酵素断片との相互作用が予測されるアミノ酸に変異を導入したSwitchbodyの時間依存的な発光強度変化(B, C)MDシミュレーションによる、抗原BGP-C7が無いとき、または有るときのSwitchbodyの構造(DOI:10.1002/advs.202508422![]() より一部改変)
より一部改変)
最後に、Switchbodyの作動原理が抗体の種類を変えても成立するかを検証しました。効率よく検証するために、抗体の軽鎖に強く結合するProtein M(PM)[用語8] [参考文献5](図4A)のC末端側にHiBiTを融合したPM-HiBiTを作製して抗体と混合し、HiBiTが抗体にトラップされ、抗原結合によりリリースされるかどうかを確認しました(図4B)。抗BGP抗体KTM219、抗TARGET-tag抗体P20.1、抗チロキシン抗体ME.125の3種類の抗体を用いて検証したところ、いずれの抗体においても抗原濃度依存的に発光強度が増大しました(図4C–E)。興味深いことに、P20.1はKTM219においてHiBiTとの静電相互作用に重要であったAsp52Hを欠いているにもかかわらず、抗原濃度依存的に酵素活性が上昇しました。これは、酵素断片と抗原結合部位近傍のアミノ酸との相互作用が静電相互作用に限定されず、多様な様式で相互作用し、抗原結合に伴ってリリースされ得ることを示しています。つまり、抗体のN末端側に酵素断片を融合するだけで抗原濃度依存的に酵素活性を上昇させる仕組みを構築できる可能性が示されました。一方、未発表ではありますが、NanoLuc以外の酵素を使ってもSwitchbodyを作製できることが判明しており、今後、さまざまな酵素と抗体との組み合わせで多様なSwitchbodyを作製していく予定です。
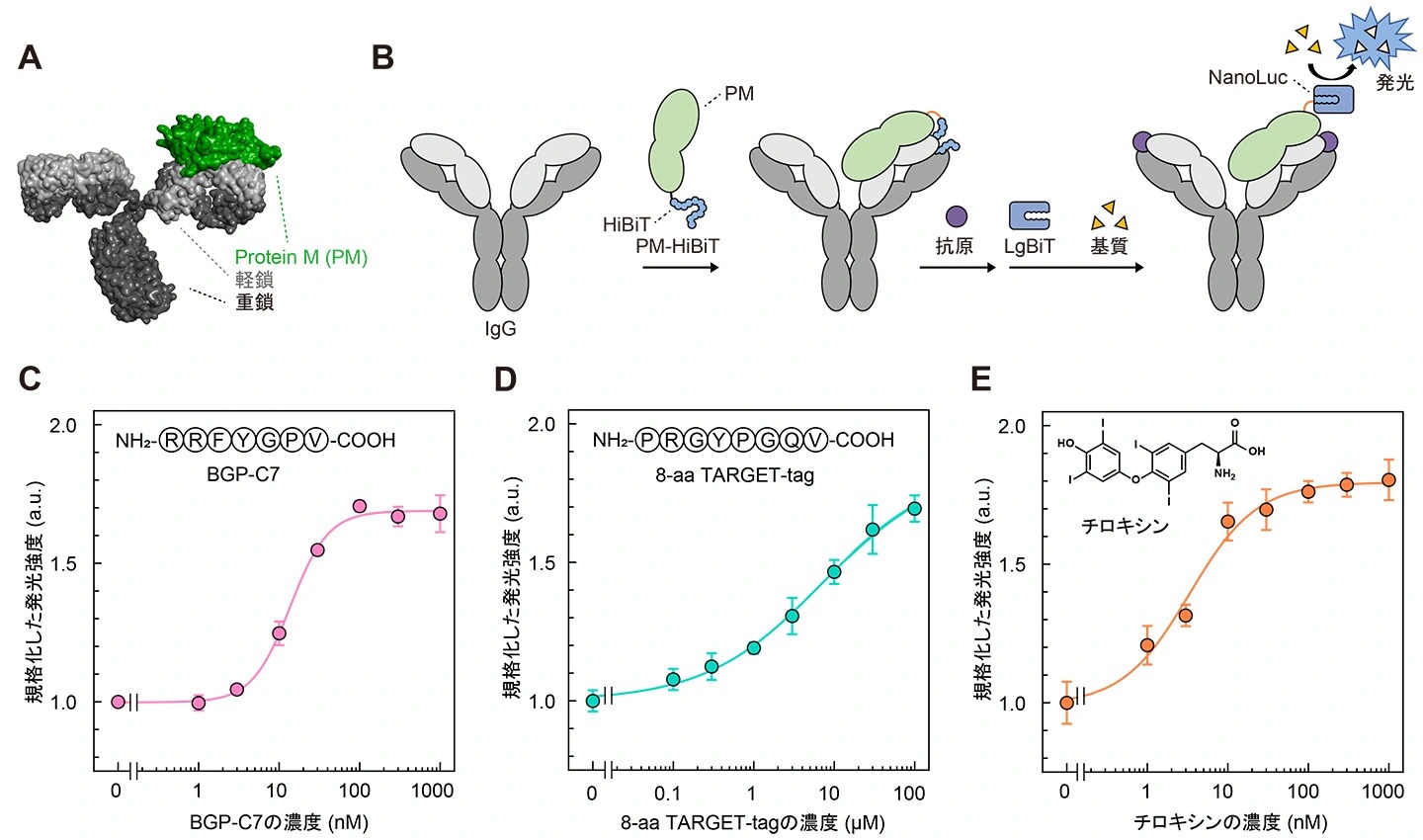
図4.
(A)結晶構造(PDB ID:4NZR, 1IGT)をもとに作製したPM/抗体複合体のモデル構造(B)PMに融合されたHiBiTの抗体によるトラップと抗原結合によるリリースの模式図(C–E)PM-HiBiT/抗体複合体に抗原を添加したときの発光強度変化(DOI:10.1002/advs.202508422![]() より一部改変)
より一部改変)
社会的インパクト
Switchbodyにより、タンパク質の機能を任意の分子によって制御する道が拓かれました。これは、新たな作動原理に基づく免疫測定法としてだけでなく、独自の化学遺伝学ツールの創出としても位置付けられ、生命現象の理解を深めることに貢献していくと考えられます。また、疾患はしばしば細胞生理機能の破綻に起因するため、これらの機能を特定の薬剤で回復させる革新的な治療法の開発にも応用可能です。さらに、代謝酵素や細胞増殖を制御することで、バイオプロセスにおける目的産物の収率向上も可能となるでしょう。このようにSwitchbodyは生命現象の理解の深化、医療への貢献、バイオプロセスへの応用など幅広い用途での活用が期待されます。
今後の展開
本研究で示した、酵素断片のトラップ&リリースを作動原理とする酵素スイッチSwitchbodyは、さまざまな抗体で作製可能であり、さらにNanoLuc以外の酵素へも拡張できます。今後は、その応用展開の第一歩として、細胞内シグナル分子や代謝分子の合成酵素を用いてSwitchbodyを構築し、それを細胞内環境で機能させることで、細胞生理機能を任意の分子によって自在に操作することを目指します。
- 付記
本研究は、科学研究費助成事業(JP23K13607、JP19H02522、JP18H03851、JP24K01264)、笹川科学研究助成(2024-3031)、人と知と物質で未来を創るクロスオーバーアライアンス(JP2024Y008)、物質・デバイス領域共同研究拠点「共同研究プログラム」の支援を受けて行われました。
- 参考文献
- [1] B.N. Armbruster, X. Li, M.H. Pausch, S. Herlitze, B.L. Roth "Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand" Proc. Natl. Acad. Sci. 104, 5163 (2007). DOI: 10.1073/pnas.0700293104
- [2] J. Bonaventura, M.A.G. Eldridge, F. Hu et al. "High-potency ligands for DREADD imaging and activation in rodents and monkeys" Nat. Commun. 10, 4627 (2019). DOI: 10.1038/s41467-019-12236-z
- [3] A.S. Dixon, M.K. Schwinn, M.P. Hall et al. "NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells" ACS Chem. Biol. 11, 400 (2016). DOI: 10.1021/acschembio.5b00753
- [4] R. Abe, H. Ohashi, I. Iijima et al. ""Quenchbodies": Quench-Based Antibody Probes That Show Antigen-Dependent Fluorescence" J. Am. Chem. Soc. 133, 17386 (2011). DOI: 10.1021/ja205925j
- [5] R.K. Grover, X. Zhu, T. Nieusma et al. "A Structurally Distinct Human Mycoplasma Protein that Generically Blocks Antigen-Antibody Union" Science 343, 656 (2014). DOI: 10.1126/science.1246135
- 用語説明
[用語1] NanoLuc:深海エビ(Oplophorus gracilirostris)由来の生物発光酵素。基質を消化して460 nm付近にピークを持つ強い青色の光を放つ。HiBiTはNanoLucの156番目と157番目のアミノ酸の間を切断して得られた短い断片に変異が加えられた11残基のアミノ酸からなるペプチド。LgBiTは残りの156アミノ酸の16カ所に変異が加えられたタンパク質である。HiBiTとLgBiTは解離定数KDが約700 pMと親和性が強く、それぞれ単体では酵素活性を示さないが、両者が相互作用しNanoLucが再構成すると活性を示す。
[用語2] ELISA(Enzyme-Linked Immuno Sorbent Assay):マイクロプレートに検出したい分子やそれを認識する抗体を固相化し、サンプル中に含まれる目的の分子を検出・測定する分析法。分子どうしの相互作用を簡単に比較する目的で実施される場合もある。
[用語3] X線結晶構造解析:タンパク質や核酸などの分子を結晶化し、X線を照射して得られる回折パターンを解析することで、分子の立体構造を決定する方法。静的な構造情報を得ることができ、リガンド結合部位や分子間相互作用の理解に有効である。
[用語4] NMR(Nuclear Magnetic Resonance)解析:分子の原子核スピンの磁気共鳴を利用して、分子の局所環境を測定する手法。タンパク質の場合、立体構造に加え運動性に関する情報も得られるため、分子の動的機能を明らかにできる。
[用語5] MD(Molecular Dynamics)シミュレーション:分子の運動をニュートンの運動方程式に基づいて時間発展させる計算手法。分子の構造変化や分子間相互作用の動態を予測でき、実験で得られた構造やダイナミクスについて補完的知見を与えることができる。
[用語6] 化学遺伝学ツール:人工的に設計された受容体や酵素を、人工の低分子リガンドに応答して作動させる技術や実験手法。遺伝子導入によって細胞や個体に導入した標的タンパク質の活性を選択的に制御できるため、生命現象の解析や病気の治療に役立てられている。
[用語7] DREADD(Designer Receptors Exclusively Activated by Designer Drugs):化学遺伝学ツールの一種で、ムスカリン受容体を改変した人工の受容体。自然界には存在しない人工リガンドによってのみ活性化され、神経活動やシグナル伝達を人為的に操作できる。培養細胞のみならず動物個体でも広く利用されている。
[用語8] Protein M:マイコプラズマ(Mycoplasma genitalium)由来の抗体結合タンパク質。ほぼ全ての種の抗体の軽鎖に対して、解離定数KDが数nMという高い親和性を示す。
論文情報
| 掲載誌: | Advanced Science |
|---|---|
| タイトル: | Switchbody, an Antigen-Responsive Enzyme Switch Based on Antibody and Its Working Principle |
| 著者: | Takanobu Yasuda, Yoshiyuki Ueno, Masahiko Taguchi, Naoya Tochio, Hiromasa Yagi, Shuma Yazaki, Ryoichi Arai, Bo Zhu, Takanori Kigawa, Hiroshi Ueda, Tetsuya Kitaguchi |
| DOI: | 10.1002/advs.202508422 |
研究者プロフィール
北口 哲也 Tetsuya KITAGUCHI
東京科学大学 総合研究院 化学生命科学研究所 准教授
研究分野:バイオイメージング、タンパク質工学


安田 貴信 Takanobu YASUDA
東京科学大学 総合研究院 化学生命科学研究所 助教
研究分野:タンパク質工学、ケミカルバイオロジー


関連リンク
- 独自の深層学習モデルによる蛍光免疫センサーの高性能化|生命理工学系 News
- 牛乳や血液をそのまま薄めず標的分子を検出できる免疫センサーを開発|生命理工学系 News
- 幼少期の脳における記憶維持にはたらくオステオクリン|生命理工学系 News
- 抗体と混ぜるだけで抗原を素早く検出!病気やアレルギーの検査をより手軽に|Science Tokyoニュース
- 抗体と混ぜるだけで洗浄不要の免疫測定法を実現する新たな測定素子を開発|生命理工学系 News
- 10^5個以上の菌株を数日で選別するタンパク質分泌生産株ハイスループットスクリーニング法を開発|生命理工学系 News
- 赤色蛍光タンパク質型cGMPセンサーの開発と多色イメージングへの応用|生命理工学系 News
- 赤色蛍光タンパク質型グルコースセンサーの開発|生命理工学系 News
- 緑色蛍光タンパク質型乳酸センサーとピルビン酸センサーの開発|生命理工学系 News
- 新規緑色蛍光タンパク質型グルコースセンサーを開発|生命理工学系 News
- 生命活動の燃料「ATP」を観察する3色の蛍光センサーの開発に成功|生命理工学系 News
- 北口 哲也 Tetsuya Kitaguchi | Science Tokyo研究情報データベース(理工学系)
- 安田 貴信 Takanobu Yasuda | Science Tokyo研究情報データベース(理工学系)
- 北口哲也研究室
- 総合研究院 化学生命科学研究所
- 生命理工学院 生命理工学系
- 総合研究院
- 生命理工学院