生命理工学系 News
新規緑色蛍光タンパク質型グルコースセンサーを開発
リアルタイムで細胞内グルコースの動態を可視化
要点
- グルコースの細胞内での挙動を光学顕微鏡で可視化観察できるセンサーを開発
- 3種の反応性が異なるセンサーを使い分け、広い濃度範囲のグルコースを検出
- デュアルカラーイメージング、線虫個体内でのin vivoイメージングを達成
概要
東京工業大学 科学技術創成研究院 化学生命科学研究所の北口哲也准教授(ライフエンジニアリングコース主担当)は東京大学 大学院総合文化研究科の坪井貴司教授、三田真理恵大学院生らと共同で新規緑色蛍光タンパク質型グルコース(ブドウ糖)センサー「Green Glifon[用語1]」の開発に成功した。センサーは緑色蛍光タンパク質[用語2]を基盤とし、グルコース添加により蛍光輝度が約7倍に上昇する。このセンサーは細胞内グルコースの動態を高い時空間分解能で検出でき、バイオイメージングの有効なツールとなる。
今回開発したセンサーはグルコースへのEC50[用語3]値が異なる3タイプ(50 μM、600 μM、4,000 μM)からなり、これらの使い分けで生理的な濃度域である数百μM~10数mMのグルコース濃度変化のほとんどを検出できる。そして、細胞内のグルコース動態に加え、細胞小器官特異的な可視化やカルシウムイオンとの同時可視化も実現した。また細胞だけでなく、線虫個体内のグルコース動態も可視化できることから、in vivo[用語4]イメージングにも適用できる。人工甘味料[用語5]とグルコースとの生理学的な相関を検討し、膵β細胞[用語6]への人工甘味料投与が細胞内のグルコース動態を攪乱させる可能性を見出した。
以上の結果から、開発した3タイプのセンサーは生細胞のリアルタイムなグルコース動態の観察を可能にし、細胞のエネルギー動態やその破綻による病態を解析するうえで、重要なツールになると期待される。
研究成果は「Analytical Chemistry(アナリティカル・ケミストリー)」オンライン版にて3月14日に公開された。
研究成果
北口准教授らは緑色蛍光タンパク質を基盤とした3種のグルコースセンサー (Green Glifon)を開発し、それらを利用した生細胞内グルコース動態の可視化に成功した。GreenGlifonは分割した緑色蛍光タンパク質(Citrine)の間に、グルコース結合ドメイン配列を融合した構造を持つ(図1A)。
蛍光タンパク質とグルコース結合タンパク質をつなぐ、リンカー領域[用語7]の長さとアミノ酸配列を最適化することにより、グルコース添加時の蛍光輝度が約7倍に上昇した(図1B)。さらに、グルコース結合ドメインへ変異を導入することで、グルコースへの反応性が異なる3種の変異体を獲得することに成功した。3種のGreen GlifonのEC50値はそれぞれ50 μM、600 μM、4,000 μMであり(図1C)、濃度依存曲線の直線化の範囲から、8 μMから15 mMまでの濃度のグルコースを定量性高く検出できることが判明した。
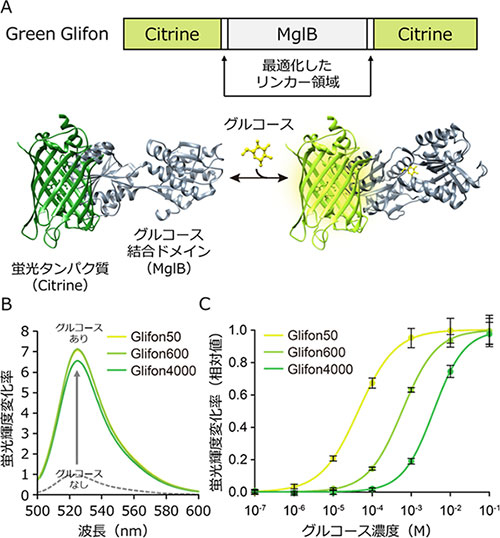
図1. Green Glifonの構造模式図とその性質
(A)分割した緑色蛍光タンパク質Citrineの配列の間に、グルコースへの結合ドメインとしてMglBの配列を挿入した。グルコースが結合ドメインへ結合すると、リンカー領域を通して構造変化がCitrineへ伝わり、蛍光輝度が上昇する。(B)3種のGreen Glifonの蛍光輝度変化率。グルコース添加で蛍光輝度が約7倍に増加する。(C)3種のGreen Glifonの各グルコース濃度への応答。それぞれのEC50値は44 μM(Glifon50)、590 μM(Glifon600)、3,800 μM(Glifon4000)となった。
Green Glifonをヒト子宮頸がん細胞株HeLa(ヒーラ)細胞に遺伝子導入し、細胞外にさまざまな濃度のグルコースを投与すると、その濃度に応答したGreen Glifonの輝度変化が見られた(図2)。さらに、細胞膜、核、ミトコンドリアへの局在化シグナルを融合したGreen Glifonによって、細胞小器官特異的なグルコース動態を可視化できた(図3A)。そしてGreen Glifonは、生きている線虫体内でも発現し、グルコース特異的な蛍光輝度変化を示したことから、in vivoイメージングへの適用が可能であることも示された(図3B)。
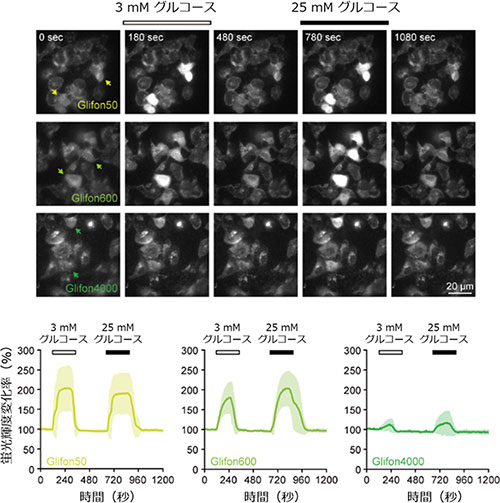
図2. Green Glifonを用いた細胞内グルコース動態の可視化実験
HeLa細胞に各Green Glifonを導入し、3 mMまたは25 mMグルコースを投与した際の蛍光輝度変化を測定した。それぞれ、グルコース濃度に応答した蛍光輝度変化がみられた。
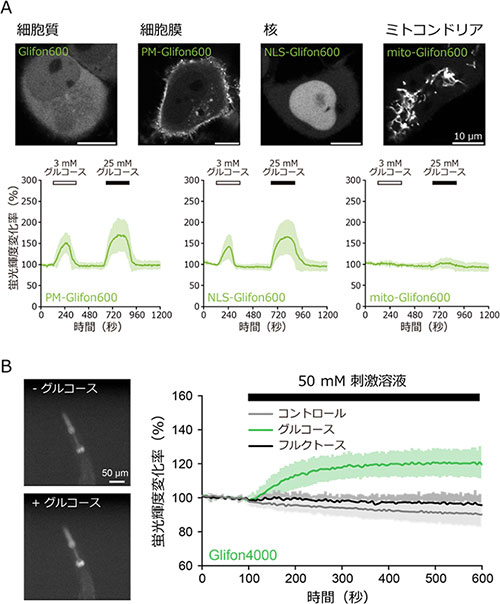
図3. 細胞小器官への局在化と生きた生物個体でのグルコース動態の可視化実験
(A)細胞膜、核、ミトコンドリアへ特異的に発現させたGlifon600の蛍光輝度変化を測定した。ミトコンドリアでは蛍光輝度が変化せず、グルコースが取り込まれないことを示した。(B)線虫の咽頭筋にGlifon4000を発現させ、グルコースや他の単糖であるフルクトースを投与したときの蛍光輝度変化を測定した。グルコース投与時のみ、Glifon4000の蛍光輝度が上昇した。
また、マウス膵β細胞株であるMIN6 m9細胞に、Green Glifonと赤色カルシウム蛍光指示薬「Rhod2」を共導入し、グルコース刺激を与えると、両者の蛍光輝度の上昇を捉えることができた(図4)。この結果から、グルコースとカルシウム動態の2色同時可視化も可能であることが分かり、マルチカラーイメージングへの適用が期待された。
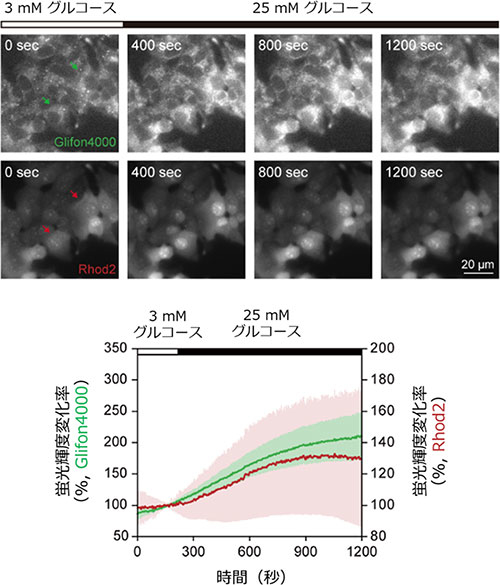
図4. 細胞内グルコースおよびCa2+動態の同時可視化実験
MIN6 m9細胞にGlifon4000とCa2+蛍光指示薬であるRhod2を共導入し、それぞれの蛍光輝度変化を測定した。高グルコース投与によって両者の蛍光輝度が上昇し、グルコースとCa2+動態との2色同時可視化が可能であることが示された。
最後に、インスリン分泌を司る膵β細胞の細胞株であるMIN6 m9細胞に人工甘味料を投与すると、細胞内グルコース濃度が上昇することが示唆された(図5)。この反応は、細胞外にグルコースがない条件では見られず、人工甘味料が膵β細胞内へのグルコース取り込みを促進させ、細胞内恒常性を攪乱させる可能性が示された。
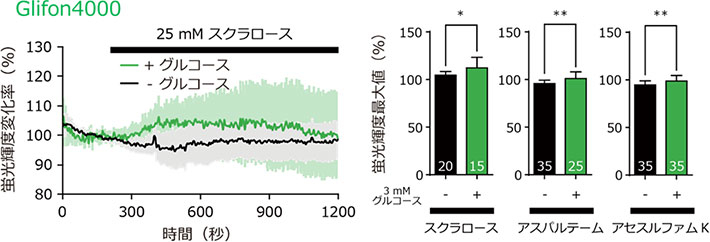
図5. 膵β細胞株への人工甘味料による細胞内グルコース動態の攪乱
MIN6 m9細胞にGlifon4000を導入し、25 mMの人工甘味料を投与した際の細胞内グルコース動態を測定した。細胞外にグルコースがない条件ではGlifon4000の蛍光輝度は上昇しないが、細胞外にグルコースがあるとGlifon4000の蛍光輝度が上昇した。人工甘味料投与の刺激によって細胞内へのグルコース取り込みが促進される可能性を見出した。*は p < 0.05、**は p < 0.01を示す。
背景
グルコース(ブドウ糖)は細胞の成長や増殖、血糖を調節するインスリンの分泌反応など、さまざまな生命活動や恒常性維持において重要な役割を果たしている。細胞内グルコースの動態は、細胞内の酵素の状態や細胞外からの刺激によってダイナミックに変化し、その代謝は、さまざまな生体反応の原動力となる分子を作り出す。
そして、グルコース代謝の破綻はホルモン分泌の異常を含むさまざまな細胞生理機能の変化を引き起こし、糖尿病を代表とした代謝疾患や神経障害など、個体レベルの病態にも深く関与する。したがって、細胞や個体におけるグルコース動態を明らかにすることはエネルギー代謝に関わる細胞生理機能だけでなく、病気の原因も明らかにできる可能性が高いと考えられる。
グルコース動態やそれを制御する関連分子の動態を、生きた細胞内で詳しく解析するためには、蛍光タンパク質を利用した分子センサーによる生細胞イメージングが有効であり、時空間分解能および汎用性が高いセンサーの開発が待ち望まれていた。
研究の経緯
蛍光タンパク質を利用した分子センサーはフォルスター共鳴エネルギー移動(Forster resonance energy transfer, FRET)型[用語8]と単色蛍光型の2種に大きく分けられる。以前に開発されていたFRET型のグルコースセンサーにより細胞内のグルコース動態の可視化は達成されていた。しかしながら、1つの検出分子に対し、2種類の蛍光を検出する必要があるという構造的なデメリットを抱えており、分子間の機能相関や階層性を検討するマルチカラーイメージングには不向きだった。一方、北口准教授らの研究グループとほぼ同時期に開発された単色蛍光型グルコースセンサーは、哺乳類由来の細胞内や生体内でのグルコース動態の可視化には適用されていなかった。
今後の展開
今回、開発したグルコースセンサー Green Glifonは、従来の技術では実現が難しかった、生細胞におけるグルコースと異なる分子の同時可視化を可能にし、マルチカラーイメージング技術への応用が期待された。そして細胞レベルだけでなく、生物個体での可視化解析が可能なことから、グルコース代謝を制御する分子基盤、エネルギーの恒常性を維持する機構、その機構の破綻による病態の解明への貢献が期待される。
用語説明
[用語1] Green Glifon : Green Glucose indicating fluorescent proteinの略。以前に開発したATPセンサーMaLionに倣って、キメラ動物から命名。
[用語2] 蛍光タンパク質 : 発色団をもち、ある特定の光(励起光)を吸収し、吸収した光よりも波長が長い光(蛍光)を放出する性質を持つタンパク質。今回開発した蛍光タンパク質センサーは、蛍光タンパク質と標的分子へ結合するタンパク質の配列を融合したもので、標的分子の結合または解離によって蛍光タンパク質の蛍光輝度を変化させ、標的分子の濃度変化や活性などを蛍光輝度の変化を通して検出する。
[用語3] EC50 : 50%効果濃度(半数効果濃度)。薬物や抗体など、今回はセンサーが最低値からの最大反応の50%を示す濃度のこと。
[用語4] in vivo : イン・ビボ。「生体内で」という意味。in vitro(イン・ビトロ)は「試験管内で」という意味。
[用語5] 人工甘味料 : 甘味をもつ化合物で、食品などの甘味料として広く使用される。天然には存在せず、合成甘味料とも呼ばれている。細胞表面の受容体に受容されることで甘味シグナルを誘導するが、細胞内には取り込まれず代謝もされないため、生体はエネルギーとして利用することができない。
[用語6] 膵β細胞 : 膵臓のランゲルハンス島にある内分泌細胞。血糖値を調節するインスリンを合成・分泌する。
[用語7] リンカー領域 : タンパク質同士をつなぐ、数個から数十個のアミノ酸からなる領域。
[用語8] フォルスター共鳴エネルギー移動型 : FRET型。2色の蛍光タンパク質と標的分子結合部位が連結された構造をしている。標的分子と結合、もしくは解離することで構造が変化し、2つの蛍光タンパク質の距離が近づくことで、片方の蛍光タンパク質の励起エネルギーがもう片方へと移動し、蛍光比が変化することを利用する。
論文情報
| 掲載誌 : | Analytical Chemistry |
|---|---|
| 論文タイトル : | Green fluorescent protein-based glucose indicators report glucose dynamics in living cells |
| 著者 : | Marie Mita#, Motoki Ito#, Kazuki Harada, Izumi Sugawara, Hiroshi Ueda, Takashi Tsuboi*, Tetsuya Kitaguchi*(#共同筆頭著者、*共同責任著者) |
| DOI : | 10.1021/acs.analchem.9b00447 |
- 生命活動の燃料「ATP」を観察する3色の蛍光センサーの開発に成功|生命理工学系 News
- 上田・北口研究室
- 研究者詳細情報(STAR Search) - 北口哲也 Tetsuya Kitaguchi
- 科学技術創成研究院 化学生命科学研究所
- 科学技術創成研究院
- 研究成果一覧
お問い合わせ先
研究に関すること
東京工業大学 科学技術創成研究院 化学生命科学研究所
准教授 北口哲也
E-mail : kitaguct-gfp@umin.ac.jp
Tel : 045-924-5270 / Fax : 045-924-5248
東京大学 大学院総合文化研究科 広域科学専攻 生命環境科学系
教授 坪井貴司
E-mail : takatsuboi@bio.c.u-tokyo.ac.jp
Tel : 03-5465-8208 / Fax : 03-5465-8208