生命理工学系 News
赤色蛍光タンパク質型グルコースセンサーの開発
新たな蛍光色で細胞内のグルコース動態を可視化
要点
- ヒト、マウスのさまざまな組織由来の細胞や線虫個体で利用できる、蛍光タンパク質をもとにした、新たな色(赤色)のグルコースセンサーの開発に成功しました。
- デュアルカラーイメージングにおいて、緑色蛍光センサーと併用することで、がん細胞内の糖代謝を空間的・階層的に捉えることに成功しました。
- 小腸内分泌細胞内のグルコース濃度を人工甘味料が攪乱することや、心筋細胞内のグルコース濃度と拍動の関連など、生体における糖代謝の重要性を明らかにしました。
概要
東京大学大学院総合文化研究科の坪井貴司教授と三田真理恵日本学術振興会特別研究員らは、東京工業大学科学技術創成研究院の北口哲也准教授(ライフエンジニアリングコース主担当)、株式会社マイオリッジの石田賢太郎博士(本社:京都府京都市、代表取締役社長:牧田直大)らと共同で、細胞内のグルコース(ブドウ糖)を可視化できる、赤色のグルコースセンサーRed Glifon(Red Glucose indicating fluorescent protein)の開発に成功しました。この研究成果は、2021年6月30日にCell Chemical Biology(オンライン版)に掲載されました。
今回開発されたRed Glifonは、赤色蛍光タンパク質を基盤として構築され、グルコース濃度に応答して蛍光輝度が変化する、蛍光タンパク質型分子センサー[用語1]です。Red Glifonを細胞に発現させ、蛍光顕微鏡で観察すると、細胞内のグルコース動態を蛍光輝度の変化を通して可視化することができました。また、グルコース、ATP、乳酸、ピルビン酸の緑色蛍光センサーと併用することで、細胞内でグルコースとその代謝産物との階層的な動態変化を同時可視化することに成功しました。
Red Glifonを用いた可視化解析は、人工甘味料[用語2]が腸管の内分泌細胞内の糖代謝に影響を与えてホルモン分泌異常を引き起こす可能性があることや、ヒト心筋細胞の拍動変化と糖代謝変化に関連があることを明らかにしました。Red Glifonは、細胞内のグルコース動態を高い時空間分解能で検出することができ、バイオイメージングのための有効なツールとなる可能性があります。細胞内のグルコース動態を理解することは、個体レベルでの病態を解析する上でも重要であり、糖尿病や心筋症などの疾患研究・薬剤探索への貢献が期待されます。
発表内容
1. 研究の背景と問題点
グルコースは生物にとって重要なエネルギー源の一つとして利用されています。グルコースは、細胞内で乳酸やピルビン酸などに代謝され、最終的にATPが産生されます。この糖代謝を理解するため、グルコースとその代謝産物の細胞内動態を可視化する技術開発が行われてきました。同研究グループはこれまでに、3色のATPセンサー MaLions(Monitoring ATP level intensity based turn on indicators)に加え、緑色グルコースセンサーGreen Glifon(Green Glucose indicating fluorescent protein)、緑色乳酸センサーGreen Lindoblum(Green Lactate indicator suitable for fluorescence imaging)および緑色ピルビン酸センサーGreen Pegassos(Green Pyruvate sensing a single fluorescent protein-based probe)の開発にも成功しています。しかし蛍光タンパク質型分子センサーは、上記も含めて緑色のものが多いため、細胞内でグルコースと別分子の動態を同時可視化するデュアルカラーイメージングを行うためには、緑色以外の蛍光色のグルコースセンサーが必要でした。
2. 研究内容
本研究では、世界初となる赤色の蛍光タンパク質型グルコ―スセンサーRed Glifonの開発に成功しました。このセンサーは、分割した赤色蛍光タンパク質mAppleと、グルコース結合ドメインMglBの配列を融合した構造を有します(図1A)。mAppleとMglBの間にはリンカー領域[用語3]を設け、この領域のアミノ酸配列の長さと種類を最適化することで、大きな蛍光輝度変化を起こす変異体を作出しています(図1B)。そしてグルコースは、生体内でさまざまな濃度で存在しているため、MglBに点変異を導入することで、グルコースへのEC50値[用語4]が異なる2種(Red Glifon 300とRed Glifon 3000)と、グルコースにほとんど反応せず陰性対照に利用できる1種(Red Glifon nega)の合計3種を構築しました(図1C)。
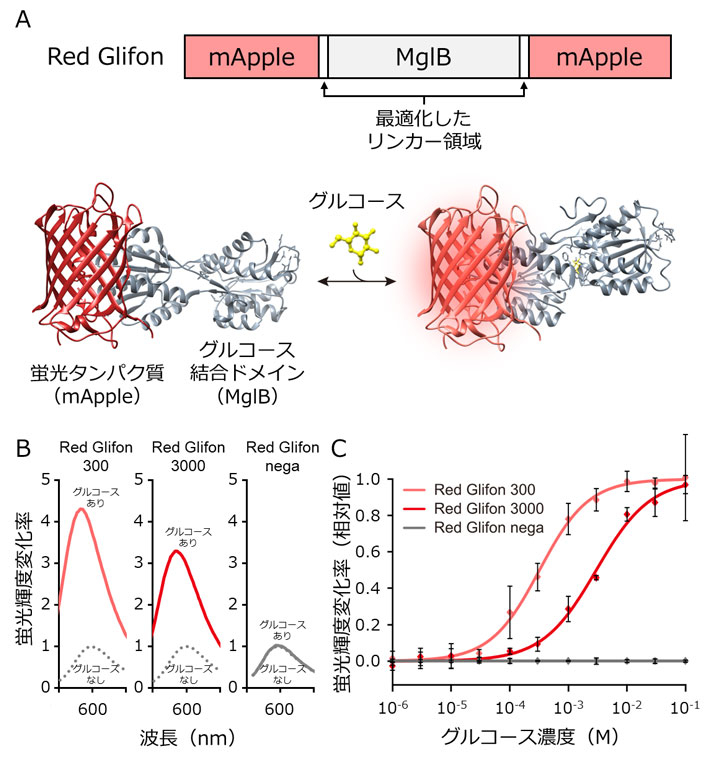
図1.Red Glifonの構造模式図とその性質。
- (A) 分割した赤色蛍光タンパク質mAppleの配列の間に、グルコースへの結合ドメインとしてMglBの配列を挿入した。グルコースが結合ドメインへ結合すると、リンカー領域を通して構造変化がmAppleへ伝わり、蛍光輝度が上昇する。
- (B) Red Glifonの蛍光輝度変化率。グルコース添加による蛍光輝度は、Red Glifon 300が約4倍、Red Glifon 3000が約3倍増加した。Red Glifon negaはグルコース添加による蛍光輝度変化を示さなかった。
- (C) Red Glifonの各グルコース濃度への応答。EC50値は、Red Glifon 300が320 µM、Red Glifon 3000が3000 µMとなった。
(Development of red genetically encoded biosensor for visualization of intracellular glucose dynamics. Mita et al., Cell Chemical Biology, 2021, doi: 10.1016/j.chembiol.2021.06.002より一部改変)
これらのセンサーを、ヒト子宮頸がん細胞株HeLa細胞内で発現させ、蛍光顕微鏡で観察すると、Red Glifon 300とRed Glifon 3000は細胞外から投与したグルコース刺激に応じた輝度変化を示しました(図2)。またHeLa細胞内で、緑色のATPセンサー、乳酸センサーおよびピルビン酸センサーとRed Glifon 300をそれぞれ併用すると、単一細胞内のATP、乳酸およびピルビン酸とグルコース動態を同時可視化することができました(図3)。グルコース刺激により、ATPと乳酸濃度が上昇するにも関わらず、ピルビン酸濃度は上昇せず、がん細胞であるHeLa細胞では解糖系が亢進していることと、ピルビン酸が速やかに乳酸へと代謝されることが示唆されました。
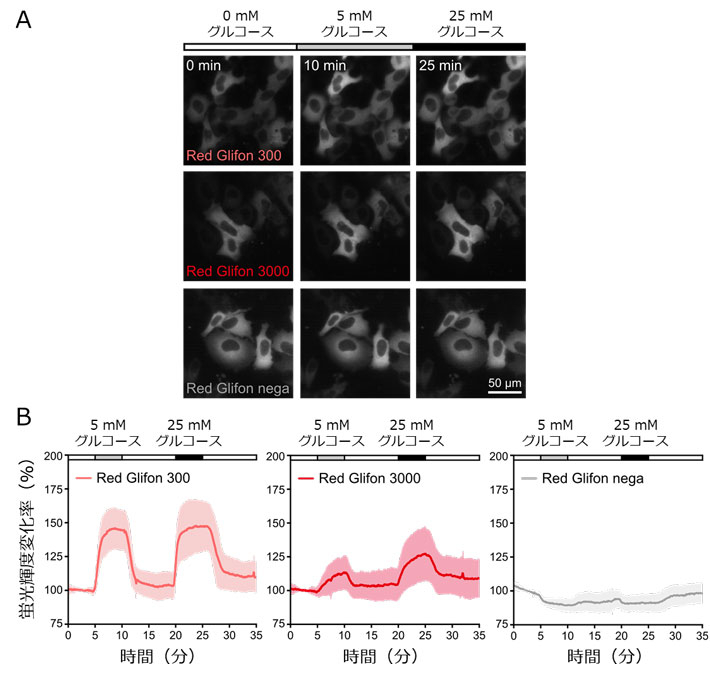
図2.Red Glifonを用いた細胞内グルコース動態の可視化実験。
- (A) HeLa細胞に各Red Glifonを導入し、5 mMまたは25 mMグルコースを投与した際の細胞の様子。
- (B) (A)の細胞における蛍光輝度変化の測定結果。Red Glifon 300とRed Glifon 3000では、グルコース濃度変化に応答した蛍光輝度変化がみられた。
(Development of red genetically encoded biosensor for visualization of intracellular glucose dynamics. Mita et al., Cell Chemical Biology, 2021, doi: 10.1016/j.chembiol.2021.06.002より一部改変)
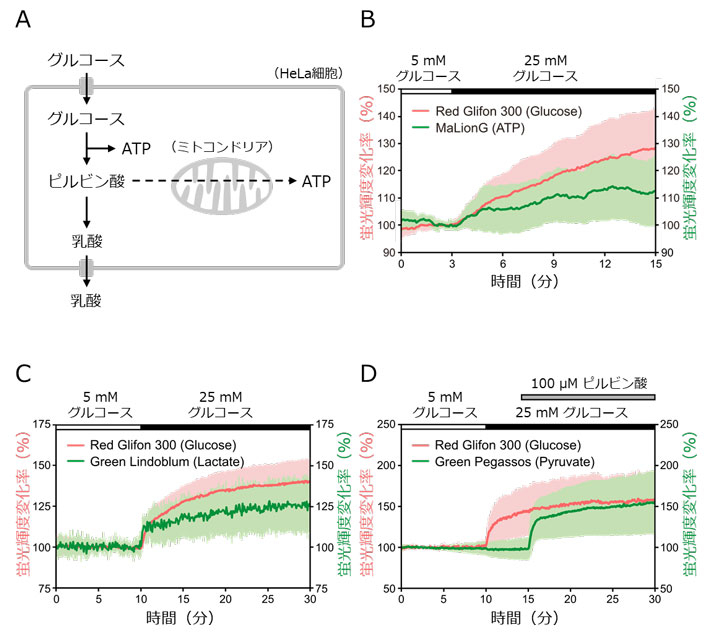
図3.HeLa細胞におけるグルコースと代謝産物の同時可視化実験。
- (A) HeLa細胞内の糖代謝の模式図。
- (B) グルコースとATP動態の同時可視化。グルコース刺激によって両者とも濃度上昇することが示唆された。
- (C) グルコースと乳酸の同時可視化。グルコース刺激によって両者とも濃度上昇することが示唆された。
- (D) グルコースとピルビン酸の同時可視化。ピルビン酸濃度は、グルコース刺激によって変化せず、ピルビン酸刺激によって上昇した。
(Development of red genetically encoded biosensor for visualization of intracellular glucose dynamics. Mita et al., Cell Chemical Biology, 2021, doi: 10.1016/j.chembiol.2021.06.002より一部改変)
また、腸と心臓において生理機能とグルコース動態との機能相関をRed Glifonを用いたイメージングによって解析しました。腸において人工甘味料スクラロースは、腸ホルモンの分泌異常を引き起こす可能性が報告されていました。しかし小腸の内分泌細胞[用語5]において、スクラロースがどのように感知され、どのようなシグナル変化が起きているかは不明でした。マウス小腸内分泌L細胞株GLUTag細胞を用いたイメージングにより、細胞へのスクラロース投与は、細胞内のCa2+動態だけでなく、cAMPおよびグルコース動態にも影響することが分かりました(図4A)。さらに人工甘味料は、複数のGタンパク質共役型受容体[用語6]によって感知されていることも分かり、そのシグナルがグルコース取り込みを制御することなどによって分泌異常を引き起こす可能性が示されました(図4B)。また、ヒトiPS細胞由来心筋細胞を用いたイメージングでは、細胞内のエネルギー輸送を阻害すると、心筋の拍動は一過的に上昇した後に停止してしまうことが分かりました(図4C)。このとき、拍動変化に伴った細胞内グルコース濃度変化が生じることが示唆され、拍動を維持するために糖代謝が調節されている可能性が明らかになりました(図4D)。
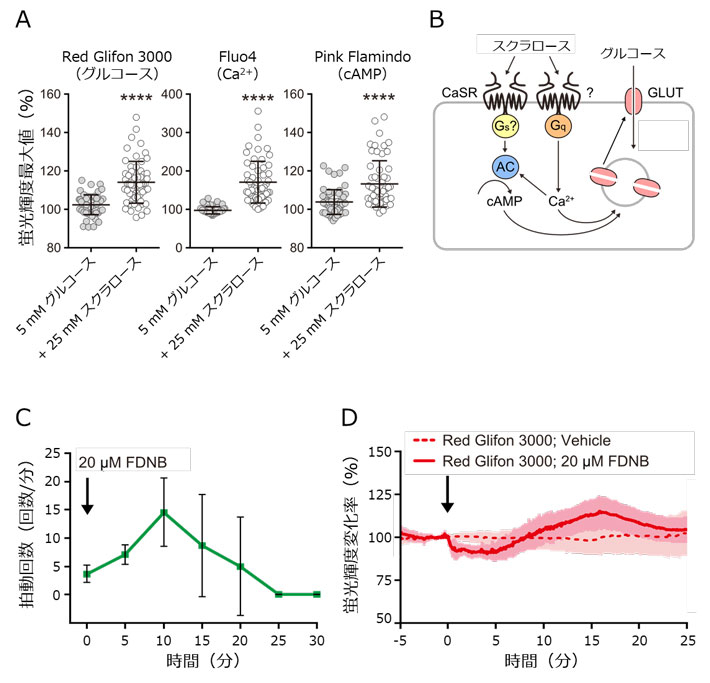
図4.小腸内分泌細胞における人工甘味料スクラロースの作用と、心筋細胞における拍動と糖代謝との関係の解析。
- (A) スクラロース投与時の小腸内分泌細胞内グルコース・Ca2+・cAMP動態。いずれも、スクラロース投与によって濃度上昇することが示唆された。
- (B) 本実験で推測された、スクラロース投与時に小腸内分泌細胞内で生じるシグナル経路。
- (C) 心筋細胞にFDNBを投与した際の拍動回数の変化。一過的な拍動上昇が起き、その後停止することが分かった。
- (D) 心筋細胞にFDNBを投与した際の細胞内グルコース濃度変化。拍動変化に応じ、細胞内グルコース濃度も変動していることが示唆された。
(Development of red genetically encoded biosensor for visualization of intracellular glucose dynamics. Mita et al., Cell Chemical Biology, 2021, doi: 10.1016/j.chembiol.2021.06.002より一部改変)
3. 社会的意義と今後の展望
今回開発されたRed Glifonは、細胞内のグルコース動態の可視化解析に有効であり、緑色蛍光センサーや他の蛍光色のセンサーと組み合わせることで、マルチカラーによる同時可視化へと発展させることができます。そして、さまざまな細胞や組織での糖代謝に関わる複数の分子の階層性をイメージングによって時空間分解能高く検出することで、生体のエネルギー恒常性を維持する機能の解明に迫ることはもちろんのこと、疾患研究や治療法探索においても有効な手段になることが期待されます。
発表者
- 三田真理恵(日本学術振興会 特別研究員)
- 菅原和(東京大学大学院理学系研究科生物科学専攻 修士課程2年(研究当時))
- 原田一貴(東京大学大学院総合文化研究科広域科学専攻 助教)
- 伊藤幹(東京大学大学院理学系研究科生物科学専攻 修士課程2年(研究当時))
- 滝澤舞(東京大学大学院総合文化研究科広域科学専攻 博士課程3年(研究当時))
- 石田賢太郎(株式会社マイオリッジ 主任研究員)
- 上田宏(東京工業大学科学技術創成研究院 化学生命科学研究所 教授)
- 北口哲也(東京工業大学科学技術創成研究院 化学生命科学研究所 准教授)
- 坪井貴司(東京大学大学院総合文化研究科広域科学専攻 教授)
- 用語説明
[用語1] 蛍光タンパク質型分子センサー : 蛍光タンパク質は、発色団をもち、特定の波長の光(励起光)を吸収し、吸収した光よりも波長が長い光(蛍光)を放出する性質をもつ。これを利用し、特定の分子への結合ドメインと融合することで、標的分子の結合または解離によって、蛍光タンパク質の蛍光輝度変化を示すように改変されたタンパク質ベースのセンサーのこと。
[用語2] 人工甘味料 : 甘味をもつ化合物で、食品などの甘味料として広く使用される。天然には存在せず、合成甘味料とも呼ばれている。細胞表面の受容体に感知されることで甘味シグナルを誘導するが、細胞内には取り込まれず代謝もされないため、生体はエネルギーとして利用することができない。
[用語3] リンカー領域 : タンパク質同士をつなぐ、数個から数十個のアミノ酸からなる領域。
[用語4] EC50値 : 50%効果濃度(半数効果濃度)のこと。薬剤や分子センサーなどが、最低値からの最大反応の50%を示す濃度。
[用語5] 内分泌細胞 : ホルモンを分泌する細胞。生体内の環境変化を感知して、ホルモンを分泌し、生体機能を調節している。小腸内分泌L細胞は、小腸下部に存在し、食欲や記憶・学習を司る消化管ホルモンの1つであるグルカゴン様ペプチド-1(GLP-1)を分泌する。
[用語6] Gタンパク質共役型受容体 : 細胞膜表面に存在し、細胞外部からのさまざまな刺激物質を感知する受容体の一種。細胞膜を7回貫通する構造をもち、細胞質側では三量体Gタンパク質というタンパク質複合体が結合している。受容体に対して特異的な刺激物質が結合することで、細胞内のCa2+やcAMP動態に影響を与え、細胞内シグナル伝達を調節する。
- 論文情報
| 掲載誌 : | Cell Chemical Biology(オンライン版:2021年6月30日掲載) |
|---|---|
| 論文タイトル : | Development of red genetically encoded biosensor for visualization of intracellular glucose dynamics |
| 著者 : | Marie Mita, Izumi Sugawara, Kazuki Harada, Motoki Ito, Mai Takizawa, Kentaro Ishida, Hiroshi Ueda, Tetsuya Kitaguchi, Takashi Tsuboi |
| DOI : |
- 蛍光抗体と発光酵素を組み合わせ、発光色の変化で抗原を高感度検出│生命理工学系News
- 緑色蛍光タンパク質型乳酸センサーとピルビン酸センサーの開発│生命理工学系News
- 人工細胞の免疫センサー化に成功│生命理工学系News
- 新規緑色蛍光タンパク質型グルコースセンサーを開発│生命理工学系News
- ヒストンタンパク質の翻訳後修飾の可視化に成功│生命理工学系News
- 生命活動の燃料「ATP」を観察する3色の蛍光センサーの開発に成功│生命理工学系News
- 上田・北口研究室
- 研究者詳細情報(STAR Search) - 北口哲也 Tetsuya Kitaguchi
- 研究者詳細情報(STAR Search) - 上田宏 Hiroshi Ueda
- 科学技術創成研究院 化学生命科学研究所
- 科学技術創成研究院(IIR)
- 生命理工学院 生命理工学系
- 東京大学 大学院総合文化研究科
- 株式会社マイオリッジ
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 化学生命科学研究所
准教授 北口哲也
E-mail : kitaguct-gfp@umin.ac.jp
Tel : 045-924-5270
東京大学 大学院総合文化研究科 広域科学専攻 生命環境科学系
教授 坪井貴司
E-mail : takatsuboi@bio.c.u-tokyo.ac.jp
Tel : 03-5465-8208