生命理工学系 News
ヒストンタンパク質の翻訳後修飾の可視化に成功
エピジェネティックマークを色で観察する細胞内抗体プローブ開発
要点
- ヒストン修飾の生細胞でのカラー計測に成功
- 従来の細胞内局在変化を利用するプローブより明瞭な信号変化
- 遺伝子活性化の可視化プローブとして、創薬などへの応用に期待
概要
東京工業大学 科学技術創成研究院の上田宏教授(ライフエンジニアリングコース主担当)と鍾蝉伊(ショウ・ゼンイChung, Chan-I)研究員(研究当時)、木村宏教授(生命理工学コース主担当)らの研究グループは、ヒストンタンパク質[用語1]の特定の翻訳後修飾[用語2](ヒストンH3タンパク質の9番目リジンのアセチル化、H3K9ac[用語3])を生細胞内の蛍光色変化として可視化する技術の開発に成功した。
細胞内抗体[用語4]と蛍光タンパク質間の蛍光共鳴エネルギー移動(FRET)[用語5]を用いてH3K9acをその蛍光波長変化として直接検出する細胞内抗体プローブH3K9ac FRET-mintbody[用語6] を開発し、生きた細胞をライブイメージングすることに成功した(図)。抗原に結合することによる細胞内抗体の微妙な構造変化と、二つの蛍光タンパク質同士の距離と配向の変化により、FRET効率が顕著に向上するプローブを構築できたと考えられる。
細胞内でDNAと結合しているヒストンタンパク質の翻訳後修飾は、遺伝子の働きを制御する重要な役割を果たしている。その中でヒストンH3のアセチル化修飾は遺伝子活性化の目印として働くと考えられており、発生や分化、iPS細胞(人工多能性幹細胞)の形成過程で大きく変動することが知られていたが、これまで生きた細胞内でその修飾量の変化を蛍光色で観察する技術は報告されていなかった。
この成果は7月15日に英科学誌「Scientific Reports(サイエンティフィックレポーツ)」にオンライン掲載された。
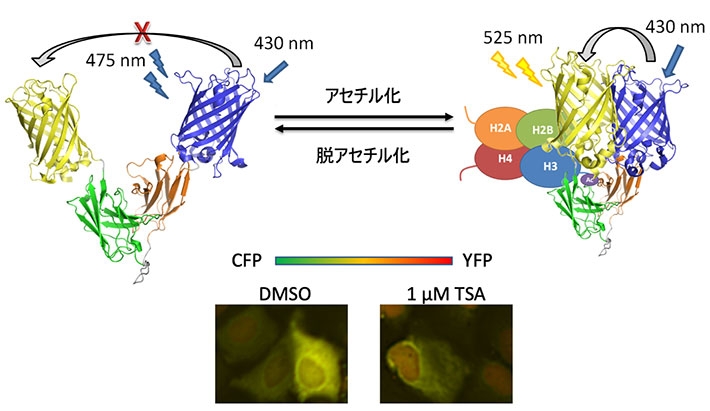
図. 内在性のH3K9acを蛍光色変化として検出する細胞内抗体プローブH3K9ac FRET-mintbodyの模式図(上)と、ヒストン脱アセチル化阻害剤トリコスタチンA (TSA)添加の有無によるプローブ発現細胞の蛍光色変化(下)
研究成果
ヒストンH3タンパク質9番目リジンのアセチル化(H3K9ac)特異的抗体の可変領域を、両側に蛍光色の異なる2種類の蛍光タンパク質を融合させた一本鎖可変領域抗体(single-chain variable region fragment, scFv)として細胞に発現させ、 蛍光共鳴エネルギー移動型細胞内抗体プローブ(fluorescence resonance energy transfer type modification-specific intracellular antibody, FRET-mintbody)を作製した。
試行錯誤ののち、哺乳動物細胞内とその細胞抽出液を用いて構築したFRET-mintbodyがH3K9acに特異的に結合して蛍光色を変化させることを確かめた。さらに、生細胞内でのH3K9acレベルのカラーライブイメージングに成功した。この結果、同条件での蛍光観察において、mintbodyの細胞内局在変化よりも大きな色(2波長での蛍光強度比)変化を、より簡便かつ正確に定量する事に成功した。
背景
多細胞生物の体を構成する細胞では個々の細胞に特有の遺伝子が活性化している。この遺伝子発現制御には、エピジェネティック制御が重要であることが示されてきた。エピジェネティック制御とは、DNA配列の変化を伴わずに起こる遺伝子発現の制御であり、DNAのメチル化やDNA結合タンパク質であるヒストンの翻訳後修飾などにより引き起こされる。
ヒストン修飾は細胞分化過程やシグナル応答などの発現遺伝子がダイナミックに変化する際に可逆的に変化するため、特に重要な役割を果たすと考えられている。H3K9acは、がん化などの細胞増殖制御に関わる遺伝子発現活性化に関与することが報告されており、筆者のうち木村教授らは、ヒストンのアセチル化亢進に伴うプローブの細胞質から核への局在変化を指標とするH3K9ac-mintbodyプローブをすでに開発していた。しかし、この変化を蛍光色変化として検出できるプローブは開発されていなかった。
研究の経緯
タンパク質の翻訳後修飾の検出法としては、細胞を固定した後に修飾特異的抗体[用語7] を反応させる方法が最もよく用いられている。しかし翻訳後修飾の役割をより詳細に理解するためには、生きた細胞でダイナミックに変化する修飾を個々の細胞単位で調べる必要がある。木村教授らのグループはこれまで、各種修飾特異的抗体由来の生細胞プローブを開発し、生きた細胞の中で起こるヒストンタンパク質の翻訳後修飾を、蛍光顕微鏡を用いて観察するシステムを樹立してきた。
特に抗体の可変領域を蛍光タンパク質融合型scFv[用語8]として細胞内に発現させたプローブmintbodyは、遺伝子改変動物の個体レベルの解析などに応用可能であったが、修飾に伴うプローブの細胞内局在変化を検出する原理のため、蛍光強度の変化が少なく定量的評価のためには核と細胞質での蛍光定量を厳密に行う必要があった。
そこで今回、蛍光抗体プローブ構築を専門とする上田教授らにより、抗体可変領域がH3K9acに結合する事で蛍光共鳴エネルギー移動の効率が変化するプローブの構築が試みられた。この結果、同条件での蛍光観察において、脱アセチル化阻害剤トリコスタチン添加によるmintbodyの細胞内局在変化よりも大きな色(2波長の蛍光強度比)変化を、より簡便に検出することに成功した。さらにこの変化のライブセルイメージングに成功した。
今後の展開
ヒストンの化学修飾はDNA配列の変化を伴わずに起こる遺伝子発現の制御であるエピジェネティクスで重要な役割を果たしており、なかでもヒストンのアセチル化修飾は遺伝子活性化の目印として注目されている。本研究により得られたH3K9 FRET-mintbodyにより、より高い精度で生細胞での解析が可能となり、この修飾の新たな側面が見いだされることが期待できる。また、本成果は今後、他の細胞内在性抗原検出のための抗体プローブ構築の指針になると期待される。
用語説明
[用語1] ヒストンタンパク質 : 真核生物のクロマチン(染色体)を構成する主要なタンパク質。
[用語2] 翻訳後修飾 : タンパク質は細胞内で生合成された後、アセチル化、メチル化、リン酸化など様々な化学修飾を受ける。細胞内のほとんどのタンパク質はこれらの修飾により機能や活性が調節されている。
[用語3] ヒストンH3タンパク質の9番目リジンのアセチル化(H3K9ac) : 一般的にヒストンがアセチル化されると、クロマチンと DNA の結合が緩み、転写因子が結合しやすくなって遺伝子発現が増加する。特にH3K9acは、活性化された遺伝子のエンハンサーおよびプロモーター領域で検出される。このようなアセチル化はヒストン・アセチルトランスフェラーゼ(Histone acetyltransferase; HAT)とヒストン脱アセチル化酵素(Histone acetylase; HDAC)によって調節されている。
[用語4] 細胞内抗体 : 本来細胞外タンパク質である抗体はジスルフィド結合が形成されない細胞内では天然の構造を形成しづらい。そのため今回は天然抗体に変異を導入し、細胞内でも安定な構造をとって機能する抗体を選択し利用した。
[用語5] 蛍光共鳴エネルギー移動 : 近接した二つの蛍光色素間を、無放射的にエネルギーが移動して励起した色素の蛍光波長が減衰し、通常より長い波長の蛍光が観察される現象。正確にはフェルスター共鳴エネルギー移動(Förester Resonance Energy Transfer, 短くFRET)と呼ばれる。今回は蛍光色素として細胞で発現可能な2種類の蛍光タンパク質(水色のCFPと黄色のYFP)を用いた。
[用語6] FRET-mintbody : FRET(fluorescence resonance energy transfer=蛍光共鳴エネルギー移動)、Mintbody(Modification specific intracellular antibody=修飾特異的細胞内抗体)
[用語7] 修飾特異的抗体 : 修飾されたアミノ酸を含む配列を特異的に認識して結合する抗体。修飾部位とその前後数残基を含むペプチドを抗原として動物を免疫し、作製することができる。
[用語8] 蛍光タンパク質融合型scFv : 一本鎖抗体scFvに通常1個の蛍光タンパク質を融合させたもの。蛍光によりその細胞内局在を観察できる。Mintbodyにおいてはヒストン修飾の増加に伴い、ヒストンがある核に局在するMintbodyの割合が増加する。
論文情報
| 掲載誌 : | Scientific Reports |
|---|---|
| 論文タイトル : | Intrabody-based FRET probe to visualize endogenous histone acetylation |
| 著者 : | Chan-I Chung1,5, Yuko Sato2, Yuki Ohmuro-Matsuyama1, Shinichi Machida3, Hitoshi Kurumizaka3,4, Hiroshi Kimura2 & Hiroshi Ueda1 |
| 所属 : |
1Laboratory for Chemistry and Life Science, Institute of Innovative Research, Tokyo Institute of Technology 2Cell Biology Center, Institute of Innovative Research, Tokyo Institute of Technology 3Laboratory of Structural Biology, Graduate School of Advanced Science & Engineering, Waseda University 4Present address: Institute for Quantitative Biosciences, The University of Tokyo 5Present address: Department of Pharmaceutical Chemistry, University of California San Francisco |
| DOI : | 10.1038/s41598-019-46573-2 |
- タンパク質だけの汎用蛍光バイオセンサーを開発│東工大ニュース
- 上田・北口研究室
- 木村研究室
- 研究者詳細情報(STAR Search) - 上田宏 Hiroshi Ueda
- 研究者詳細情報(STAR Search) - 木村宏 Hiroshi Kimura
- 科学技術創成研究院 化学生命科学研究所
- 科学技術創成研究院 細胞制御工学研究センター
- 東京工業大学 科学技術創成研究院 (IIR)
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 化学生命科学研究所
教授 上田宏
E-mail : ueda@res.titech.ac.jp
Tel : 045-924-5248 / Fax : 045-924-5248