生命理工学系 News
“構造活性相関転移”による低分子医薬品候補の設計
既知の構造活性相関情報から異なる阻害剤の活性向上を予測
要点
- 大規模な活性データベースを用いて活性順列の網羅的な解析を実施
- 構造活性相関転移の予測に基づいて新規低分子医薬品候補を設計
- 既存の化合物より3.5倍の活性をもつ新規化合物を創出
概要
東京工業大学 生命理工学院 生命理工学系の梅寺倖平大学院生(博士後期課程2年)、同 科学技術創成研究院 化学生命科学研究所の中村浩之教授と株式会社理論創薬研究所の吉森篤史博士、ライン・フリードリヒ・ヴィルヘルム大学ボン(ドイツ)のユルゲン・バヨラト教授らは、低分子医薬品[用語1]の迅速な構造最適化を目指し、構造活性相関(SAR)[用語2]転移の予測によるマトリックスメタロプロテアーゼ1(MMP-1)[用語3]阻害剤[用語4]を設計した。
低分子医薬品の開発では、母骨格の構造が異なっていても類似したSARを示すという、SAR転移を可能とする阻害剤の組み合わせが知られている。SAR転移の予測は迅速な構造最適化につながるが、これまでそうした阻害剤の組み合わせは十分に探索されていなかった。
研究グループはMMP-1阻害剤について、大規模な活性データベースを網羅的に検索することで、SAR転移を起こす既存阻害剤を発見した。活性の向上が予測された新規化合物を実際に合成して評価すると、既知化合物よりも3.5倍高いMMP-1阻害活性が得られた。ファーマコフォア[用語5]フィッティングにより結合様式を解析すると、ハロゲン結合の形成が活性の向上に寄与したことが示唆された。
本研究成果は、迅速な医薬品設計を可能にするものであり、新薬をいち早く社会に届けることで、人々の健康に寄与することが期待される。また、12月3日付(現地時間)に英国科学誌「Scientific Reports(サイエンティフィック・リポーツ)」に掲載された。
研究の背景と経緯
創薬におけるリード最適化[用語6]は、活性の向上や物性の改善を目指して、化合物の部分構造を改変していくことで達成される。特に低分子医薬品の開発では、母骨格の構造が異なるにもかかわらず、類似した構造活性相関(Structure Activity Relationship: SAR)を示す阻害剤の組み合わせが観測されている。これは、母骨格が異なる化合物の間で、活性の向上に伴う側鎖構造の変化が一致しているということであり、SAR転移が可能であることを示す。開発中の候補化合物について、SAR転移が起きる阻害剤の組み合わせを予測できれば、迅速なリード最適化が期待できる。
従来のSAR転移の解析手法は、対象とする化合物に制限を掛けており、組み合わせの探索を十分に行えてなかった。また、SAR転移を新規阻害剤の創出に応用した例も報告されていない。そこで本研究グループは、大規模なデータベースを用いてSAR転移が起きる阻害剤の組み合わせを予測し、実際に合成と活性評価を行うことで、新規阻害剤の創出を目指した。
本研究グループはこれまでの研究で、部分構造の変化による活性順列をアライメント[用語7]する手法を開発した(Eur. J. Med. Chem. 2022, 239, 114558.)。本手法は、開発の早期段階にある阻害剤について、すでに多様な構造変換が施された阻害剤の中から類似したSARを示すものを検索することを可能にする。見出された阻害剤と同様の構造変換を施すことによって、SAR転移による迅速な構造最適化が期待できる。
研究成果
本研究では、マトリックスメタロプロテアーゼ1(MMP-1)阻害剤について、大規模な活性データベースであるChEMBL[用語8]で活性順列の網羅的なアライメントを行い、SAR転移が起きる阻害剤の組み合わせを予測した。その結果、キネシン様タンパク質11(KIF11)阻害剤のSARが転移し得ることを見出した。活性の向上が予測される新規化合物を実際に合成すると、既知阻害剤よりも3.5倍のMMP-1阻害活性をもつことが明らかになった。結合様式をファーマコフォアフィッティングにより解析すると、合成した化合物がMMP-1の214番目のアルギニン残基とハロゲン結合を形成しており、これが活性の向上に寄与したことが示唆された(図1)。
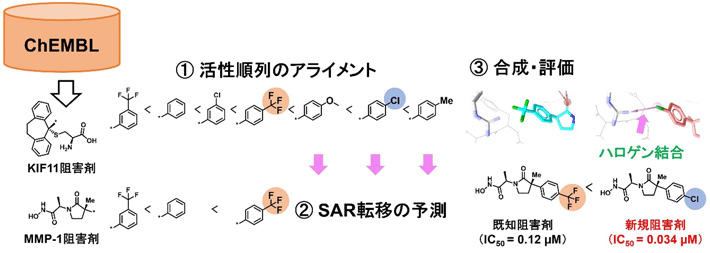
図1.SAR 転移による新規阻害剤の設計
このように、MMP-1阻害剤とKIF11阻害剤は、母骨格だけでなく、結合タンパク質も異なるにもかかわらず、同様のSARを示すことが明らかになった。さらに、KIF11阻害剤の活性の向上に寄与している構造変換をMMP-1阻害剤にも適用することで、実際に活性が向上することが確かめられ、SAR転移の予測による新規阻害剤の開発を実証することができた。
社会的インパクト
本研究は、医薬品開発における構造最適化の過程を加速するものである。低分子医薬品の開発が年々困難になる中で、本研究は、有望な医薬品候補化合物を早期に取得することを可能にし、医薬品開発のコスト削減や成功率の向上を実現すると期待される。
今後の展開
本研究の手法は、活性順列の類似度に基づいた新たな阻害剤設計を可能にするものである。一方で、ユルゲン・バヨラト教授および吉森篤史博士らは、機械学習によってリード最適化に望ましい構造変化を予測する手法を開発している(Bioorg. Med. Chem. 2022, 66, 116808.)。この機械学習による手法は、変換された部分構造の出現頻度に基づいて予測を行うものであり、本研究の手法とは異なる視点で新規化合物を設計することができる。今後の研究では、これら2つの手法を組み合わせることで、活性の向上が期待されるだけでなく、標的分子が明らかでない阻害剤の設計を可能にする新手法の開発を目指す。
- 用語説明
[用語1] 低分子医薬品 : 分子量500以下の合成化合物である医薬品。
[用語2] 構造活性相関(SAR) : 化学構造と生物学的な活性の間に成り立つ相関関係。
[用語3] マトリックスメタロプロテアーゼ1(MMP-1) : コラーゲンなどの組織骨格を分解する酵素。
[用語4] 阻害剤 : 酵素などの生物学的な活性を低下させる化合物。
[用語5] ファーマコフォア : 化合物とタンパク質の結合を可能にし、生物学的反応を誘発または遮断するのに必要な電子的・立体的特徴の集合。
[用語6] 創薬におけるリード最適化 : 創薬開発の起点となるリード化合物の活性や安全性を高めることを目的として、新しい化学構造を合成展開していくこと。
[用語7] アライメント : 類似性を比較するために並べること。
[用語8] ChEMBL : 欧州バイオインフォマティクス研究所によって運営されている生物活性低分子が集められたデータベース。
- 論文情報
| 掲載誌 : | Scientific Reports |
|---|---|
| 論文タイトル : | Design of MMP-1 inhibitors via SAR transfer and experimental validation |
| 著者 : | Kohei Umedera, Atsushi Yoshimori, Jürgen Bajorath*, Hiroyuki Nakamura* |
| DOI : |
- ナノ空間で制御可能なヒスチジン残基化学修飾を開発|生命理工学系 News
- 膨大な活性データの網羅的解析から低分子医薬品候補を創出|生命理工学系 News
- 副反応を起こしやすいアミノ酸を迅速かつクリーンに連結 —抗HIV抗菌ペプチドの大量生産に道—|生命理工学系 News
- 中性子捕捉療法のための有望なホウ素薬剤を開発 —マウスのがんで、高い治療効果を確認—|生命理工学系 News
- 【研究室紹介】 中村・岡田研究室|生命理工学系 News
- 中村・岡田研究室
- 中村浩之 Hiroyuki Nakamura|研究者検索システム 東京工業大学STARサーチ
- 生命理工学院 生命理工学系
- 化学生命科学研究所
- 科学技術創成研究院(IIR)
- ライン・フリードリヒ・ヴィルヘルム大学ボン(ドイツ)
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 化学生命科学研究所
教授 中村浩之
E-mail : hiro@res.titech.ac.jp
Tel 045-924-5244 / Fax 045-924-5976(研究所事務室)