生命理工学系 News
ナノ空間で制御可能なヒスチジン残基化学修飾を開発
タンパク質研究の新しい化学ツール
発表のポイント
- 触媒の近接環境で選択的に進行するタンパク質化学修飾反応の新しいツールを開発。
- 従来の手法とは異なる新たなアプローチでタンパク質のヒスチジン残基を迅速に化学修飾することに成功。
- ナノメートルスケールの局所環境で抗体分子を部位選択的に機能化することに成功。
- 細胞内のタンパク質の位置関係を明らかにする手法への応用が期待される。
概要
タンパク質の化学構造に不可逆的な強い結合(共有結合)で機能を導入する技術「タンパク質化学修飾」は、タンパク質を用いるバイオマテリアル創出や、ドラックデリバリーシステム開発において必要不可欠な技術です。
東京工業大学 科学技術創成研究院の中村浩之教授(ライフエンジニアリングコース主担当)は、東北大学 学際科学フロンティア研究所の佐藤伸一助教、同大学 大学院生命科学研究科の石川稔教授らと共同で、タンパク質に対する新しい化学修飾反応を開発しました。本手法では活性酸素種の一種である一重項酸素[用語1]を利用することで、特定座標の周辺に存在するヒスチジン残基を迅速に機能化します。一重項酸素を活用する本手法は、局所空間内に存在するタンパク質を機能化する新たな戦略として、タンパク質研究を加速させると期待できます。
この研究成果に関する論文は4月27日付けでJournal of the American Chemical Society 誌のオンライン速報版で公開されました。
背景
タンパク質の化学構造に不可逆的な強い結合(共有結合)で機能を導入する技術「タンパク質化学修飾」は、タンパク質を用いるバイオマテリアル創出や、抗体薬物複合体などのタンパク質を基盤としたドラックデリバリーシステム開発において必要不可欠な技術です。タンパク質化学修飾法に適用できる化学反応は種類が限られており、機能を導入できるアミノ酸残基も限定されています。20種類の天然アミノ酸残基のうち、リジン残基とシステイン残基を化学修飾する手法は確立されているものの、その他18種類のアミノ酸残基を高い信頼性で化学修飾することは難しい課題です。
ヒスチジン残基はタンパク質構造において、金属の結合部位となること、プロトン移動に関与し酵素の活性中心になること、リン酸化部位になること等が知られており、ヒスチジン残基の選択的化学修飾はタンパク質研究の有用なツールになると期待されますが、報告例が少ないのが現状です。また、従来のヒスチジン残基修飾法は、ヒスチジン残基の弱い求核性を利用するという性質上、他の求核性アミノ酸残基との選択性の低さが問題となっています。
研究成果
(1)従来法とは異なる新たなアプロ―チでヒスチジン残基を迅速に化学修飾する反応を開発
従来のヒスチジン残基修飾法は、ヒスチジン残基の求核性を利用し、求電子剤を反応させるという手法でした。一方で、本研究では、一重項酸素とヒスチジン残基が反応して生じる求電子性の中間体を求核剤によって捕捉するという戦略を取りました。一重項酸素の高い反応性から、反応は迅速に完結することが分かりました。従来法では、タンパク質のヒスチジン残基を化学修飾するためにpH8.5程度の塩基性条件や数時間の反応時間を必要としていましたが、本手法では、生理的pH条件下、光触媒への数分(~10分)間の可視光照射で効率的にヒスチジン残基を修飾することに成功しました。一重項酸素により、メチオニン残基、トリプトファン残基も酸化されますが、本手法で用いる求核剤はヒスチジン残基を選択的に化学修飾しました。
(2)触媒分子周辺のナノ空間で選択的にヒスチジン残基を標識することに成功
一重項酸素は短寿命性(マイクロ秒単位)の高反応性活性種であり、触媒周辺のナノメートルスケールの近接空間で選択的にタンパク質を酸化することが知られています。研究グループは、光触媒をタンパク質の特定の部位に近接させることで、部位選択的なヒスチジン残基が可能であると考え、抗体のFc領域[用語2]選択的な化学修飾に応用しました。磁気ビーズ表面に抗体のFc領域と結合する分子と光触媒を修飾し、磁気ビーズ上の反応場で抗体を修飾することで、部位選択的にヒスチジン残基を化学修飾することに成功しました。
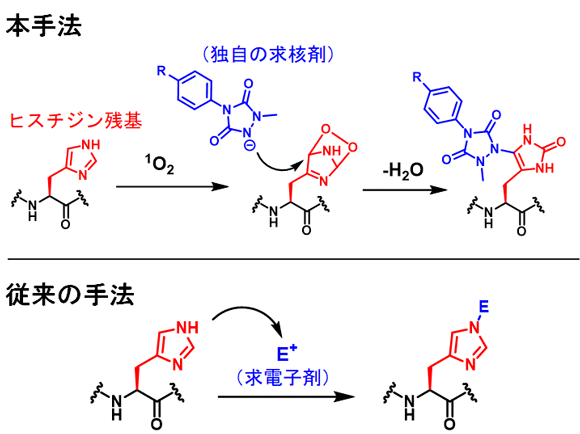
図1.本手法によるヒスチジン残基修飾法と従来法の違い
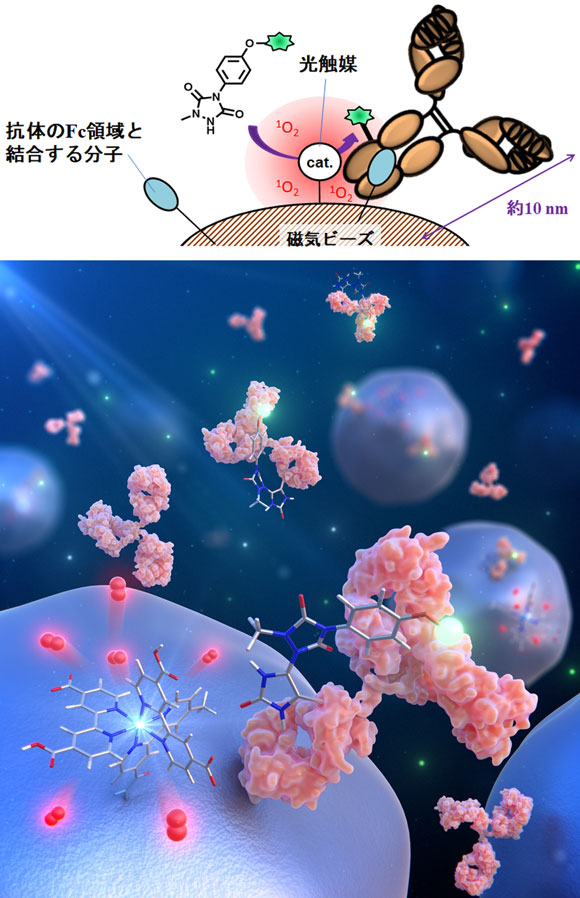
図2.磁気ビーズ上のナノ空間での抗体の部位特異的な化学修飾のイメージ
今後の予定および波及効果
触媒周辺のナノ空間でタンパク質を化学修飾する「近接標識法」は、タンパク質間相互作用の解明のための化学ツールとして近年注目されています。細胞内の酵素タグ周辺での近接標識と、標識されるタンパク質のプロテオミクス解析は未知のタンパク質間相互作用の網羅的な同定を可能にします。細胞内で一重項酸素を産生可能な酵素タグや光触媒は既に報告されており、可視光刺激により容易に発生のタイミングを制御できるため、細胞内近接標識への活用が期待されています。これまでは一重項酸素を活用した有用なタンパク質修飾法がボトルネックとなっていましたが、本手法により、細胞内のタンパク質間相互作用ダイナミクスを解析できる方法への発展が期待されます。
また、一重項酸素の産生能を有する低分子性の光触媒は多数知られており、そのような分子と生物活性分子を連結する戦略により、生物活性分子に結合する標的タンパク質を選択的に標識する手法に応用することができます。
- 用語説明
[用語1]一重項酸素 : 活性酸素種の一種です。光触媒への光照射によって、酸素分子から生じる高い反応性の活性種であり、マイクロ秒単位の寿命を持ちます。
[用語2] 抗体のFc領域 : 抗体はFab領域とFc領域の2つの領域に分けられます。Fab領域は抗原認識を担い、配列が抗体ごとに異なる一方で、Fc領域は抗体間で共通の配列から構成されています。
- 論文情報
| 掲載誌 : | Journal of the American Chemical Society |
|---|---|
| 論文タイトル : | Proximity Histidine Labeling by Umpolung Strategy Using Singlet Oxygen |
| 著者 : | Keita Nakane, Shinichi Sato*, Tatsuya Niwa, Michihiko Tsushima, Shusuke Tomoshige, Hideki Taguchi, Minoru Ishikawa, and Hiroyuki Nakamura |
| DOI : |
- 膨大な活性データの網羅的解析から低分子医薬品候補を創出|生命理工学系 News
- N-メチル化ペプチドを高収率・短時間で合成|生命理工学系 News
- 迅速・高収率でアミノ酸N-カルボキシ無水物を合成|生命理工学系 News
- 副反応を起こしやすいアミノ酸を迅速かつクリーンに連結|生命理工学系 News
- 中性子捕捉療法のための有望なホウ素薬剤を開発|生命理工学系 News
- 【研究室紹介】 中村・岡田研究室|生命理工学系 News
- 中村・岡田研究室
- 研究者詳細情報(STAR Search) - 中村浩之 Hiroyuki Nakamura
- 生命理工学院 生命理工学系
- 科学技術創成研究院 化学生命科学研究所
- 科学技術創成研究院
- 研究成果一覧