生命理工学系 News
筋収縮に不可欠な“横行小管”をつくる新たな仕組みを解明
生体膜変形のメカニズムに新たな知見
ポイント
- ショウジョウバエを用いて、筋細胞に特有の管状膜構造体である横行小管(T管)を対象にした大規模な解析を実施。
- 横行小管の形成に必須な新規因子として、直鎖(M1連結型)ユビキチン鎖を合成する酵素LUBEL(ルベル)を発見。
- ユビキチン化によって形成される集合体が、BAR(バー)ドメインタンパク質の膜変形機能を制御するという、新しいメカニズムを提唱。
概要
東京科学大学(Science Tokyo) 総合研究院 細胞制御工学研究センターの川口紘平特任助教と藤田尚信准教授(生命理工学コース 主担当)らの研究チームは、徳島大学の小迫英尊教授、大阪大学の池田史代教授らとの共同研究により、筋収縮に不可欠な横行小管(T管)の形成を制御する新しい分子機構を明らかにしました。
研究チームは、ショウジョウバエをモデルに用いて、T管の近接依存性標識プロテオミクス[用語1]とT管を標的としたRNAiスクリーニング[用語2]を実施しました。その結果、T管の形態形成に必須な新規因子として、直鎖(M1連結型)ユビキチン鎖[用語3]を合成する酵素LUBELを同定しました。さらに、LUBELのユビキチン化酵素としての活性に加えて、BARドメイン[用語4]タンパク質を介したAmph(アンフィファイジン)との結合、およびLUBELと直鎖ユビキチン鎖からなる自己集合体の形成が、T管の形成に不可欠であることを示しました。加えて、LUBELとAmphの連携は無脊椎動物で高度に保存されている一方で、脊椎動物ではカベオリン[用語5]に依存した別の仕組みへと進化的に置き換わっていることも判明しました。これにより、進化的視点からもT管形成機構の理解が大きく進展しました。
本研究は、これまで主に免疫系で機能すると考えられてきた直鎖ユビキチン鎖が、生体膜の形態制御に直接関わることを示す、意外性の高い発見です。また、ユビキチン化による集合体の形成がBARドメインタンパク質の膜変形機能を制御するという、新たな概念を提唱するものです。
本成果は、1月7日付(現地時間)の「Science Advances」誌に掲載されました。

背景
T管は、筋細胞の細胞膜が陥入して形成される管状のネットワーク構造であり、筋収縮において重要な役割を果たします。運動神経から筋細胞へ伝えられた刺激は、T管を通じて素早く筋細胞内部へ伝わります。それにより、筋小胞体からのカルシウム放出が誘導され、筋収縮が引き起こされます(図1:1〜5)。このように、T管は刺激を筋細胞深部へと伝える伝導路として機能しており、T管の形態異常は、先天性ミオパチーをはじめとする遺伝性および障害性の筋疾患に関係していることが知られています。
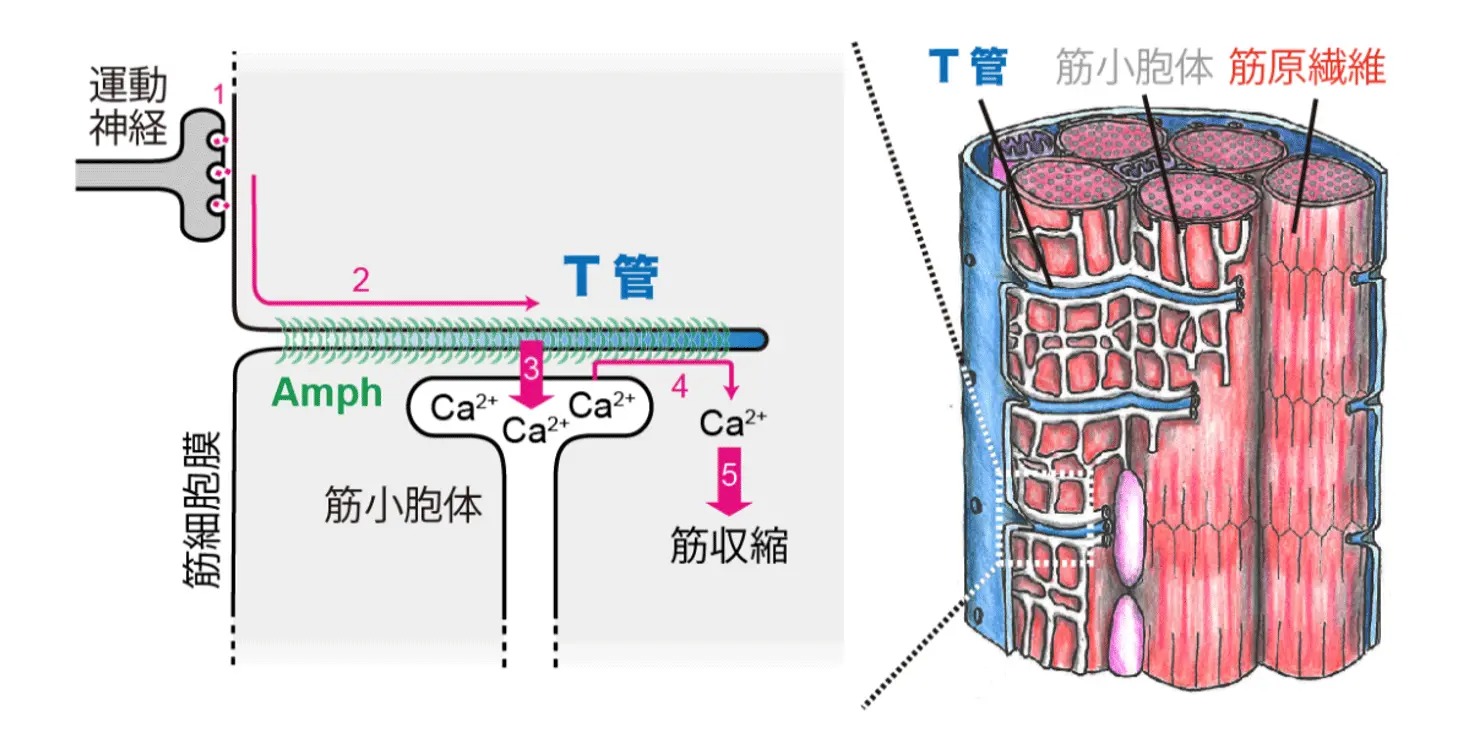
図1. T管を介した筋収縮の誘導(自著論文[参考文献1]を改変して作成したもの。ライセンス:CC BY 4.0.)
先天性ミオパチーの原因遺伝子の1つであるAmph2(アンフィファイジン2)は、 BARドメインを持ち、多量体化することで生体膜を管状化する働きを担っています(図1)。脊椎動物では、膜の陥入や曲率形成に働くカベオリンと呼ばれる分子が、Amph2による膜の管状化を開始させる初期段階を制御していると考えられています。しかし、進化的には、T管は膜変形能を持つカベオリンよりも前に獲得された構造であるため、カベオリンに依存しないT管形成機構が存在するはずだと長年推測されてきました。ところが、その仕組みはこれまで明らかになっておらず、筋細胞を対象とする研究領域における大きな未解決課題として残されていました[参考文献1]。
研究成果
本研究ではまず、T管の形成機構を解明するための足がかりとして、近接依存性標識プロテオミクスという手法により、T管近傍に存在するタンパク質を網羅的に同定しました[参考文献2]。続いて、得られた249の候補遺伝子について、T管を標的とした筋特異的なRNAiスクリーニングを行い、LUBELを含む7つのT管形成関連遺伝子を新たに同定することに成功しました。
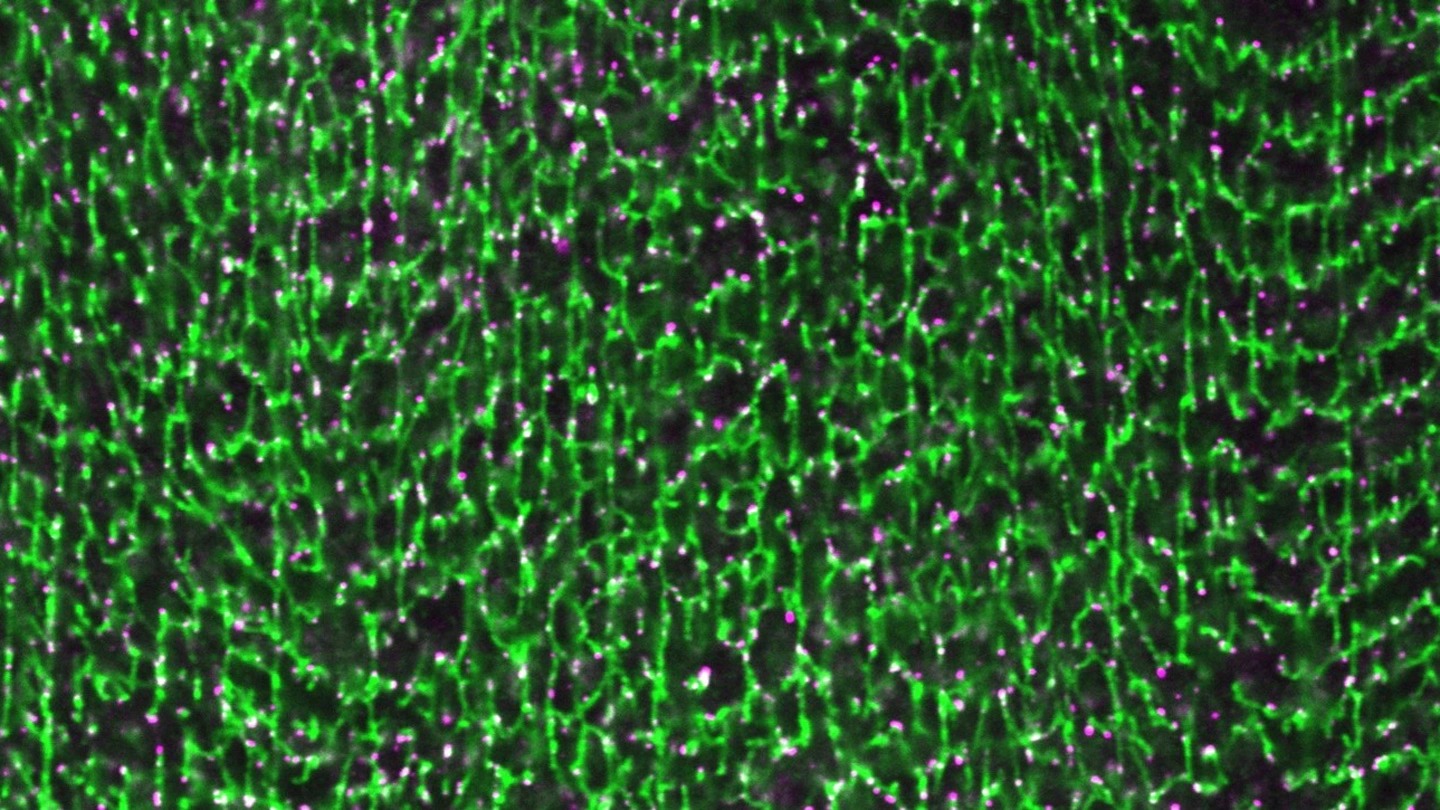
RNAiによるノックダウン(目的遺伝子の発現抑制)と同様に、LUBELの酵素活性を失わせた点変異体でもT管の形態異常が観察されたことから、LUBELによる直鎖ユビキチン化がT管形成に必須であることが明らかになりました。また、LUBELを欠損させた筋細胞では、Amphの量や膜局在は保たれているにもかかわらず、膜が管状化せず、シート状へと変化していました(図2)。このことから、Amphが膜上に存在するだけでは、T管特有の管状構造は形成されず、その過程にはLUBELによる制御が必須であることが示されました。さらに、LUBELのN末端に存在するプロリンリッチ配列と、Amphが持つSH3ドメイン[用語6]との相互作用(図3左)が、T管形成に必要であることも明らかになりました(図3右)。
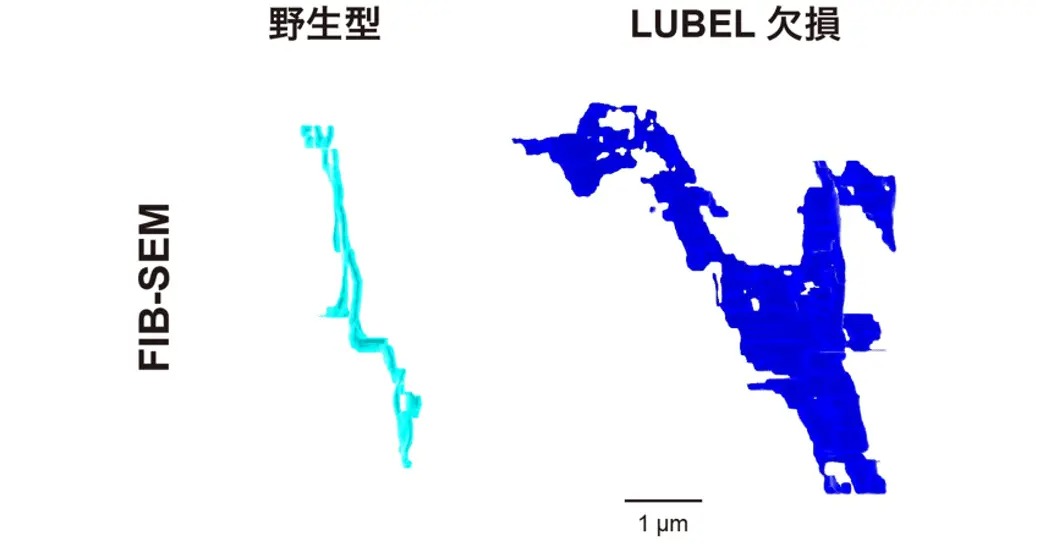
図2. LUBEL欠損筋細胞でみられるシート状の膜構造体(今回の発表論文を改変して作成したもの。ライセンス:CC BY 4.0. 図3~6も同様)
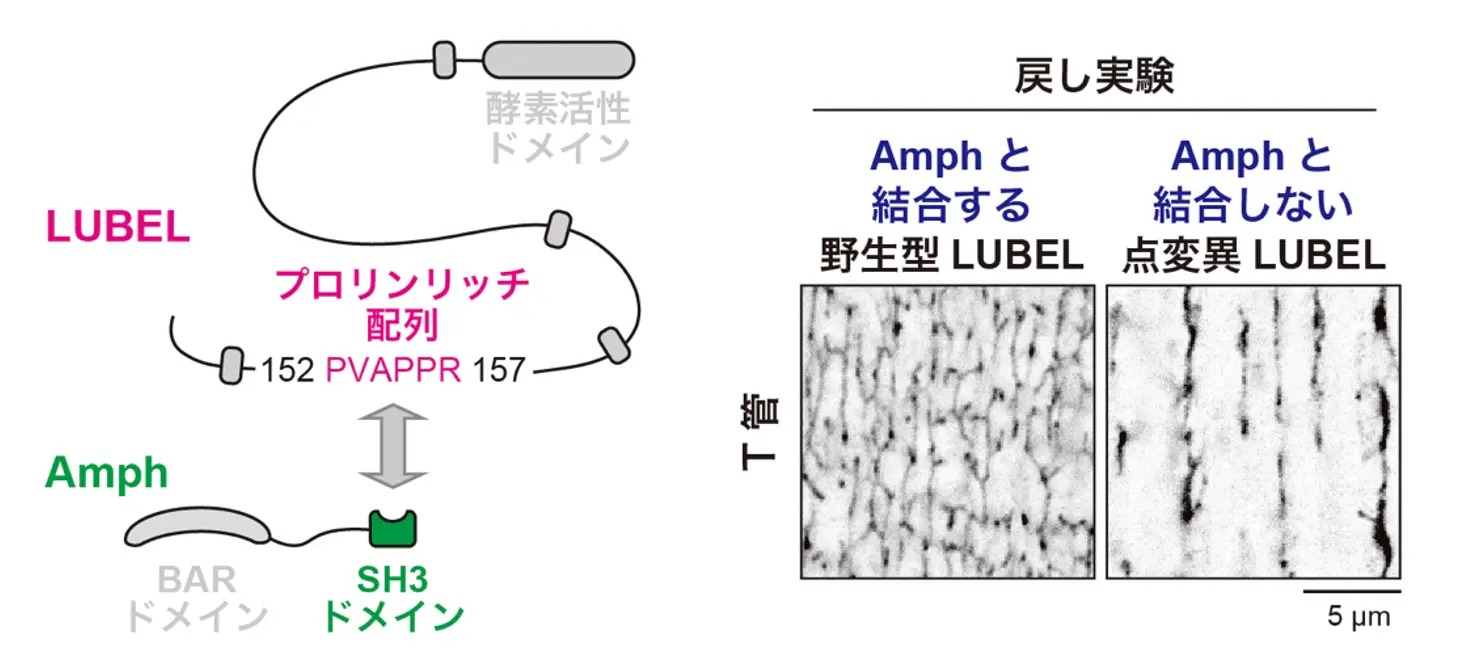
図3. Amph-LUBEL結合はT管形成に必須
LUBELはT管上で直鎖ユビキチン鎖とともに集合体を形成し、この集合体は発達途中のT管が伸長する部位に局在していました(図4左)。さらに、生化学的な解析によって、LUBELは天然変性領域(IDR)[用語7]を介した相互作用や、自らにユビキチン鎖を結合させる自己ユビキチン化を介して他のLUBEL分子とも相互作用することが明らかになりました。これらの複数の相互作用により、LUBELは集合体を形成すると考えられます(図4右)。また、この集合体の形成に重要な天然変性領域やユビキチン結合ドメインを欠失させると、T管形成能が失われることが分かりました。これらの結果から、LUBELおよび直鎖ユビキチン鎖を含む集合体の形成が、T管形成に必要であると考えられます。
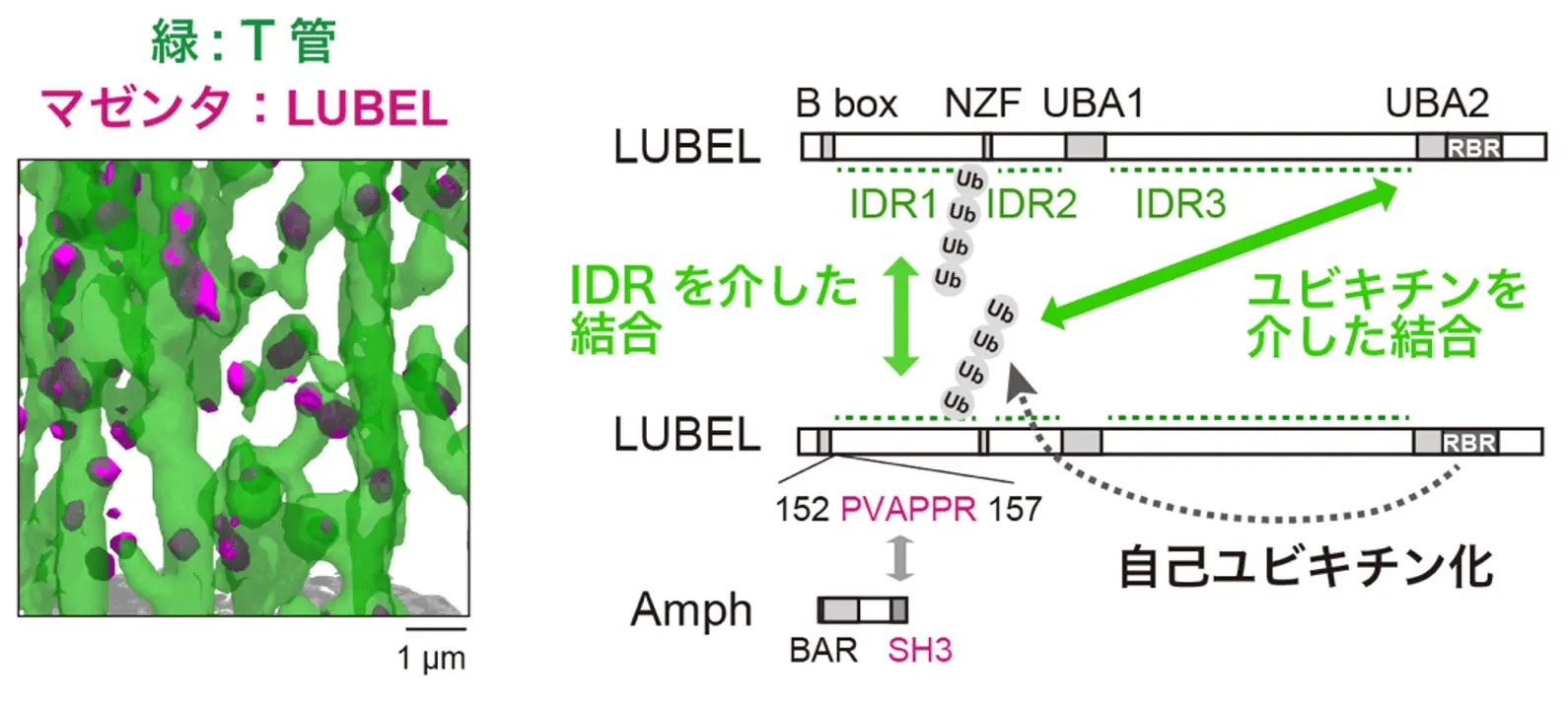
図4. T管上のLUBEL陽性集合体とLUBEL同士の多価相互作用
分子進化解析の結果、LUBELのような直鎖ユビキチン化酵素とAmphの結合は、多くの無脊椎動物で保存されていることが分かりました。その一方で、脊索動物や脊椎動物では失われており、代わりに膜変形能力を持つカベオリンが獲得されていました(図5)。このことから、進化の過程で直鎖ユビキチン化酵素に依存した膜変形機構が、カベオリンに依存したものへと置き換わったと考えられます(図6)。また、脊椎動物では直鎖ユビキチン化が主に免疫系での機能に特化して利用されるようになったのに対し、無脊椎動物では、直鎖ユビキチン鎖のより原始的な機能であると考えられる膜変形過程に利用されている可能性が示唆されます。
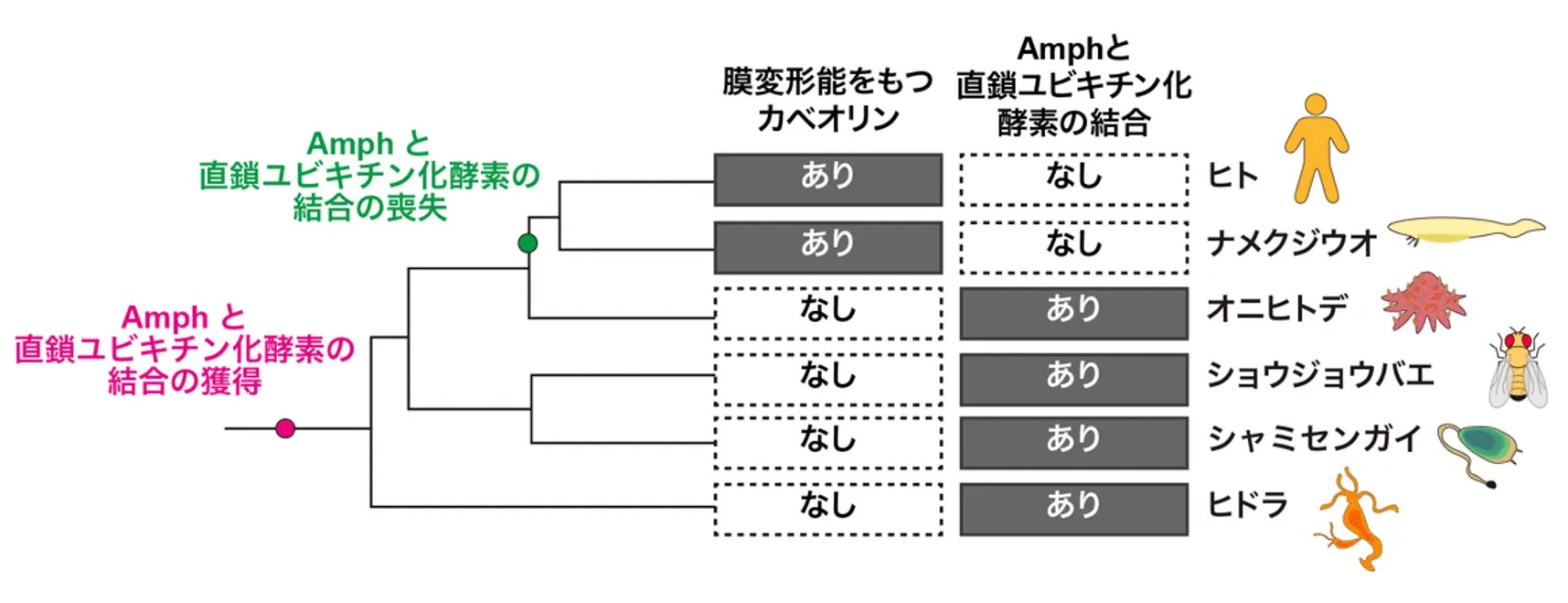
図5. Amphと直鎖ユビキチン化酵素の相互作用とカベオリンの分子進化解析
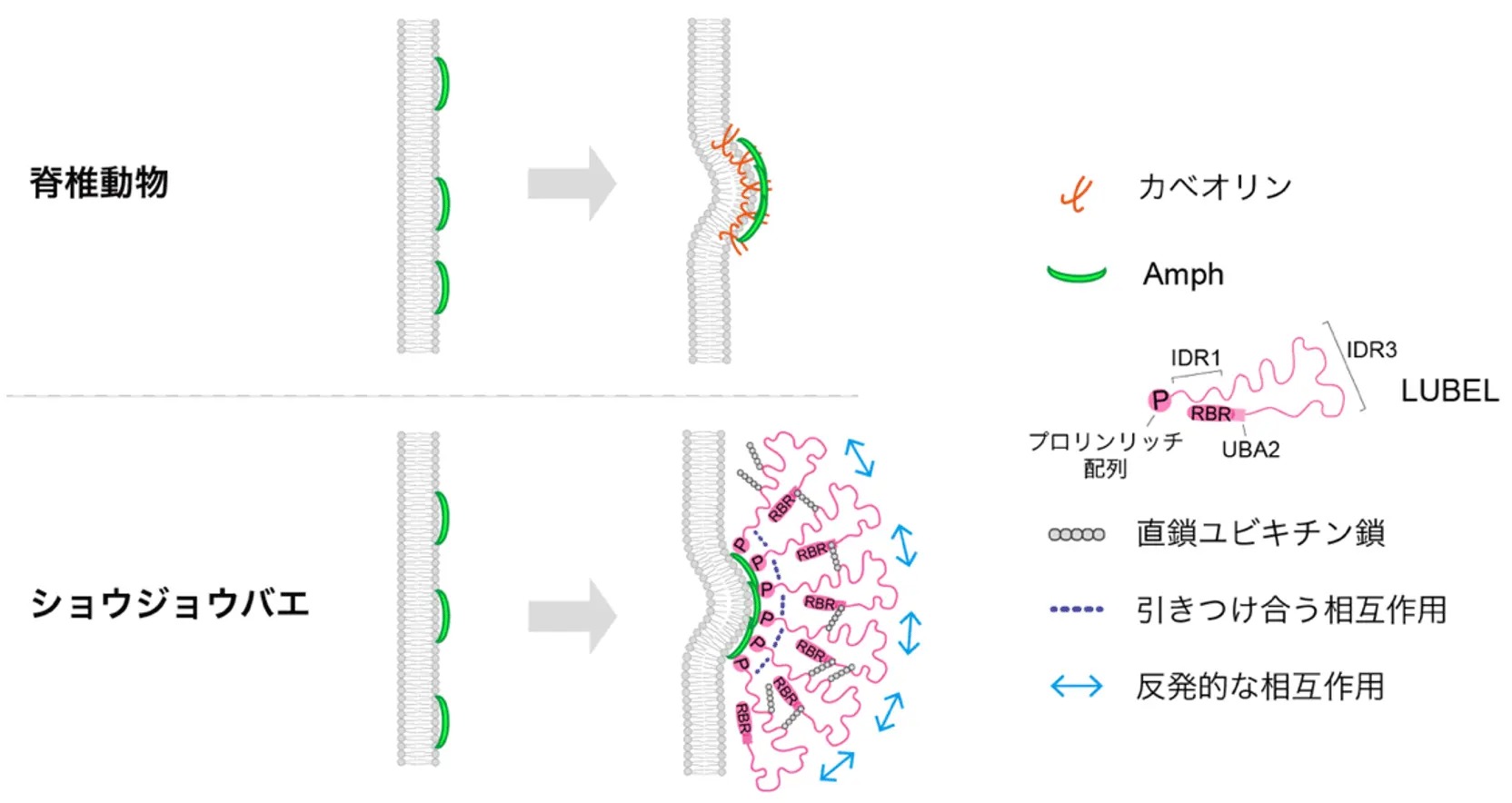
図6. Amphと直鎖ユビキチン化の連携による機構はカベオリン依存機構に置き換わっている
社会的インパクト
本研究は、筋細胞生物の長年の未解決課題であった「カベオリンに依存しない、より原始的なT管形成機構」を明らかにしました。また、これまで主に免疫系での役割が知られていた直鎖ユビキチン化が、無脊椎動物では生体膜の変形に利用されていることを示す、意外性の高い発見でもあります。さらに、今回得られた知見は、「ユビキチン化によるタンパク質集合体の形成が、 BAR ドメインタンパク質の膜変形機能を制御する」という新たな概念を提示しました。多くの BAR ドメインタンパク質は SH3などのタンパク質結合ドメインを持ち、ユビキチン化酵素と直接結合し得ることが知られています。そのため、直鎖ユビキチン鎖だけでなく、他の結合様式のユビキチン鎖による制御機構が存在する可能性があり、膜リモデリングの分子機構の理解を大きく拡げる成果と言えます。
今後の展開
直鎖ユビキチン鎖を認識する分子がT管の形成に関与している可能性が高いものの、本研究で実施したRNAiスクリーニングでは同定されませんでした。また、LUBEL以外にも直鎖ユビキチン化を受ける基質が存在する可能性があり、それらはタンパク質にとどまらず、近年ユビキチン化されることが分かってきた脂質や糖鎖である可能性も考えられます。今後は、これらを含めた直鎖ユビキチン化基質の網羅的同定と機能解析が求められます。このように、直鎖ユビキチン鎖を介したT管の形成過程には、LUBEL以外の複数の分子が関与している可能性が高く、その全体像の解明が次の重要な課題となります。
- 付記
本研究は、国立研究開発法人 日本医療研究開発機構(課題番号:JP19ek0109285h0003)、文部科学省 科学研究費補助金(課題番号:JP21H05147、JP25K02270)、アステラス病態代謝研究会、ならびにJSTさきがけ(課題番号:JPMJPR18H8)の支援を受けて実施されました。ここに深く感謝申し上げます。
- 参考文献
[参考文献1] Kawaguchi K, Fujita N. Shaping transverse-tubules: central mechanisms that play a role in the cytosol zoning for muscle contraction. J Biochem. 2024 Feb 25;175(2):125-131. DOI : 10.1093/jb/mvad083. PMID: 37848047; PMCID: PMC10873525.
[参考文献2] 澤崎達也、小迫英尊:実験医学別冊 最強のステップUPシリーズ リアルな相互作用を捉える近接依存性標識プロトコール、ISBN 978-4-7581-2274-0
- 用語説明
[用語1] 近接依存性標識プロテオミクス:特定のタンパク質のごく近くに存在する分子に化学標識を付け、これらの標識されたタンパク質を精製・同定することで、目的タンパク質の局所的な相互作用ネットワークを明らかにする手法。
[用語2] RNAiスクリーニング:RNA干渉(RNAi)により目的遺伝子の発現を抑制し、その結果生じる表現型の変化から、機能する遺伝子を体系的に同定する手法。
[用語3] 直鎖(M1連結型)ユビキチン鎖:ユビキチンがそのN末端のメチオニンを介して直鎖状に連結された特殊なユビキチン修飾形態。主にNF-κBシグナルなど炎症応答や免疫制御に重要であることが知られている。
[用語4] BARドメイン:複数のαヘリックスが束ねられたバナナ型の立体構造を持つタンパク質ドメイン。脂質膜の曲率の認識や形態変化に関わる。
[用語5] カベオリン:細胞膜に形成される 直径50–100 nm 程度の陥入構造カベオラを形作る主要な膜タンパク質。膜の陥入・曲率形成に働く。
[用語6] SH3ドメイン:タンパク質同士の結合に重要な、プロリンリッチ配列を特異的に認識して結合するタンパク質ドメイン。
[用語7] 天然変性領域(IDR):特定の立体構造をとらず柔軟にゆらいだ状態で存在するタンパク質領域。他の分子と可逆的に結合しやすく、集合体形成やシグナル制御などに重要な役割を果たす。
- 論文情報
| 掲載誌: | Science Advances |
|---|---|
| タイトル: | Linear ubiquitination triggers Amph-mediated T-tubule biogenesis |
| 著者: | Kohei Kawaguchi, Yutaro Hama, Harunori Yoshikawa, Kohei Nishino, Kazuki Morimoto, Tsuyoshi Nakamura, Michiko Koizumi, Yuriko Sakamaki, Kota Abe, Soichiro Kakuta, Koichiro Ichimura, Fumiyo Ikeda, Hidetaka Kosako, Naonobu Fujita |
| DOI: |
10.1126/sciadv.ady4934 |
研究者プロフィール
藤田 尚信 Naonobu Fujita
東京科学大学 総合研究院 細胞制御工学研究センター 准教授
研究分野:細胞生物学
関連リンク
- 蛹期に備えて幼虫脂肪体のオートファジーは抑制される|生命理工学系 News
- 筋細胞内に管状のリソソームネットワークを発見|生命理工学系 News
- 細胞のコラーゲン分泌機構の一部を解明|生命理工学系 News
- 藤田 尚信 Naonobu Fujita|ScienceTokyo研究情報データベース(理工学系)
- 川口 紘平 Kohei Kawaguchi|ScienceTokyo研究情報データベース(理工学系)
- 藤田研究室
- 細胞制御工学研究センター
- 総合研究院
- 生命理工学系
- 生命理工学院