生命理工学系 News
蛹期に備えて幼虫脂肪体のオートファジーは抑制される
要点
- オートファジーによる任意のタンパク質の分解を生細胞で解析できる新たなシステムを開発
- ショウジョウバエの幼虫の最終期には、哺乳動物の肝臓と脂肪組織にあたる脂肪体で、タンパク質などの分解を担うリソソームの機能が低下することを発見
- 多様な疾患の分子標的となりうるオートファジー・リソソーム機能の調節メカニズムの理解へ向け、新たな知見を提供することに期待
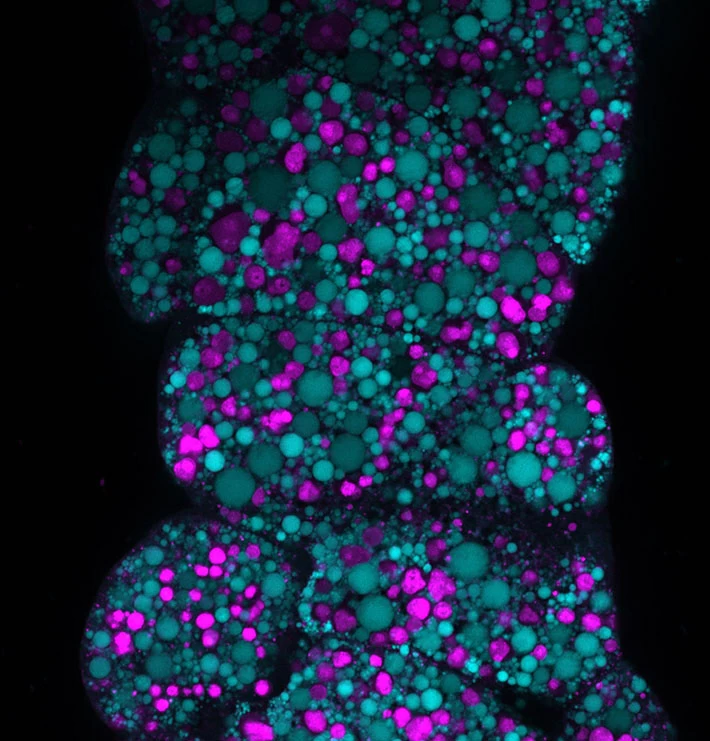
幼虫最終期の脂肪体内に見られる肥大したオートリソソーム(マゼンタ)と脂肪滴(シアン)
概要
東京工業大学 生命理工学院 生命理工学系の村川直柔大学院生(科学技術創成研究院リサーチフェロー)、科学技術創成研究院 細胞制御工学研究センターの藤田尚信准教授(生命理工学コース主担当)らは、同研究センターの木村宏教授(生命理工学コース主担当)、コロラド州立大学のTimothy Stasevich(ティモシー・スタセビッチ)准教授(東京工業大学 科学技術創成研究院WRHI特任准教授)との共同研究により、任意のタンパク質のリソソーム[用語1]分解を生細胞で観察する新システムを開発し、ショウジョウバエの幼虫の最終期に、脂肪体[用語2]にあるリソソームの機能が抑制されることを発見した。さらに、この機能抑制の結果、オートファジー[用語3](図1)が阻害され、脂肪体内にオートリソソーム[用語4]が蓄積することを明らかにした。脂肪体内に蓄積したオートリソソームは、外部からの栄養供給が絶たれた蛹期の栄養源として利用される。
幼虫の最終期に、脂肪体内にオートリソソームが蓄積する原因は、オートファジーの亢進によるものだとこれまで考えられていたが、今回新たに開発した生細胞でオートファジーによる分解を観察可能なシステムによって、オートリソソームの蓄積がオートファジーの抑制によるものであることを初めて明らかにした。
オートファジー・リソソーム系の異常は、神経変性疾患などの原因となることが知られている。本研究成果は、多様な疾患の分子標的となりうるオートファジー・リソソーム機能の調節メカニズムの理解へ向けて、新たな知見を提供すると期待される。
研究成果は2022年3月23日付で英国科学誌「Development(デベロップメント)」電子版に掲載された。
背景
オートファジーは細胞質成分の大規模な分解システムであり、飢餓時の栄養源の確保や細胞質成分の新陳代謝のみならず、発生などにも重要であることが知られている。
オートファジーが誘導されると、細胞質成分がオートファゴソームにより隔離される。その後、オートファゴソームとリソソームが融合し、オートファゴソームの内容物はリソソーム由来の酸性加水分解酵素により分解される(図1)。
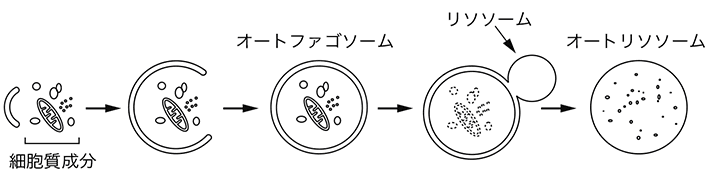
図1 オートファジーの模式図
ショウジョウバエを含む多くの昆虫は、哺乳動物の肝臓と脂肪組織の機能を併せ持ちエネルギー代謝で中心的な働きを担う、脂肪体と呼ばれる器官を持っている。ショウジョウバエの幼虫の最終期には、脂肪体内に肥大したオートリソソームが蓄積する。その原因は、変態ホルモン[用語5]の作用によってオートファジーが亢進するためであるとこれまで長らく考えられてきたが、その実体は不明であった。
東京工業大学の木村宏教授らのグループと、コロラド州立大学のTimothy Stasevich(ティモシー・スタセビッチ)准教授らのグループは、ヒトインフルエンザウイルスタンパク質であるヘマグルチニン由来のエピトープタグ[用語6]であるHAエピトープを生細胞で検出できるようにした、遺伝子コード型の抗体プローブ[用語7]「Frankenbody」を先に開発した[参考文献1]。
一方、ショウジョウバエには、遺伝子にHAエピトープを付加したゲノムワイドな組換え体ライブラリーが整備されつつある[参考文献2]。
そこで本研究では、両者を組み合わせ、ショウジョウバエの幼虫の最終期に脂肪体内にオートリソソームが蓄積する仕組みの解明に取り組んだ。
研究の手法と成果
1. ショウジョウバエの生細胞でタンパク質の機能解析を行うための新システムの構築
オートファジーによる分解を正確に評価するには、オートファジー関連構造体の数や大きさの観察だけでは不十分である。しかしながら、ショウジョウバエの生体内でオートファジーを解析する良いシステムがなかったことから、幼虫最終期の脂肪体で見られるオートファジーの実体はこれまで不明であった。
そこで本研究では、生細胞においてHAエピトープを検出することができる抗体プローブであるFrankenbodyと、各遺伝子にHAタグを融合させたショウジョウバエの組換え体ライブラリーを利用して、新たな解析システムの構築に取り組んだ。蛍光タンパク質を付加したFrankenbodyとHAタグ付きのタンパク質を目的の組織に同時に発現させることにより、任意のタンパク質の細胞内局在と、オートファジーによる分解を生細胞で解析できるようになった。図2にその仕組みを示す。
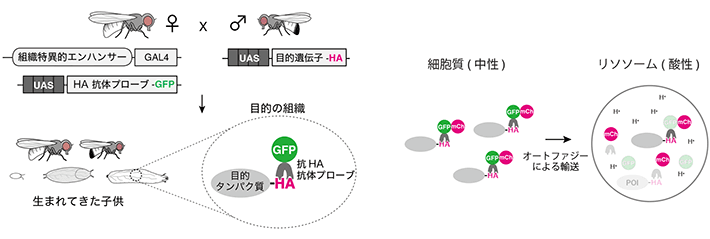
図2 Frankenbodyを利用した解析方法の概要
(左)タンパク質の局在観察に広く用いられる緑色蛍光タンパク質(GFP)をFrankenbodyに付加することにより、目的の組織における目的遺伝子の局在を生細胞において観察することが可能となる。
(右)本研究では、Frankenbodyに緑色蛍光タンパク質(GFP)と赤色蛍光タンパク質(mCh)を並列に付加して、目的タンパク質のオートファジーによる分解を解析した。mChはリソソーム内でも発光する一方、GFPは酸性条件下、つまり通常のリソソーム内の環境では発光しない。したがって、mChと比較してGFPの蛍光強度が低下した場合は、目的タンパク質がオートファジーによりリソソームに運ばれて分解されたと判断できる。このように、蛍光タンパク質の特性を利用し、目的タンパク質のオートファジーによる分解を評価することが可能となる。
2. ショウジョウバエの脂肪体におけるオートファジー活性の評価
本研究で開発した解析方法によって、ショウジョウバエの脂肪体におけるオートファジー活性を調べたところ、幼虫最終期の脂肪体ではGFPが消光しておらず、オートファジーが阻害されていることが分かった。またその原因は、タンパク質をはじめとした物質の分解を担うリソソームの機能が低下しているためであった(図3)。つまり、ショウジョウバエの幼虫最終期の脂肪体では、リソソームの機能が抑制されることにより分解が阻害され、肥大したオートリソソームが蓄積していた。
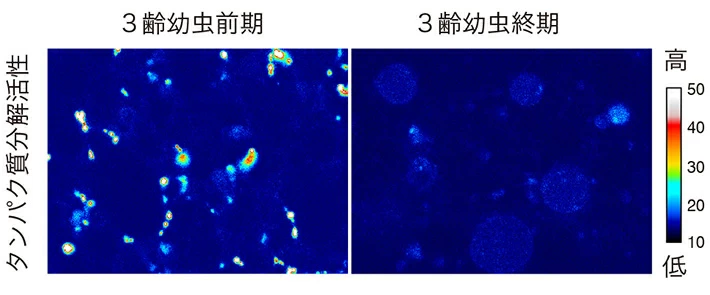
図3 幼虫最終期の脂肪体で見られるリソソーム活性の低下
3齢幼虫の前期(左)で見られる脂肪体のリソソームにおけるタンパク質分解活性が、終期(右)では有意に低下していることが分かる。
3. 実験による検証
幼虫最終期の脂肪体においてリソソームの機能を強制的に活性化させると、ショウジョウバエは蛹期に致死となった。脂肪体に蓄積したオートリソソームは、蛹期に急激に減少することが知られている。蛹期には外部からの栄養供給が絶たれ疑似的な飢餓状態になることから、脂肪体に蓄積されたオートリソソームは、アミノ酸等の貯蔵庫として蛹期に利用されていると考えられる(図4)。
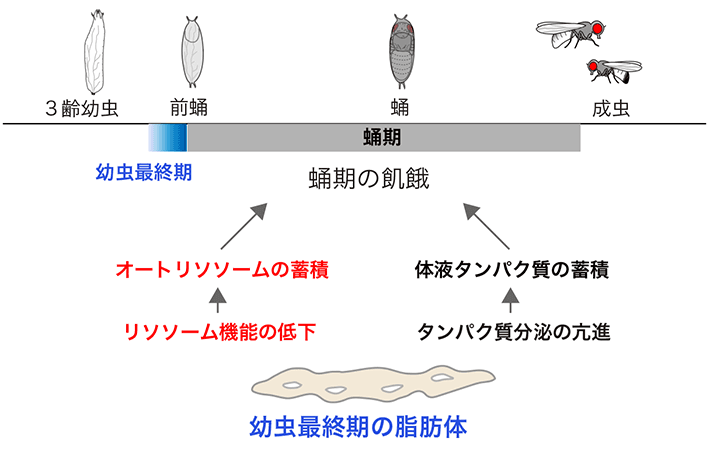
図4 蛹期に備えた脂肪体リソソーム活性の抑制
幼虫最終期の脂肪体では、リソソーム機能が抑制され、オートリソソームが蓄積される。また、この時期の脂肪体は体液中にタンパク質を大量に分泌する。ショウジョウバエは、これらを利用して、蛹期の飢餓を乗り越えていると考えられる。
今後の展開
本研究では、生体内でオートファジー活性を評価できる新たな解析方法を開発することによって、脂肪体で見られるオートリソソーム蓄積の原因がリソソーム活性の抑制であることを初めて明らかにした。
しかしながら、変態ホルモンの作用により、どのようなメカニズムでリソソーム活性が抑制されているのかその詳細は未だ不明であり、今後の解明が待たれる。
オートファジー・リソソーム系の異常は、神経変性疾患などの引き金となることが知られている。本研究成果は、多様な疾患の分子標的となりうるリソソーム機能の調節メカニズムの理解へ向けて、新たな知見を提供すると期待される。
- 用語説明
[用語1] リソソーム : 種々の物質を分解する、さまざまな酸性加水分解酵素を含む細胞小器官。通常は球状であり、その内部は酸性に保たれている。ライソゾームとも呼ばれる。
[用語2] 脂肪体 : 哺乳動物の肝臓と脂肪組織との機能を併せ持つ器官。ショウジョウバエを含む多くの昆虫に見られる。
[用語3] オートファジー : 酵母などの単細胞生物から動植物まで、細胞核を有するあらゆる生物に保存された細胞内物質を分解する仕組み。自食作用とも呼ばれる。飢餓時の栄養源の供給に加えて、老化したタンパク質や有害・異常なタンパク質の分解などにも関わっている。このオートファジーに関する研究は、2016年のノーベル医学生理学賞の対象となった。
[用語4] オートリソソーム : オートファゴソームとリソソームが融合することにより、一過的に形成される細胞内小器官。内容物が分解された後は、オートリソソームからリソソームが再生される。
[用語5] 変態ホルモン : 動物の変態を促すホルモン。ショウジョウバエの幼虫から成虫への変態は、ステロイドホルモンであるエクジソンにより制御されている。
[用語6] エピトープタグ : 抗体は、抗原の表面に存在する「エピトープ」と呼ばれる特異的な標的を認識して結合する。解析対象とするさまざまなタンパク質に既知のエピトープタグを融合させ、そのエピトープと特異的に結合する抗体を用いてタンパク質の解析を行う技術を「エピトープタグ法」と呼ぶ。
[用語7] 抗体プローブ : タンパク質、糖、低分子化合物といった標的因子を可視化するために、抗体分子の抗原特異性を利用したもの。
- 参考文献
[1] Zhao N. et al., "A genetically encoded probe for imaging nascent and mature HA-tagged proteins in vivo." Nat Commun. (2019) 10(1): 2947
(参考)生細胞イメージングのための新しい分子ツールを開発|東工大ニュース
[2] Bischof J. et al., "A versatile platform for creating a comprehensive UAS-ORFome library in Drosophila." Development (2013) 140(11): 2434-42
| 掲載誌 : | Development |
|---|---|
| 論文タイトル : | A Drosophila toolkit for HA-tagged proteins unveils a block in autophagy flux in the last instar larval fat body |
| 著者 : | Tadayoshi Murakawa, Tsuyoshi Nakamura, Kohei Kawaguchi, Futoshi Murayama, Ning Zhao, Timothy J Stasevich, Hiroshi Kimura, and Naonobu Fujita |
| DOI : |
- 筋細胞内に管状のリソソームネットワークを発見|生命理工学系News
- 【研究室紹介】 藤田研究室|生命理工学系 News
- 藤田研究室
- 木村研究室
- Timothy J. Stasevich | Tokyo Tech World Research Hub Initiative (WRHI)
- 藤田尚信 Naonobu Fujita|研究者検索システム 東京工業大学STARサーチ
- 木村宏 Hiroshi Kimura|研究者検索システム 東京工業大学STARサーチ
- Timothy J Stasevich|研究者検索システム 東京工業大学STARサーチ
- 科学技術創成研究院 細胞制御工学研究センター
- Tokyo Tech World Research Hub Initiative (WRHI)
- 科学技術創成研究院(IIR)
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
准教授 藤田尚信
E-mail : nafujita@bio.titech.ac.jp
Tel : 045-924-5131
※4月12日 14:40 誤字を修正しました。