生命理工学系 News
【研究室紹介】 藤田研究室

主担当 生命理工学コース
准教授 藤田 尚信![]()
| キーワード | オルガネラ、筋細胞、ショウジョウバエ、オートファジー、リソソーム |
|---|---|
| WEBサイト |
研究紹介
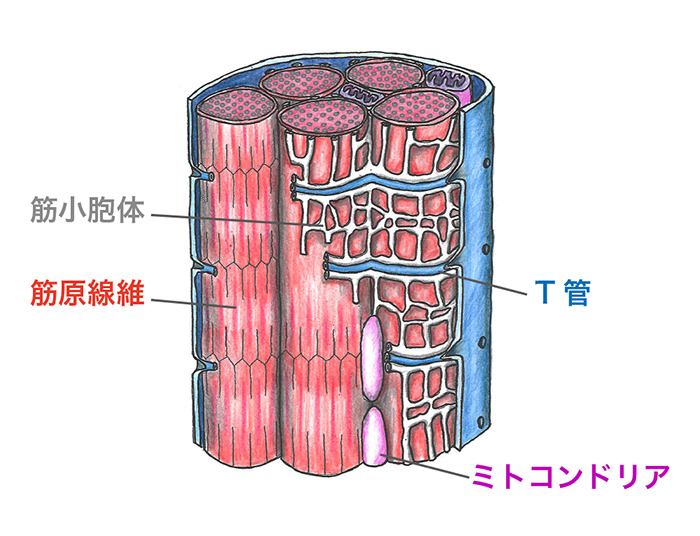
筋細胞は多核の巨大な細胞であり、T管などの高度に組織化されたユニークなオルガネラを持ちます。
それらの構造と生理的な重要性は良く理解されていますが、形作られるメカニズムは驚くほど明らかにされていません。
私たちは、主にショウジョウバエと培養細胞を用いて、筋細胞のオルガネラが形成・再構成されるメカニズムの解明に取り組んでいます。
また、ショウジョウバエを利用した独自のアプローチにより、オートファジー・リソソーム経路の分子メカニズムと生物学的機能の解明にも取り組んでいます。
1. ショウジョウバエを利用した筋細胞の研究
筋細胞オルガネラの研究が立ち遅れてきた要因に、十分に発達した筋細胞を培養系で再現できず、ハイスループットな解析ができなかった点があげられます。
私たちは、筋細胞の構造が進化的によく保存されていることに着目し、ショウジョウバエを用いて、筋オルガネラが形成・再構成されるメカニズムを明らかにしようとしています。
ショウジョウバエの筋細胞は体表直下に位置するため、蛍光タンパク質を付加したオルガネラマーカーを発現させることにより、生きた個体の筋細胞オルガネラを共焦点顕微鏡により簡便に観察でき、ハイスループットな解析も可能です。
また、筋疾患の遺伝学解析、ショウジョウバエの遺伝学、また細胞生物学的手法を駆使して、ヒト遺伝性筋疾患の原因遺伝子の同定と機能解析にも取り組んでいます。

2. 筋細胞リモデリングのメカニズムの解析
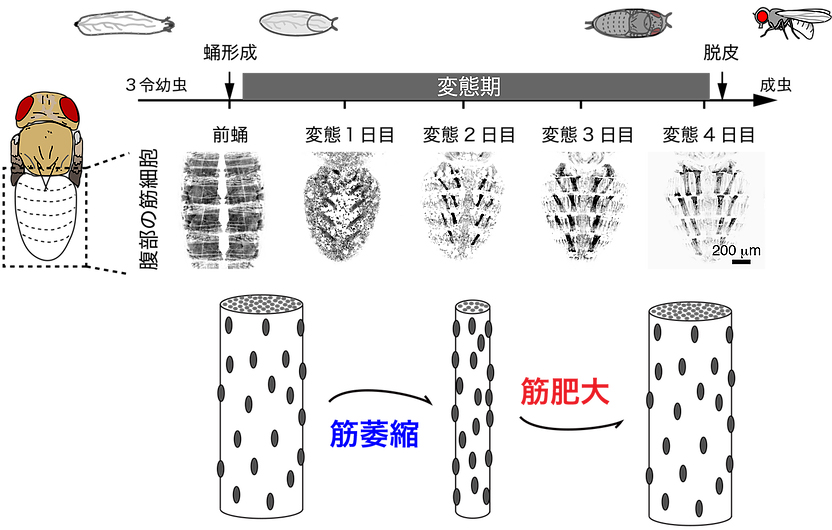
筋細胞は最終分化した細胞ですが可塑性を持ち、体内環境の変化に応じて、恒常的に萎縮と肥大(リモデリング)を繰り返しています。
その際、筋原線維の増減に伴いオルガネラも適切に分解・再構成されていますが、そのメカニズムはほとんど明らかにされていません。
私たちは、ショウジョウバエの変態期に、腹部の一群の筋細胞のオルガネラが壊された後に再形成される新たな現象を発見しました。
この現象は、筋萎縮・筋肥大の良い解析モデルになると考えられます。
これまでの解析から、筋細胞の再構成にオートファジーが重要な役割を果たしていることを明らかにしましたが、まだまだ多くの謎が残されています。
RNAseqによる遺伝子発現の解析、ライブイメージング、また遺伝学的な手法などを駆使して、筋細胞リモデリングの全容を明らかにします。
3. オートファジーを介した分泌経路の解析
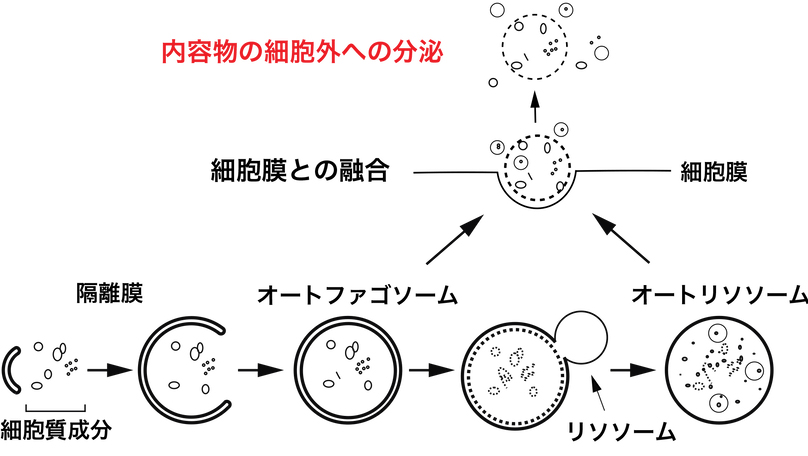
通常の分泌タンパク質は、シグナルペプチドを持ち粗面小胞体上で翻訳され、小胞体とゴルジ体を経由して細胞外へ分泌されます。しかしながら、シグナルペプチドを持たないタンパク質の中にも、ガレクチンやインターロイキン(IL)-1ベータなどのように、細胞外で重要な機能を持つものが多数知られています。
これらの分泌にオートファジーが関わることが示唆されていますが、その実体はこれまで明らかにされていません。
私たちは、ショウジョウバエの筋細胞から、オートファジーを介してかなりの量の細胞質タンパク質が分泌されていることを見出しました。
独自のアッセイ法と、ショウジョウバエの遺伝学的手法を組み合わせて、オートファジーを介した分泌に働く一群の遺伝子を同定します。
さらに、オートファジーに依存して分泌されるカーゴタンパク質の網羅的な解析にも取り組んでいます。
研究成果
- 代表的な論文
- 1.Homma, Y., Kinoshita, R., Kuchitsu, Y., Wawro, P. S., Marubashi, S., Oguchi, M., Ishida, M., Fujita, N., Fukuda, M. Comprehensive knockout analysis of the Rab family GTPases in epithelial cells.J Cell Biol (2019) 218, 2035-2050.
- 2.Kuchitsu, Y., Homma, Y., Fujita, N.#, and Fukuda, M.# Rab7 knockout unveiled regulated autolysosome maturation induced by glutamine starvation J Cell Sci (2018) 131, jcs215442 (# co-corresponding authors)
- 3.Fujita, N.#, Huang, W., Lin, T.H., Groulx, J.F., Jean, S., Nguyen, J., Kuchitsu, Y., Koyama-Honda, I., Mizushima, N., Fukuda, M., and Kiger, A.A.# Genetic screen in Drosophila muscle identifies autophagy-mediated T-tubule remodeling and a Rab2 role in autophagy. Elife (2017) 6. e23367 (# co-corresponding authors)
- 4.Fujita, N.*, Morita, E.*, Itoh, T., Tanaka, A., Nakaoka, M., Osada, Y., Umemoto, T., Saitoh, T., Nakatogawa, H., Kobayashi, S., Haraguchi, T., Guan, J.L., Iwai, K., Tokunaga, F., Saito, K., Ishibashi, K., Akira, S., Fukuda, M., Noda, T., and Yoshimori, T. Recruitment of the autophagic machinery to endosomes during infection is mediated by ubiquitin. J Cell Biol (2013) 203, 115-128. (* co-first authors)
- 5.Hamasaki, M., Furuta, N., Matsuda, A., Nezu, A., Yamamoto, A., Fujita, N., Oomori, H., Noda, T., Haraguchi, T., Hiraoka, Y., Amano, A., and Yoshimori, T. Autophagosomes form at ER-mitochondria contact sites. Nature (2013) 495, 389-393.
- 6.Fujita, N., Saitoh, T., Kageyama, S., Akira, S., Noda, T., and Yoshimori, T. Differential involvement of Atg16L1 in Crohn disease and canonical autophagy: analysis of the organization of the Atg16L1 complex in fibroblasts. J Biol Chem (2009) 284, 32602-32609.
- 7.Hayashi-Nishino, M., Fujita, N., Noda, T., Yamaguchi, A., Yoshimori, T., and Yamamoto, A. A subdomain of the endoplasmic reticulum forms a cradle for autophagosome formation. Nat Cell Biol (2009) 11, 1433-1437.
- 8.Saitoh, T.*, Fujita, N.*, Hayashi, T., Takahara, K., Satoh, T., Lee, H., Matsunaga, K., Kageyama, S., Omori, H., Noda, T., Yamamoto, N., Kawai, T., Ishii, K., Takeuchi, O., Yoshimori, T., and Akira, S. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response.
Proc Natl Acad Sci U S A (2009) 106, 20842-20846. (* co-first authors) - 9.Saitoh, T. *, Fujita, N.*, Jang, M.H., Uematsu, S., Yang, B.G., Satoh, T., Omori, H., Noda, T., Yamamoto, N., Komatsu, M., Tanaka, K., Kawai, T., Tsujimura, T., Takeuchi, O., Yoshimori, T., and Akira, S. Loss of the autophagy protein Atg16L1 enhances endotoxin-induced IL-1beta production. Nature (2008) 456, 264-268. (* co-first authors)
- 10.Fujita, N., Hayashi-Nishino, M., Fukumoto, H., Omori, H., Yamamoto, A., Noda, T., and Yoshimori, T. An Atg4B mutant hampers the lipidation of LC3 paralogues and causes defects in autophagosome closure. Mol Biol Cell (2008) 19, 4651-4659.
- 11.Fujita, N., Itoh, T., Omori, H., Fukuda, M., Noda, T., and Yoshimori, T. The Atg16L complex specifies the site of LC3 lipidation for membrane biogenesis in autophagy. Mol Biol Cell (2008) 19, 2092-2100.
- 主な日本語総説
- 1.朽津芳彦、藤田尚信、福田光則『Rabによるオートファジーの制御』
実験医学 35: 2516-2523 (2017) - 2.藤田尚信『ショウジョウバエを用いたメンブレントラフィックの研究』
メンブレントラフィック(福田光則、吉森保編・化学同人)(2016) p226-235 - 3.藤田尚信、吉森保『オートファジー ∼分子機構と疾患との関連∼』
BIO Clinica 26: 269-372 (2011) - 4.松永耕一、藤田尚信、吉森保『オートファジーの駆動・制御機構の進化と疾患とのかかわり』
実験医学 27: 2930-2936 (2009) - 5.藤田尚信、松永耕一、野田健司、吉森保
哺乳類オートファジー研究の夜明け
蛋白質核酸酵素 53(16) : 2106-2021 (2008)
教員紹介
藤田 尚信 准教授
- 学歴
| 2003年 | 東京農工大学農学部 卒業 |
|---|---|
| 2008年 | 総合研究大学院大学生命科学研究科後期博士課程 修了 博士(理学)を取得 |
- 職歴
| 2008-09年 | 大阪大学微生物病研究所 谷口奨励研究員 |
|---|---|
| 2010-11年 | 大阪大学大学院生命機能研究科 助教 |
| 2012-15年 | カリフォルニア大学サンディエゴ校 博士研究員 |
| 2016-18年 | 東北大学大学院生命科学研究科 助教 |
| 2018- | 科学技術振興機構 さきがけ研究 研究者 兼任 |
| 2019- | 東京工業大学 准教授(現職) |
- 受賞歴
| 2017年 | 日本細胞生物学会 若手優秀発表賞受賞 |
|---|
- 所属学会
日本細胞生物学会、日本筋学会
学生へのメッセージ
- 藤田准教授より
研究は創造的なものです。同じ結論に至る場合にも、その人の個性が大きく反映されます。結果のみでなくプロセスも含めて研究活動を楽しみましょう!
※この内容は掲載日時点の情報です。最新の研究内容については研究室サイト![]() をご覧ください。
をご覧ください。
※ 2025年5月1日:一部最新の情報に更新しました。