生命理工学系 News
壊れたDNAを安全に修復するための第一歩を解明
ペプチドを利用しDNA修復系を意のままに操る可能性
要点
- 切断されたDNA鎖を正確に修復するためには相同組換えが必要
- 相同組換え誘導はヌクレアーゼ活性化による一本鎖DNAの形成が必須
- 相同組換えを誘導するヌクレアーゼの活性化条件を分子レベルで解明
- たった15アミノ酸からなるペプチドがヌクレアーゼ活性化能を持つ
概要
東京工業大学 科学技術創成研究院 細胞制御工学研究センターのAleksandar Zdravković(アレクサンダー・ゾドラヴコヴィチ)研究員、坪内英生助教(生命理工学コース主担当)、岩崎博史教授(生命理工学コース主担当)のグループはテキサス大学ヘルスサイエンスセンターのPatrick Sung(パトリック・サン)教授のグループと共同で、切断されたDNA鎖が正確に修復されるように誘導するための分子機構を明らかにした。
DNA鎖が切断された場合、遺伝情報[用語1]を正確に復元するためには相同組換え[用語2]が必須である。その際、切断されたDNA末端の二本鎖のうちの一方を削り込むことで、一本鎖DNAを末端に露出させ、そこに相同組換えタンパク質を結合させる必要がある。この一本鎖DNAの形成に重要な役割を果たすのがMre11-Rad50-Nbs1(MRN)よりなるDNAヌクレアーゼ[用語3]だが、この複合体が機能するにはCtp1という制御タンパクにより活性化される必要がある。
研究グループは試験管内の再構成[用語4]によりCtp1のリン酸化がMRNとCtp1の会合を促すこと、活性化にはCtp1のC末端が必須であることを明らかにした。しかもこの活性化にはCtp1末端を構成するたった15アミノ酸からなるペプチドで十分であった。この知見を応用することで、ペプチドを介して相同組換えの活性化や阻害を細胞レベルで制御できる可能性がある。
研究成果は3月8日付(現地時間)の「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」電子版に掲載された。
背景
DNA鎖が放射線などで損傷を受けた場合、破壊された遺伝情報を正確に復元するには、相同な配列を持つDNAを見つけ出しその領域をコピーする、いわゆる相同組換えを用いた修復が唯一の手段である(図1)。一方で、生物は切断されたDNAの二重鎖を取り敢えず繋(つな)げて修復する、いわゆる末端結合修復機構も併せ持っている。末端結合は二重鎖切断[用語5]によるDNA損傷を手っ取り早く塞(ふさ)ぐことができる一方で、修復に伴う遺伝情報の喪失が不可避である。
二重鎖切断末端に対してエキソヌクレアーゼ[用語6]の働きで3'末端を持つ一本鎖DNAが形成されると、その部分に対して相同組換えタンパク質であるRecAファミリーに属するタンパク質(RecAホモログ[用語7])が螺旋状に結合する(図2)。RecAホモログは結合した一本鎖DNAと相同な配列を持つ二本鎖DNAを探し出し、相同なDNA分子間でDNA鎖交換反応を行う活性を持つ。その結果、二重鎖切断の正確な修復が可能となる。
このように、二重鎖切断末端が削り込まれることで相同組換え修復経路への誘導がおこることから、その反応を担うエキソヌクレアーゼの活性化は相同組換えを誘導する際に決定的なスイッチの役割を果たすと考えられる(図2)。
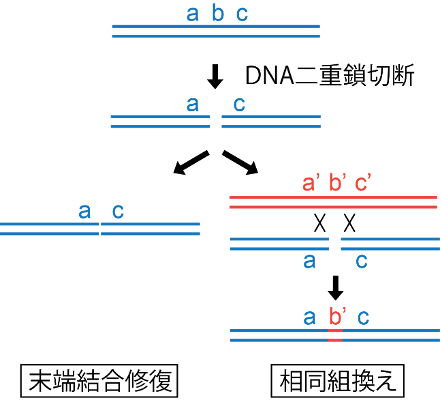
図1. DNA二重鎖切断修復。遺伝情報a、b、cを持つ領域に二重鎖切断が入り遺伝情報bが失われた場合、末端結合修復ではbが失われるが、相同組換えでは相同配列を元に修復するため、a、b、cとよく似たa'、b'、c'を参照した結果b'として復元される。
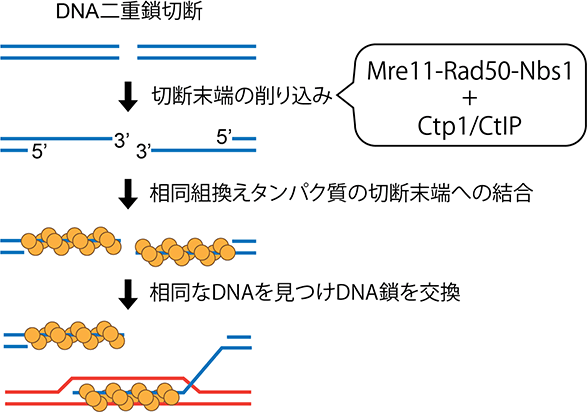
図2. DNA二重鎖切断末端の削り込みが相同組換えを誘導する。Mre11-Rad50-Nbs1はCtp1により活性化され二重鎖切断末端を削り込むため、二重鎖切断が相同組換えで修復されるようになる。
研究成果
分裂酵母をモデルに、相同組換えの開始制御の分子機構を生化学的に解析した。DNA二重鎖切断末端の削り込みに関与するDNAヌクレアーゼ複合体であるMre11-Rad50-Nbs1(MRN)、及びその活性化因子であるCtp1を大腸菌で発現・精製し、二重鎖切断末端に対して起こる一本鎖形成反応を試験管内で再構成した。その結果Ctp1がMRNを活性化する上で鍵となる2つの要因を分子レベルで特定した。
まず、Ctp1はMRNと相互作用することでヌクレアーゼの活性化を行うが、その相互作用はCtp1リン酸化に依存し、Ctp1のリン酸化はMRNの中でもNbs1との直接的相互作用を引き起こす事が分かった。また、Ctp1のどの部位がMRNの活性化に必要かを探索したところ、そのC末端が僅かにでも欠失するとMRNの活性化が起こらないことが判明した。MRNの活性化に必要十分な領域を絞り込んだところ、驚いたことにCtp1末端を構成するたった15アミノ酸からなるペプチドを反応系に十分量加えるだけでMRNの活性化が起こることが分かった。さらに、ヒト由来のMRNにヒトのCtp1ホモログであるCtIPのC末端由来のペプチドを加えることでもMRNの活性化が起こることを見出し、このメカニズムが生物種間を超えて保存されていることを確認した。
今後の展開
本研究によりMRNがCtp1により活性化される鍵となる要因が分子レベルで特定された一方で、このCtp1由来の小さなペプチドがどのようにMRNを活性化するのかは今後の課題である。また、ペプチドレベルの小分子が相同組換えを活性化しうることは興味深い。
DNA二重鎖切断は、正確だがコストのかかる相同組換え経路と不正確だが簡便な末端結合経路[用語8]の両方で修復される。ヒトでゲノム編集[用語9]が困難なのは、ヒトでは末端結合経路が主要な二重鎖切断修復系だからである。細胞をペプチドで処理することで相同組換えを人為的に活性化させ、正確なゲノム編集を促進できるかも知れない。相同組換えの異常は様々な遺伝性疾患の原因となることからペプチドで相同組換えを制御することが新たな疾患治療法の開拓に繋がる可能性もある。
- 用語説明
[用語1] 遺伝情報: 生命の遺伝情報はDNAの塩基配列として記述されている。よってDNAの塩基配列を一定に保つことが生命機能を正常に保つ上で重要である。
[用語2] 相同組換え : 2つのDNA分子が相同性を有する際、その部分で分子の乗り換え(すなわち組換え)が起こり新しい分子が生じる現象を相同組換えと呼ぶ。相同組換えはDNAに二重鎖切断を導入することで誘導される。
[用語3] DNAヌクレアーゼ : DNAは核酸の重合体であり、DNAを切断・分解する活性を持つタンパク質をDNAヌクレアーゼと呼ぶ。
[用語4] 試験管内の再構成 : 生体内で起こっている現象を精製した材料のみを使って試験管内で再現することで、その現象の詳細を分子レベルで理解するアプローチ。
[用語5] 二重鎖切断 : DNAは多くの場合、相補的なDNA鎖がより合わさった二重らせん構造をとる。電離放射線などはDNAを構成する2本のDNA鎖に対し同時に損傷を与える結果、二本鎖DNAが完全に分断される。このような切断を二重鎖切断と呼ぶ。
[用語6] エキソヌクレアーゼ : 切断されたDNA末端特異的にDNA鎖の分解を促進するDNAヌクレアーゼをエキソヌクレアーゼと呼ぶ。
[用語7] RecAホモログ : 大腸菌RecAタンパク質はDNAが二重鎖切断を受けた際その末端に形成される一本鎖DNAに螺旋状に結合し、その部分と相同性のある二本鎖DNA分子を見つけ出し、一本鎖DNAを二本鎖DNAに潜り込ませる活性(DNA鎖交換活性)を有する。多くの真核生物は二種類のRecAファミリータンパク質であるRad51とDmc1を持ち、これらはRecAホモログと称される。
[用語8] 末端結合経路 : DNA二重鎖切断修復における主要経路の一つであり、二重鎖切断を受けたDNAの末端同士を結合させる経路である。相同配列を参照して修復する相同組換えとは対象的に、末端結合による修復は遺伝情報の喪失を伴うことが多い。
[用語9] ゲノム編集: 生命の遺伝情報の総体であるゲノムに意のままに変更を加えることを可能にする技術。
- 論文情報
| 掲載誌 : | Proceedings of the National Academy of Sciences of United States of America(米国科学アカデミー紀要) |
|---|---|
| 論文タイトル : | A Conserved Ctp1/CtIP C-Terminal Peptide Stimulates Mre11 Endonuclease Activity |
| 著者 : | Aleksandar Zdravković, James M. Daley, Arijit Dutta, Tatsuya Niwa, Yasuto Murayama, Shuji Kanamaru, Kentaro Ito, Takahisa Maki, Bilge Argunhan, Masayuki Takahashi1, Hideo Tsubouchi*, Patrick Sung*, Hiroshi Iwasaki* (*co-corresponding authors) |
| DOI : |
10.1073/pnas.2016287118
|
- 相同なDNA配列間でRad51リコンビナーゼによるDNA鎖を交換するしくみを解明|生命理工学系 News
- 相同組換えを活性化するメカニズムを解明|生命理工学系 News
- 「がん遺伝子」として働くのか?組換え酵素Rad52が染色体異常を引き起こすことを発見|生命理工学系 News
- 相同組換えのDNA鎖交換反応開始の分子機構を解明|生命理工学系 News
- 分裂酵母の性(接合型)変換を制御する新たな遺伝子を発見|生命理工学系 News
- 相同組換えのDNA鎖交換の素過程を世界で初めて解明|生命理工学系 News
- 遺伝子撹拌装置をタイミング良く染色体から取り外す仕組み|生命理工学系 News
- 葉緑体増殖の基礎的しくみを解明―葉緑体分裂・増殖時にDNA分配を制御する酵素の発見―|生命理工学系 News
- DNA相同組換えの複雑な制御機構を解明 ―分裂酵母DNAヘリカーゼFbh1が多様な働き―│東工大ニュース
- 岩崎研究室 ―研究室紹介―|生命理工学系 News
- 岩崎研究室
- 研究者詳細情報(STAR Search) - ゾドラヴコヴィチ アレクサンダー Aleksandar Zdravkovic
- 研究者詳細情報(STAR Search) - 坪内英生 Hideo Tsubouchi
- 研究者詳細情報(STAR Search) - 岩﨑博史 Hiroshi Iwasaki
- 科学技術創成研究院 細胞制御工学研究センター
- 科学技術創成研究院(IIR)
- 生命理工学院 生命理工学系
- The Graduate School of Biomedical Sciences at UT Health San Antonio
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
助教 坪内英生
E-mail : htsubouchi@bio.titech.ac.jp
Tel : 045-924-5149
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
教授 岩崎博史
E-mail : hiwasaki@bio.titech.ac.jp
Tel : 045-924-5168