生命理工学系 News
分裂酵母の性(接合型)変換を制御する新たな遺伝子を発見
接合型変換制御にユークロマチンも関与か
要点
- 接合型の変換は、DNA複製時に染色体構造と共役したDNA組換え反応で起こる
- 接合型変換機構について蛍光顕微鏡を用いて網羅的解析する手法を開発
- 組換え修復異常で起こる疾患の発症機構解明や治療法の開発に役立つ可能性
概要
東京工業大学 科学技術創成研究院の真木孝尚特任助教、岩崎博史教授(生命理工学コース主担当)、生命理工学院の小倉尚人大学院生(修士課程2年)、デンマーク・コペンハーゲン大学のジェネヴィーブ・トーン(Genevieve Thon)博士、米国・ブランダイス大学のジェームズ・E・ヘイバー(James E. Haber)博士の国際研究グループは、分裂酵母の接合型変換機構の新たな制御遺伝子を発見した。
酵母の性に相当する接合型(分裂酵母の場合はP型とM型がある)は、細胞分裂に伴い規則的に変換される。これはP型決定遺伝子とM型決定遺伝子の発現が相互に組み換わることで起こるが、その詳細はこれまで不明だった。
本研究では、真木特任助教らがトーン博士と共同で、蛍光顕微鏡を用いた新たな解析手法を開発し、接合型変換に関わる遺伝子の網羅的解析を行った。その結果、10個の新規接合型変換制御遺伝子を同定した。さらに、同定した遺伝子の遺伝学的解析や相互作用ネットワーク解析から、新たに染色体構造の制御様式が接合型変換に関わることを明らかにした。
この制御様式は、酵母に限らずヒトにも保存されており、エピジェネティクスと深く関わることから、多くの疾病と関連していることが予想される。今回の発見は、関連する疾病の発症機構解明や治療法の開発などに役立つと期待される。
本成果は2018年5月31日付の「PLoS Genetics」に掲載された。
研究の背景
分裂酵母は2つの接合型(PとM)が存在し、細胞分裂に伴いP型からM型、もしくはM型からP型の変換が起こる。接合型は、2番染色体上に存在するmating-type(mat)領域のmat1遺伝子座の遺伝情報によって決定される。すなわち、mat1がPの遺伝情報を有し、それを発現するとき(mat1-P)にはP接合型となり、mat1がMの遺伝情報を有し、それを発現するとき(mat1-M)にはM接合型となる。mat1領域の近傍には、P型遺伝情報をコードするmat2-P遺伝子座と、M型の遺伝子情報をコードするmat3-M遺伝子座が存在するが、この2つの領域はヘテロクロマチン[用語1]化されており遺伝子発現が抑制されている。すなわち、接合型決定遺伝子の発現はmat1でのみ起こる。接合型変換が起こるしくみの根幹は、遺伝子発現が可能なmat1領域に、mat2-Pまたはmat3-Mの情報を写し取るという遺伝子変換[用語2]と言える(図1)。
接合型変換反応は、DNA複製時にmat1近傍に生じるDNA二重鎖切断によって開始され、このDNA二重鎖切断が、mat2-Pまたはmat3-Mの相同配列を利用した相同組換え依存的な修復機構によって治される際に、mat1遺伝子上にmat2-Pまたはmat3-Mの遺伝情報が転移する(遺伝子変換が起こる)ものだ。興味深いことに、mat1がP情報を発現しているときにはmat3-M遺伝情報で、mat1がM情報を発現しているときにはmat2-P遺伝情報で修復され、この制御が厳密に制御されることにより正確な接合型変換が達成される。この制御では、ヘテロクロマチン構造が重要な役割を果たしている。しかしながら、その詳しい反応様式はこれまで不明だった。
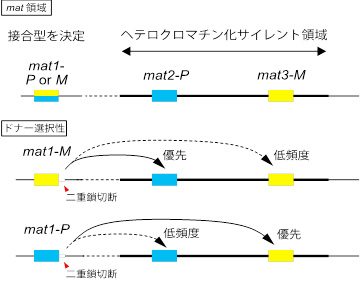
図1. mat領域の模式図と接合型変換時のドナー選択様式:
mat1の二重鎖切断はmat2-Pまたはmat3-Mを用いて修復される。この時mat1とは異なる遺伝子座を用いることで接合型が変換される。
研究の経緯と成果
本研究グループでは、この接合型変換機構の全体像を捉えるべく、接合型変換因子の網羅的解析を行った。
これまでの接合型変換能を解析する手法は、複雑なステップを必要としたり、判定に熟練を要したりするなど、様々な問題があった。そこで今回、P細胞とM細胞それぞれが特異的な蛍光を発するように遺伝学的な細工をして、蛍光顕微鏡を用いることで、P細胞とM細胞を1細胞ずつ直接観察して判定するという新たな解析手法を開発した。この手法で、分裂酵母の全ての非必須遺伝子に対して欠損株を作成し、変異株の細胞集団中のP細胞とM細胞の割合を計測し、等分から大きく離れているものを接合型変異体として、その原因遺伝子(欠損遺伝子)を接合型変換関連遺伝子とした。そして、既存の解析方法と組み合わせて、接合型変換関連遺伝子を絞り込み、最終的に10の新規因子を含む26遺伝子を同定した。
得られた因子は、複製、ヘテロクロマチン制御、DNA組換えの大きく3つのカテゴリーに分類できる。ヘテロクロマチン形成関連因子をより詳細に解析していくと、Set1/compass複合体(Set1C)の関与が明らかになった。このSet1Cは、ユークロマチン化かつ抗ヘテロクロマチン化因子として知られている。
今回の研究から、mat領域ではSet1Cがヘテロクロマチン形成を直接制御していることが新たに示唆された(図2)。この発見は、クロマチン構造の制御による、新たな遺伝子機能発現制御機構の片鱗を捉えたもので、今後さらなる研究の深化が期待できる。
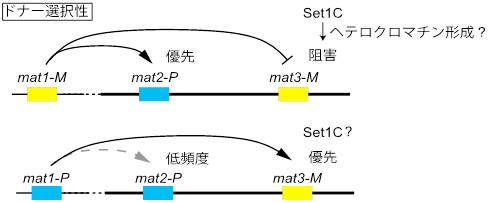
図2. Set1Cによるドナー選択制御モデル
M細胞ではmat3-Mの選択がSet1Cにより阻害され、mat2-Pとの遺伝子変換が優先される。P細胞ではSet1Cはmat3-Mにおけるドナー選択性を阻害せず、mat3-Mとの遺伝子変換が優先して起こる。すなわち、Set1CがM細胞特異的にmat3-Mとの遺伝子変換を阻害している。この分子機構の詳細は不明であるが、Set1CがM細胞特異的にmat3-M遺伝子座近傍のヘテロクロマチンの構造変化を引き起こしていることが予想される。
今後の展開
接合型変換機構は、プログラムされた部位特異的な相同組換え機構である。この制御に、ヘテロクロマチンが関与することは古くから知られていたが、本研究はこのヘテロクロマチンの制御にユークロマチンの制御因子が関わることを世界で初めて示したユニークな成果だ。今後は、同定された因子がどのようにヘテロクロマチンを制御しているのかを詳細に解析し、染色体構造と組換え制御の詳細な関係を解明することが課題となる。これらの研究を通して、組換え修復異常やエピジェネティクス異常を起因とする多くの遺伝疾患の分子病態が明らかにされていくことが期待される。
なお、本研究のヘイバー博士は、東京工業大学のWRHI※プロジェクトによって招聘された。
※WRHI(ワールド・リサーチ・ハブ・イニシアティブ):海外から世界トップレベルの研究者を招聘(または雇用)し、国際共同研究を推進する6年間のプロジェクト。
用語説明
[用語1] ヘテロクロマチン : 染色体の中で非常に凝集している構造。そのため、転写や相同組換え反応が抑制されている。その一方、弛緩した構造はユークロマチンと呼ばれ、転写や組換え反応が活性化している。
[用語2] 遺伝子変換 : 2組のDNAの似た配列でおこる、DNA鎖の交換反応で、相同組換え反応の一つである。相同組換え反応は、遺伝的多様性を生み出すことや損傷DNAの修復に貢献する。
論文情報
| 掲載誌 : | PLoS Genetics 14(5): e1007424 |
|---|---|
| 論文タイトル : | New insights into donor directionality of mating-type switching in Schizosaccharomyces pombe |
| 著者 : | 真木孝尚、小倉尚人、James E. Haber、岩崎博史※、Genevieve Thon※
※Cocoresponding authors |
| DOI : |
- 姉妹染色分体間接着の形成機構を解明│生命理工学系ニュース
- 相同組換えのDNA鎖交換の素過程を世界で初めて解明│生命理工学系ニュース
- 遺伝子撹拌装置をタイミング良く染色体から取り外す仕組み│生命理工学系ニュース
- 葉緑体増殖の基礎的しくみを解明―葉緑体分裂・増殖時にDNA分配を制御する酵素の発見―│生命理工学系ニュース
- 岩崎研究室 ―研究室紹介 #11―│生命理工学系ニュース
- 岩崎研究室
- 研究者詳細情報(STAR Search) - 真木孝尚 Takahisa Maki
- 研究者詳細情報(STAR Search) - 岩﨑博史 Hiroshi Iwasaki
- 科学技術創成研究院(IIR)
- 科学技術創成研究院 細胞制御工学研究センター
- WRHI - Tokyo Tech World Research Hub Initiative
- コペンハーゲン大学
- ブランダイス大学
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院
細胞制御工学研究センター
岩崎博史 教授
E-mail : hiwasaki@bio.titech.ac.jp
Tel : 03-5734-2588 / Fax : 03-5734-3781