生命理工学系 News
【研究室紹介】 越川研究室

主担当 人間医療科学技術コース
副担当 生命理工学コース/ライフエンジニアリングコース
教授 越川直彦![]()
| キーワード | 細胞外マトリックス、メタロプロテアーゼ、がん、バイオマーカー |
|---|---|
| Webサイト | 健康医療科学研究室 |
研究紹介
私たちは、2020年6月に東京工業大学生命理工学院の新たな研究室として始動しました。本研究室は、研究領域にとらわれない多角的な解析手法を用いて、がん細胞の悪性形質獲得の分子機序を正確に理解し、基礎研究からトランスレーショナルリサーチに発展させることで、これまでにないがん治療法・診断法の開発を目指しております。
近年、外科手術、放射線療法、薬物療法、免疫療法の進歩により、がん患者の生存率は上昇傾向にあります。しかし、残念ながら、一部の難治がんは早期に転移を起こすため、5年相対生存率は30%に満たないのが実情です。このような難治がんの治療成績を向上させるためには、まず、遠隔転移を制する(理解する)必要があります。
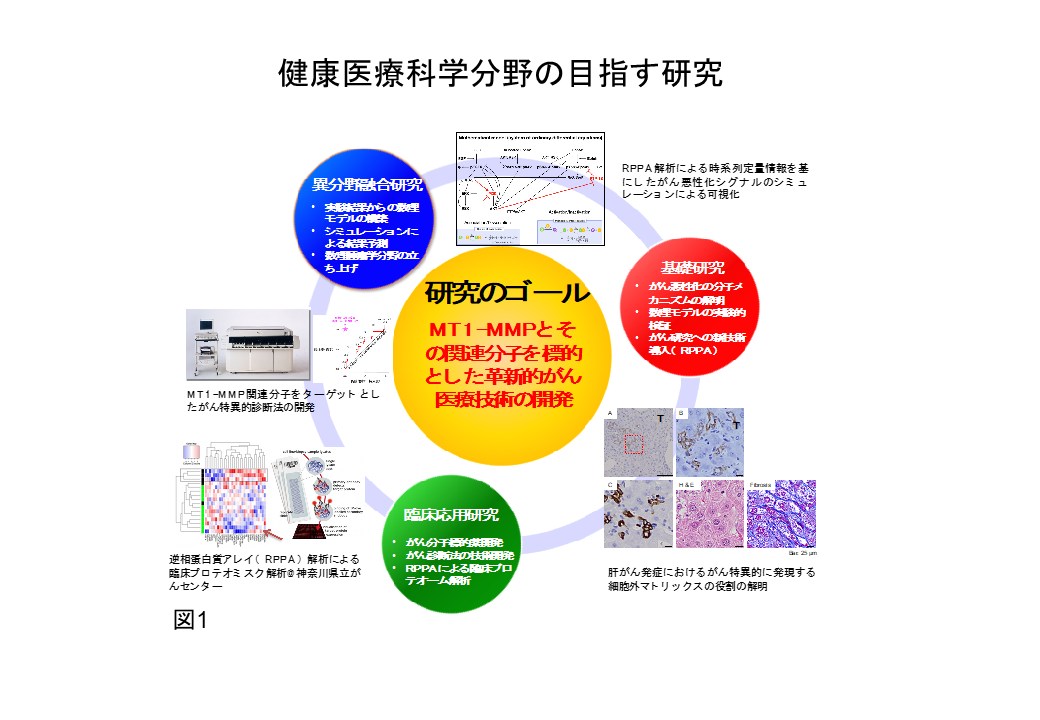
私たちは、先駆的な異分野技術を用いて、これまで一貫して、膜型マトリックス・メタロプロテアーゼ1(MT1-MMP)とその基質に一貫して着目し、MT1-MMP基質蛋白の分解による多様ながんの悪性形質の制御メカニズムを理解することで、MT1-MMPとその関連分子を標的とした革新的がん医療技術の開発を目指しています(図1)。
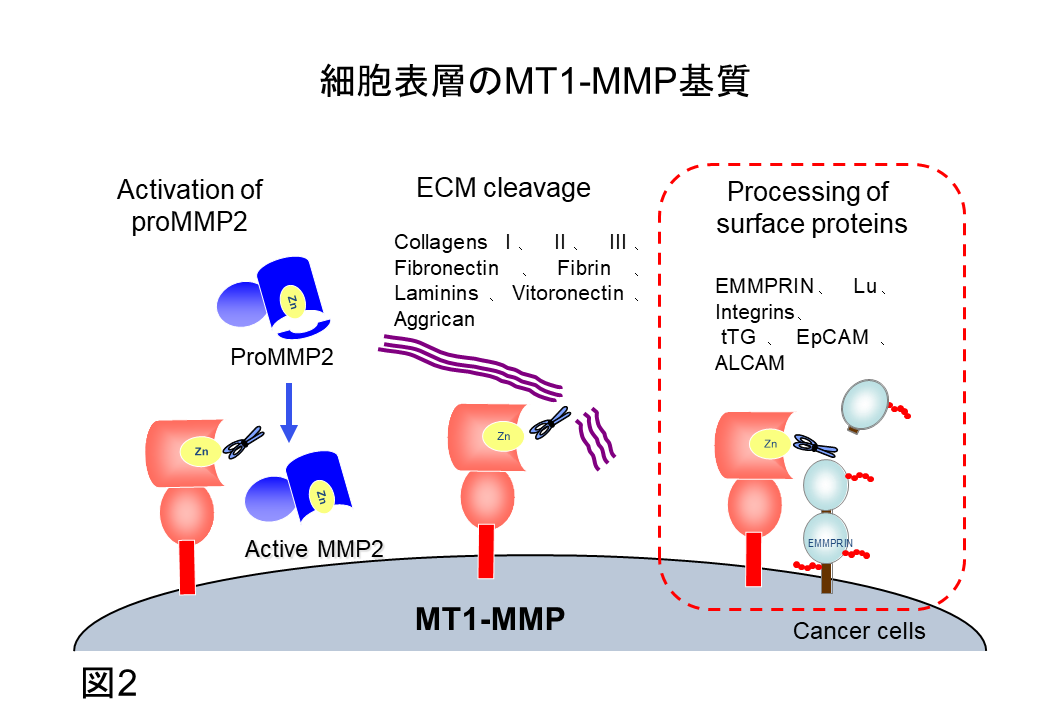
MT1-MMPは1994年に金沢大学の佐藤、清木らによって発見されました。当初、MT1-MMPは浸潤性がんに高頻度に発現し、基底膜破壊に重要なMMP2前駆体の活性化やがん細胞周辺のコラーゲンをはじめとする間質組織構造を破壊することで、MT1-MMPはがん転移・浸潤の動力源として重要とされてきました(図2左、中央)。
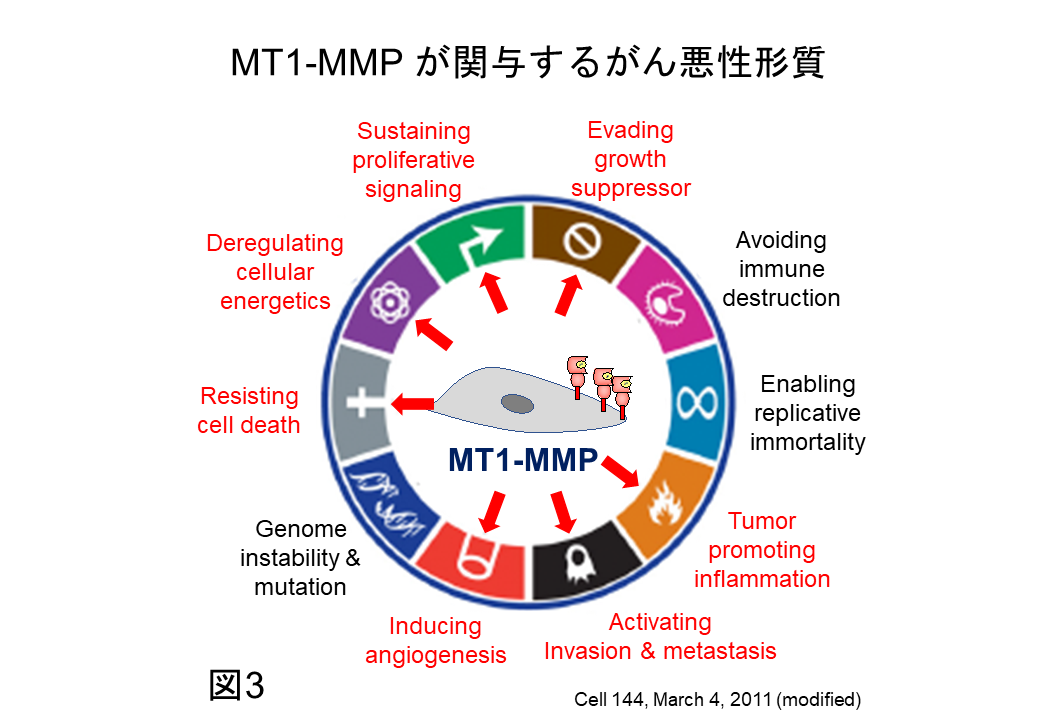
さらに近年、MT1-MMPはがん転移・浸潤だけでなく、がんの多様な悪性形質の獲得に関与することが報告されています(図3)。そのため、MT1-MMPによるがん悪性化進展制御の分子メカニズムを理解することは、新たながん治療法・診断法、創薬を開発することに繋がります。
そこで、私たちは、第3のMT1-MMP基質に着目し、MT1-MMPによるそれら基質の部分切断(プロセシング)が膜蛋白質の新たな機能制御に関与する可能性を系統的に検討しています(図2右)。
これまでに、がん細胞の膜上において、MT1-MMPが、以下の特性を持つことが見出されています(Cancer Sci 2011, Cell Death & Diseases 2017)。
- 1)がん細胞の悪性化に重要な役割を担う膜型細胞増殖因子やチロシンキナーゼ受容体と相互作用すること(Cancer Sci, 2008)
- 2)これら膜蛋白質をプロセシンし、その活性を制御することで(Cancer Res 2010, 2015)、がん悪性形質を亢進すること
- 3)MT1-MMPのプロセシングで生じる基質遊離断片は、がん細胞を生体内で検出するための目印(バイオマーカー)となること
以上より、がん浸潤・転移の動力源として見出されたMT1-MMPは、細胞膜上で様々な膜蛋白質と相互作用することで、がんの多様な悪性形質の獲得に寄与すること、MT1-MMPのプロセシングを受けた膜蛋白質が新たな細胞機能を獲得し、がん治療や診断の新たな標的となることを強く示唆しています。現在、これまでの基礎研究の知見を元にしたトランスレーショナルリサーチを進め、MT1-MMPとその関連分子を標的としたシーズの臨床有用性(Proof of Concept:POC)を得ることで、独創的ながん治療・診断法を社会に向けて発信してゆきます。
研究成果
- 1.Nagano M, Hoshino D, Toshima J, Seiki M, Koshikawa N. NH2-terminal fragment of ZF21 protein suppresses tumor invasion via inhibiting the interaction of ZF21 with FAK: Cancer Science, in press.
- 2.Suzuki M, Muroi A, Nojima M, Numata A, Takasaki H, Sakai R, Yokose T, Miyagi Y, Koshikawa N. Utility of a Reverse Phase Protein Array to Evaluate Multiple Biomarkers in Diffuse Large B-Cell Lymphoma: Proteomics Clin Appl. 2020 Jan;14(1):e1900091. doi: 10.1002/prca.201900091.
- 3.Yasuda H, Nakagawa M, Kiyokawa H, Yoshida E, Yoshimura T, Koshikawa N, Itoh F, Seiki M. Unique Biological Activity and Potential Role of Monomeric Laminin-γ2 as a Novel Biomarker for Hepatocellular Carcinoma: A Review. Int J Mol Sci. 2019 Jan 8;20(1):226. doi: 10.3390/ijms20010226.
- 4.Takahashi Y, Hamasaki M, Aoki M, Koga K, Koshikawa N, Miyamoto S, Nabeshima K. Activated EphA2 Processing by MT1-MMP Is Involved in Malignant Transformation of Ovarian Tumours In Vivo. Anticancer Res. 2018 Jul;38(7):4257-4266. doi: 10.21873/anticanres.
- 5.Kikuchi K, Kozuka-Hata H, Oyama M, Seiki M, Koshikawa N. Identification of Proteolytic Cleavage Sites of EphA2 by Membrane Type 1 Matrix Metalloproteinase on the Surface of Cancer Cells. Methods Mol Biol. 2018;1731:29-37. doi:10.1007/978-1-4939-7595-2_3.
- 6.Koshikawa N, Minegishi T, Kiyokawa H, Seiki M. Specific detection of soluble EphA2 fragments in blood as a new biomarker for pancreatic cancer. Cell Death Dis. 2017 Oct 26;8(10):e3134. doi: 10.1038/cddis.2017.545.
- 7.Nakagawa M, Karashima T, Kamada M, Yoshida E, Yoshimura T, Nojima M, Inoue K, Shuin T, Seiki M, Koshikawa N. Development of a fully automated chemiluminescence immunoassay for urine monomeric laminin-γ2 as a promising diagnostic tool of non-muscle invasive bladder cancer. Biomarker Res. 2017 Oct 13;5:29. doi: 10.1186/s40364-017-0109-4.
- 8.Suzuki T, Minerva D, Nishiyama K, Koshikawa N Chaplain MAJ. Study on the tumor-induced angiogenesis using mathematical models. Cancer Sci. 2018 Jan;109(1):15-23. doi: 10.1111/cas.13395.
- 9.Kiyokawa H, Yasuda H, Oikawa R, Okuse C, Matsumoto N, Ikeda H, Watanabe T, Yamamoto H, Itoh F, Otsubo T, Yoshimura T, Yoshida E, Nakagawa M, Koshikawa N, Seiki M. Serum monomeric laminin-γ2 as a novel biomarker for hepatocellular carcinoma. Cancer Sci. 2017 Jul;108(7):1432-1439. doi: 10.1111/cas.13261.
- 10.Tatsukawa R, Koga K, Aoki M, Koshikawa N, Imafuku S, Nakayama J, Nabeshima K. Immunohistochemical demonstration of EphA2 processing by MT1-MMP in invasive cutaneous squamous cell carcinoma. Virchows Arch. 2016 Jul;469(1):25-34. doi: 10.1007/s00428-016-1934-9.
- 11.Kamada M, Koshikawa N, Minegishi T, Kawada C, Karashima T, Shuin T, Seiki M. Urinary laminin-γ2 is a novel biomarker of non-muscle invasive urothelial carcinoma. Cancer Sci. 2015 Dec;106(12):1730-7. doi: 10.1111/cas.12832.
- 12.Koshikawa N, Hoshino D, Taniguchi H, Minegishi T, Tomari T, Nam SO, Aoki M, Sueta T, Nakagawa T, Miyamoto S, Nabeshima K, Weaver AM, Seiki M. Proteolysis of EphA2 Converts It from a Tumor Suppressor to an Oncoprotein. Cancer Res. 2015 Aug 15;75(16):3327-39. doi: 10.1158/0008-5472.CAN-14-2798.
- 13.Kikuchi K, Noguchi A, Kasajima R, Miyagi Y, Hoshino D, Koshikawa N, Kubota A, Yokose T, Takano Y. Association of SIRT1 and tumor suppressor gene TAp63 expression in head and neck squamous cell carcinoma. Tumour Biol. 2015 Sep;36(10):7865-72. doi: 10.1007/s13277-015-3515-y.
- 14.Ito-Kureha T, Koshikawa N, Yamamoto M, Semba K, Yamaguchi N, Yamamoto T, Seiki M, Inoue J. Tropomodulin 1 expression driven by NF-κB enhances breast cancer growth. Cancer Res. 2015 Jan 1;75(1):62-72. doi: 10.1158/0008-5472.
- 15.Koshikawa N, Mizushima H, Minegishi T, Eguchi F, Yotsumoto F, Nabeshima K, Miyamoto S, Mekada E, Seiki M. Proteolytic activation of heparin-binding EGF-like growth factor by membrane-type matrix metalloproteinase-1 in ovarian carcinoma cells. Cancer Sci. 2011 Jan;102(1):111-6. doi:10.1111/j.1349-7006.
- 16.Koshikawa N, Mizushima H, Minegishi T, Iwamoto R, Mekada E, Seiki M. Membrane type 1-matrix metalloproteinase cleaves off the NH2-terminal portion of heparin-binding epidermal growth factor and converts it into a heparin-independent growth factor. Cancer Res. 2010 Jul 15;70(14):6093-103. doi:10.1158/0008-5472.CAN-10-0346.
- 17.Niiya D, Egawa N, Sakamoto T, Kikkawa Y, Shinkawa T, Isobe T, Koshikawa N, Seiki M. Identification and characterization of Lutheran blood group glycoprotein as a new substrate of membrane-type 1 matrix metalloproteinase 1 (MT1-MMP): a systemic whole cell analysis of MT1-MMP-associating proteins in A431 cells. J Biol Chem. 2009 Oct 2;284(40):27360-9. doi:10.1074/jbc.M109.029124.
- 18.Tomari T, Koshikawa N Uematsu T, Shinkawa T, Hoshino D, Egawa N, Isobe T,Seiki M. High throughput analysis of proteins associating with a proinvasive MT1-MMP in human malignant melanoma A375 cells. Cancer Sci. 2009 Jul;100(7):1284-90. doi: 10.1111/j.1349-7006.2009.01173.x.
- 19.Koshikawa N, Minegishi T, Nabeshima K, Seiki M. Development of a new tracking tool for the human monomeric laminin-gamma 2 chain in vitro and in vivo. Cancer Res. 2008 Jan 15;68(2):530-6. doi: 10.1158/0008-5472.CAN-07-5269.
- 20.Koshikawa N, Giannelli G, Cirulli V, Miyazaki K, Quaranta V. Role of cell surface metalloprotease MT1-MMP in epithelial cell migration over laminin-5. J Cell Biol. 2000 Feb 7;148(3):615-24. doi: 10.1083/jcb.148.3.615.
- 21.Koshikawa N, Moriyama K, Takamura H, Mizushima H, Nagashima Y, Yanoma S, Miyazaki K. Overexpression of laminin gamma2 chain monomer in invading gastric carcinoma cells. Cancer Res. 1999 Nov 1;59(21):5596-601. PMID: 10554040.
(日本語総説)
- 1.室井 敦、星野大輔、清木元治、越川直彦、MT1-MMPのプロテアーゼ活性を通じたがん悪性化進展制御(膜タンパク質工学ハンドブック)、2020.
- 2.星野大輔、室井 敦、清木元治、越川直彦、がんの悪性化:浸潤と転移、細胞運動と浸潤、がん生物学 イラストレイテッド、P242-261(羊土社)、2019.
- 3.越川直彦、細胞外基質を指標とした膀胱がんの新しい診断法の開発、日薬理誌、146、248-251, 2015.
- 4.越川直彦、清木元治、膜型マトリックスメタロプロテアーゼの新しい側面と腫瘍マーカー,カレントテラピー、29、45-50, 2011.
- 5.越川直彦:改訂版4版 蛋白質の実験ノート上巻、無敵のバイオテクニカルシリーズ(羊土社)、125-133, 2011.
- 6.越川直彦:がん細胞膜上の微小環境-悪性化制御因子としての膜型マトリックスメタロプロテアーゼ1-、Medical Bio, 52, 4-29, 2011.
- 7.越川直彦、清木元治:血管新生とマトリックスメタロプロテアーゼ、実験医学(増刊)、20, 1153-1160, 2002
- 8.越川直彦、清木元治:マトリックスメタロプロテアーゼと癌転移、Molecular Med. 39, 32-38, 2002.
- 9.越川直彦、宮田 智、宮崎 香:続がんの浸潤・転移研究マニュアル、-実験の手技と指針-(金芳堂)168-172 1997.
教員紹介
大学院時代から一貫して細胞外プロテアーゼとその基質である細胞外マトリックスとがん悪性化についての研究を継続しています。これまでに、腫瘍特異的に発現するラミニンγ2単鎖を見出し、その悪性化進展の分子機構を明らかとし、がん浸潤・転移の分子機構の解明の基礎研究を行っていました。2001年に米国留学から戻り、東京大学医科学研究所の清木元治教授(元所長)の研究室のスタッフに加えて頂き、そこで基礎研究の成果を医療に応用するトランスレーショナルリサーチの重要性を学び、それ以後、基礎と臨床応用を両輪とした研究を進めています。7年前、前任地である神奈川県立がんセンター臨床研究所に研究室を構え、がん医療を間近で見ながら行った研究は大変に貴重な経験となりました。東京工業大学・生命理工学院では、次代のがん医療を拓くことができる若い人材の育成と細胞外プロテオリシスによるがん悪性化進展制御の分子機序を基にした新たながん医療技術の開発を進めてゆきたいと思います。
- 学歴
| 1990年 | 横浜市立大学 文理学部 生物学科 卒業 |
|---|---|
| 1995年 | 横浜市立大学大学院 総合理学研究科 博士課程 修了 博士(理学)取得 |
- 職歴
| 1995年-1998年 | 日本学術振興会特別研究員(PD) 横浜市立大学木原生物学研究所 |
|---|---|
| 1997年-2001年 | スクリプス研究所 細胞生物学部 リサーチアソシエート |
| 2001年-2003年 | スクリプス研究所 細胞生物学部 客員助教授 |
| 2001年-2014年 | 東京大学医科学研究所 腫瘍細胞社会学分野 助手、助教、講師、准教授 |
| 2008年-2014年 | 東京大学大学院 新領域創成科学研究科 兼担講師、兼担准教授 |
| 2014年-2019年 | 高知大学医学部泌尿器科学教室 客員教授 |
| 2014年-2020年 | 神奈川県立がんセンター臨床研究所 がん生物学部 部長 |
| 2014年- | 東京大学医科学研究所 人癌病因遺伝子分野 客員教授 |
| 2020年- | 現職 |
- 受賞・助成金
| 2000年 | 日本がん転移学会 研究奨励賞 受賞 |
|---|---|
| 2005年 | 日本癌学会 研究奨励賞 受賞 |
| 2019年 | 高松宮妃癌研究基金・研究助成金 |
- 所属学会
日本癌学会(評議員)
日本がん転移学会(評議員、理事、会長)
日本がん分子標的治療学会
日本生化学会
米国癌学会
米国マトリックス生物学会
学生へのメッセージ
- 越川教授より
2020年6月から立ち上がった新しい研究室です。
細胞外マトリックス(ECM)および、その分解に重要なマトリックメタロプロテアーゼ(MMP)によるがん悪性化進展制御の分子機構の解明と、その研究成果の臨床応用を目指しています。また、国内で唯一稼働している逆相蛋白質アレイ装置を用いた臨床プロテオミクスによる新たながん治療診断の分子標的の探索なども行っています。
このような研究に興味を持ち、一緒に粘り強く頑張ってくれる学生の皆さん、是非、研究室で語り合いましょう。
※この内容は掲載日時点の情報です。最新の研究内容については研究室サイト![]() をご覧ください。
をご覧ください。
※ 2025年5月1日:一部最新の情報に更新しました。
※ 2026年1月6日:一部最新の情報に更新しました。