生命理工学系 News
【研究室紹介】 近藤研究室(~2023.3)
低酸素をキーワードに新たな技術とアイデアでがんを攻略する
生命理工学系にはライフサイエンスとテクノロジーに関連した様々な研究室があり、基礎科学と工学分野の研究のみならず、医学や薬学、農学等、幅広い分野で最先端の研究が活発に展開されています。
研究室紹介シリーズでは、ひとつの研究室にスポットを当てて研究テーマや研究成果を紹介。今回は、腫瘍内低酸素に着目して、新たな診断薬・治療薬の開発研究をする、近藤研究室です。
※近藤教授は2023年3月31日、東工大を定年退職しました。

ライフエンジニアリングコース
教授 近藤科江![]()
| キーワード | がんの生物学、タンパク質工学、光イメージング、創薬研究 |
|---|
研究紹介
私たちの体の中は、まだまだわからないことがたくさんあります。病気の予防も治療も、その理解が無くては始めることができません。直接治療するのは医学の分野です。しかし、最先端の医療は、工学の知識や技術が無くては成り立たなくなっています。例えば、体を傷つけずに体の中を見る診断機器や病気の場所を教えてくれる診断薬(プローブ)、得られた情報を処理して的確な診断に繋げる技術、遠隔で手術するロボット、手術中に切除する場所を的確に示してくれる光プローブなどです。人間の五感や技能を遥かに超えた高度な診断・治療が、豊かで安心な生活をもたらしてくれます。そのために、「医」と「工」の連携(医工連携)が推進されているのです。近藤研では、体の中の様々な仕組みを学び、イメージング技術やプローブ開発、タンパク質創薬の研究に医工連携を取り入れて、研究を進めています。
がんとは?
現在、日本では2人に1人ががんに罹り、3人に1人が死亡しています。がんは現代の医療技術でも完治することが非常に難しい疾患ですが、近藤研では、先進的なバイオテクノロジーを駆使して、革新的ながんの治療方法の開発を目指しています。がんは遺伝子に傷がつき、異常な増殖能を獲得することに始まります。がんの治療を難しくしている理由として、遺伝子が傷つく理由が多様で予防や根本的治療法が無いことや、がん化した細胞を構成する分子が正常細胞と基本的に同じであることが挙げられます。がん細胞を薬剤で攻撃しようとしても正常細胞にもダメージを与えてしまう"副作用"が深刻な問題になります。 これまでの研究から、がん細胞は非常に多様な遺伝的性質を獲得しており、正常細胞には影響を及ぼさず、かつ全てのがん細胞を攻撃する薬の開発は難しいことがわかってきました。そこで、我々は、腫瘍組織特有の環境、例えば、がん組織が正常組織に比べて酸素濃度が低くなる特徴や、がん組織に特徴的に集まってくるがん細胞以外の細胞が、幅広いがん種に共通してがんの悪性化に関わっていることに着目して研究を進めています。 具体的には、たんぱく質やペプチドをベースにした腫瘍環境特異的に作用する新しい治療薬の開発と共に、腫瘍内の環境をより深く理解するためのイメージング解析技術の開発などに取り組んでいます。
- 腫瘍微小環境を標的とした治療薬の開発
- ほとんどの固形腫瘍には、細胞増殖と血管新生の不均衡に起因する“低酸素環境”が存在しています(図1)。低酸素環境に適応したがん細胞は、放射線や多くの抗がん剤に抵抗性で、治療効果不良の主因であるばかりでなく、浸潤・転移・再発の温床となっており、難治性癌の悪性化の原因として注目されています。我々は、低酸素下で安定化し、細胞障害性を発揮する融合タンパク質製剤(TOP3、POP33)を開発し、低酸素がん細胞を標的治療可能であることを示してきました。現在、膵臓癌治療への臨床応用を目指して、他の抗がん剤との併用プロトコル(combination therapy)や製剤調整の最適化をおこなっています。
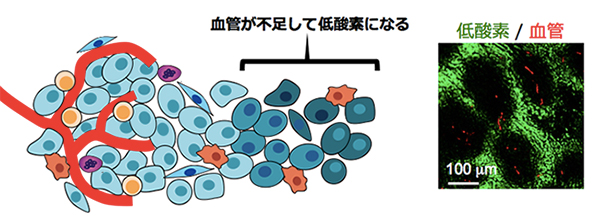
図1. 腫瘍内に形成される低酸素環境
- 抗体医薬に匹敵するペプチド医薬の開発
- 治療標的に結合する抗体を利用した医薬(抗体医薬)は従来の低分子薬剤と比べて副作用が少なく、低分子薬剤をしのぐ治療成績をあげるものもあり、薬剤として有望視されています。しかし、抗体は大量生産が難しいため製剤費が高額であり、そのため治療費が年間数百万円にも達するという問題があります。そこで我々は、安価に合成できるペプチドを抗体医薬の代替として利用するために、標的結合ペプチドの高性能化を進めています。これまでに、ゆらぎを抑制して構造を固定することで標的結合ペプチドの結合力を飛躍的に高める技術を開発し、抗体医薬分子から抗体代替ペプチドの理論的創出に成功しました。現在は、実際に医薬品として有望なゆらぎ抑制ペプチドの探索と生体内投与を指向した分子設計を行っています。
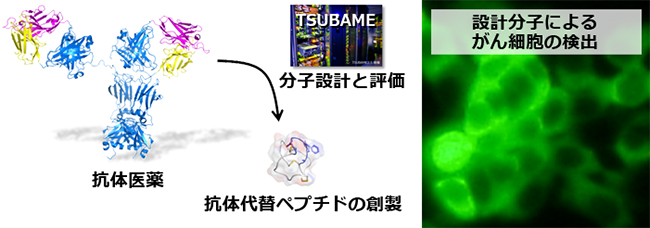
図2. 抗体代替ペプチドによるがん細胞の検出
- 次世代創薬に向けた治療標的探索・薬剤評価・DDS開発
- 薬剤耐性を獲得したがん細胞や休眠状態にあるがん細胞などは、現在の抗がん剤では治療効果があまり得られず、腫瘍の再発や転移の温床となることが明らかになってきています。このような悪性度の高いがん細胞を根治するためには、これまでとは異なるコンセプトに基づく創薬が必要です。そこで私たちは、腫瘍組織内に誘引されて悪性化を促進する免疫系細胞を新規に同定し、この細胞による悪性化メカニズムの全容解明と治療標的としての可能性を検討しています。また、現在抗がん剤が存在していない休眠がん細胞を治療標的とするために、休眠状態へと誘導したがん細胞を用いた薬剤スクリーニングを進めています。さらに、従来のドラッグデリバリーシステム(DDS)では送達が困難であった、内圧の高いがん組織や正常血管近くに存在するがん細胞への送達を実現するために、腫瘍血管に作用する機能性ペプチドCPP/PTDによる新たなDDSの構築を進めています。
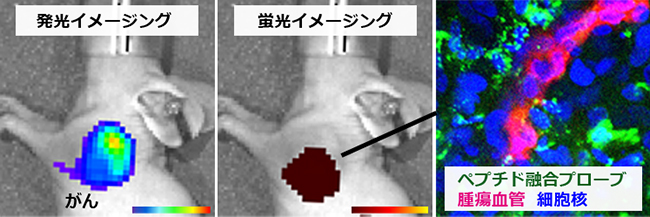
図3. CPP/PTDペプチドによるイメージングプローブの腫瘍集積
がん微小環境を可視化する光イメージングツールの開発
がん悪性化機構とがん微小環境要因の関わりをより深く理解することは、新たな治療法の考案に重要です。しかし、腫瘍組織内の微小環境は時事刻々と変化しており、従来の解析手法によって、微小環境による悪性化の制御機構を精度よく解析するのは困難でした。そこで、我々は、がん微小環境と悪性化機構の関わりを非侵襲的かつ高感度に可視化するイメージングシステムを開発し、がん悪性化機構について新たな知見を得ることを目指しています。現在は、ホタルの発光機構を利用した生物発光センサーや複数のルシフェラーゼを組みあわせることで、より高感度かつ多角的に腫瘍内微小環境の動的な変化を捉えることができる発光イメージングシステムの開発を進めています。
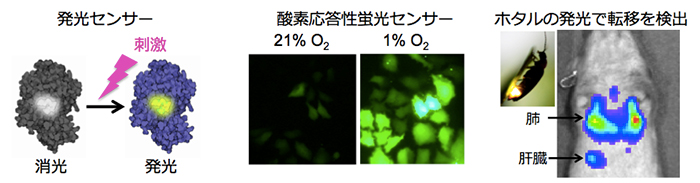
図4. がん微小環境を可視化する光イメージングツールの開発
がん転移を制御する新規分子機構の解明
がんによる死因のほとんどは転移によるものであるが、未だ効果的な治療法は開発されていません。がんの転移を決定的に制御する分子機構の理解は、将来のがんの撲滅に必須となります。がんの転移は、血中へのがん細胞の漏出に始まり、遠隔臓器への侵入、微小転移巣の形成など、非常に複雑で多段階の過程によって構成されており、そのメカニズムを理解するには、がん細胞自体の特性だけでなく、転移過程におけるがん細胞と間質組織との相互作用も明らかにしなければなりません(図5)。そこで、我々は、従来の生物学的な解析手法に加え、独自に開発した光イメージング手法、ユニークな転移モデルや遺伝子の大規模解析を組みあわせて、がんの転移を制御するメカニズムの解明を目指しています。特に、骨肉腫の肺転移や前立腺癌の骨転移を制御する新たなメカニズムの理解を目指して、遺伝子レベルから個体レベルまで、様々な手法を駆使して研究を進めています。
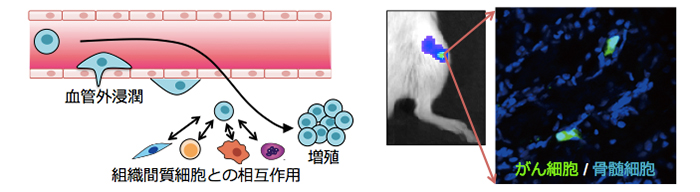
図5. がん転移過程におけるがん細胞と組織間質細胞の相互作用
研究成果
最近の論文
- [1] Kadonosono T, Yimchuen W, Tsubaki T, Shiozawa T, Suzuki Y, Kuchimaru T, Sato Y, Kizaka-Kondoh S. Domain architecture of vasohibins required for their chaperone-dependent unconventional extracellular release. Protein Sci, in press.
- [2] Kuchimaru T, Suka T, Hirota K, Kadonosono T, Kizaka-Kondoh S. A novel injectable BRET-based in vivo imaging probe for detecting the activity of hypoxia-inducible factor regulated by the ubiquitin-proteasome system. Sci Rep 6, 34331 (2016).
- [3] Kuchimaru T, Iwano S, Kiyama M, Mitsumata S, Kadonodono T, Niwa H, Maki S, Kizaka-Kondoh S. A luciferin analogue generating near-infrared bioluminescence achieves highly sensitive deep-tissue imaging. Nat Commun 7, 11856 (2016).
- [4] Hoang N, Kadonosono T, Kuchimaru T, Kizaka-Kondoh S. HIF-targeting prodrug TOP3 combined with gemcitabine or TS-1 improves pancreatic cancer survival in an orthotopic model. Cancer Sci, 107, 1151-1158 (2016).
- [5] Kadonosono T, Yamano A, Goto T, Tsubaki T, Niibori M, Kuchimaru T, Kizaka-Kondoh S. Cell penetrating peptides improve tumor delivery of cargos through neuropilin-1-dependent extravasation. J Controlled Release 201, 14-21 (2015).
- [6] Kuchimaru T, Hoshino T, Aikawa T, Yasuda H, Kobayashi T, Kadonosono T, Kizaka-Kondoh S. Bone resorption facilitates osteoblastic bone metastatic colonization by cooperation of insulin-like growth factor and hypoxia. Cancer Sci 105, 553-559 (2014).
- [7] Ueda M, Ogawa K, Miyano A, Ono M, Kizaka-Kondoh S, Saji H. Development of an Oxygen-Sensitive Degradable Peptide Probe for the Imaging of Hypoxia-Inducible Factor-1-Active Regions in Tumors. Mol Imaging Biol 15(6): 713-721 (2013).
- [8] Kadonosono T, Kuchimaru T, Yamada S, Takahashi Y, Murakami A, Watanabe H, Tani T, Inoue M, Tsukamoto T, Toyoda T, Tanaka T, Hirota K, Urano K, Machida K, Eto T, Ogura T, Tsutsumi H, Ito M, Hiraoka M, Kondoh G & Kizaka-Kondoh S. Detection of the onset of ischemia and carcinogenesis by hypoxia-inducible transcription factor-based in vivo bioluminescence imaging. PLoS ONE 6(11):e26640 (2011).
- [9] Kuchimaru T, Kadonosono T, Tanaka S, Ushiki T, Hiraoka M, Kizaka-Kondoh S. In vivo imaging of HIF-active tumors by an oxygen-dependent degradation protein probe with an interchangeable labeling system. PLoS ONE 5(12): e15736 (2010).
- [10] Kizaka-Kondoh S, ltasaka S, Zeng L, Tanaka S.Zhao T. Takahashi Y, Shibuya K, Hirota K, Semenza GL, Hiraoka M. Selective killing of hypoxia-inducible factor-1-active cell improves survival in a mouse model of invasive and metastatic pancreatic cancer. Clin Cancer Res 15(10): 3433-3441 (2009).
主な日本語総説・著書
- [1] 近藤科江 「生体光イメージング研究『生体の窓』活用の最前線」 実験医学34(14): 2339-2343 (2016).
- [2] 近藤科江、口丸高弘、門之園哲哉 「腫瘍内HIF活性のin vivo イメージング」 がんの分子イメージング、浦野泰照編集、p173-184, 2015 化学同人 2015年9月30日発行
- [3] 近藤科江、口丸高弘、門之園哲哉 「がん間質における低酸素応答が悪性化を駆動する」 実験医学33(5): 758-754 (2015).
- [4] 近藤科江 「腫瘍内低酸素環境を標的とした癌治療戦略」 Surgery Frontier, 21(2): 47-52 (2014).
- [5] 近藤科江 「がん特異的な環境標的である低酸素誘導転写因子HIF活性に対する抗がん剤の開発」 がん基盤生物、清木元治他編集、p81-87, 南山堂 2013年10月15日刊行
- [6] 近藤科江 「血管新生と低酸素」 血管新生研究の最先端、佐藤靖史、高倉伸幸 編集、医薬ジャーナル社、p172-183, 2013年2月10日刊行
- [7] 口丸高弘、門之園哲哉、近藤科江 「低酸素がん特異的イメージングプローブの開発」 PET Journal 24 : 7-9 (2013).
- [8] 口丸高弘、門之園哲哉、近藤科江 「血管系のin vivo イメージング:腫瘍HIFのイメージング」 血管医学13(2): 129-136 (2013).
- [9] 近藤科江 「機能イメージングによる病的低酸素の検出」 医学のあゆみ、244(4): 334-335 (2013).
- [10] 近藤科江 「低酸素誘導因子HIFの機能と低酸素-幹細胞様形質と治療抵抗性のリンク」 実験医学29(20): 148-155 (2011). 12月号
教員紹介
近藤科江 教授 医学博士
岐阜薬科大学厚生薬学科卒業後、単身渡米
Albany Medical College(Albany, New York)大学院に入学、1984年修士課程修了(医学修士)
帰国後、大阪大学大学院医学研究科博士課程に入学(微生物病研究所)
1989年博士課程修了(医学博士)
日本学術振興会研究員、新技術事業団岡山細胞変換プロジェクト研究員を経て、1999年に京都大学大学院医学研究科 助手、2004年にCOE准教授、2008年に特定教授
2010年より現職
- 所属学会
- 日本分子イメージング学会(監事、2012年会長)、日本女性科学者の会(理事)、日本女性技術者科学者ネットワーク(副理事長)、日本癌学会(評議員)、日本がん分子標的治療学会学(評議員)、日本血管生物医学会(評議員)、がんとハイポキシア研究会(代表)、日本分子生物学会、米国癌学会(AACR, Active member)、国際分子イメージング学会(2014年プログラム委員)
教員からのメッセージ
- 近藤教授より
-
自然資源の乏しい日本では、先端技術やそれを生み出す人材が最高の資源です。 新しい技術や材料を工学と医学の連携の中から生み出す研究分野は、既成概念に捕らわれない発想と失敗を恐れないチャレンジ精神がとても大事です。「新たな分野を開きたい」「日本から世界を変えたい」くらいのチャレンジ精神を持った人を応援したいと思っています。挑戦力と体力に自信のある方、お待ちしています。
※この内容は掲載日時点の情報です。