生命理工学系 News
マイクロ流体デバイスを用いて核モデルを持つ人工細胞を大量生産
階層構造を有する均一・均質な人工細胞を実現
概要
東京科学大学総合研究院自律システム材料学研究センターの丸山 智也特任助教、同大学情報理工学院情報工学系の瀧ノ上 正浩教授(生命理工学コース 副担当)、および中央大学理工学部の鈴木 宏明教授、大学院理工学研究科学生の米山 遼太郎(当時)と森川 直哉、牛山 涼太(当時)、津金 麻実子研究員、佐藤 玲子技術補佐員(当時)の研究グループは、マイクロ流体デバイスを用いて、人工核モデルを有する均一な人工細胞(袋状の脂質二重膜)[用語1]を再現性よく大量生産する技術を開発しました。また、この核モデルを起点に、タンパク質合成が可能なことも証明しました。
脂質やDNA、タンパク質といった分子を組み合わせて細胞のモデルをボトムアップ的に組み上げる研究が世界的に進められ、近年、真核細胞にみられる複雑な階層構造を再現する研究が加速しています。細胞内にあるさまざまな小器官(オルガネラ)[用語2]の中でもゲノムDNAが凝縮された細胞核を模倣した人工細胞ができれば、これまでの単純構造の人工細胞が実際の細胞により近づき、将来的な細胞代替バイオテクノロジーへ発展することが期待されています。
本研究グループは、これまでに、均一な人工細胞製造ライン[用語3]としてのマイクロ流体デバイスを開発しています[用語4]。本研究では、内液相、外液相、油相からなる3相流を実現するマイクロ流体デバイスを活用して、細胞サイズの均一な脂質膜小胞(リポソーム[用語1])の中にDNA凝集体[用語5]の材料(DNAナノスターと塩)をあらかじめ入れ込みました。加えて、内液相と外液層との間に糖の濃度差を与えることにより生じる体積変化の連鎖に伴う材料分子の濃縮で、均一な核モデルを生成するプラットフォームを開発しました。従来は、DNA凝集体をつくるために加熱と冷却(熱アニーリング)を行う必要がありましたが、本技術では、材料の濃度変化を制御することで、人工細胞内の他の酵素や反応系を生かしたまま核モデルの構築を実現しました。その結果、核モデルに組み込んだ遺伝子から、緑色蛍光タンパク質(GFP)[用語6]を合成することにも成功しています。
この核モデルを持つ人工細胞は、分子認識や環境応答などの機能付与につながり、将来的には天然の細胞を代替する人工細胞生成へと展開することが期待されます。
本研究成果は、2025年6月16日(米国東部時間)付で、アメリカ化学会の国際オンライン学術誌「JACS Au」に掲載されました。
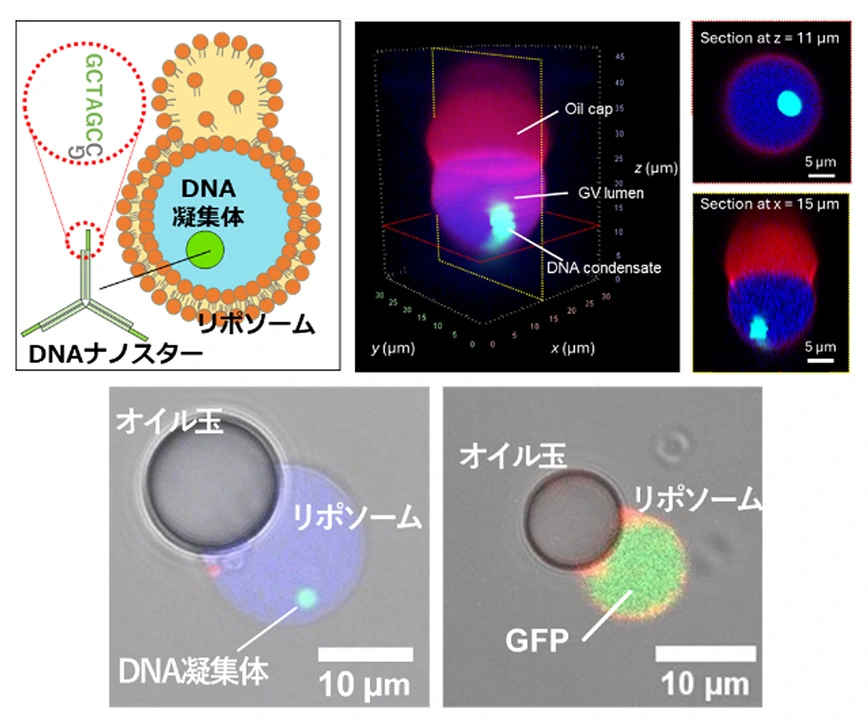
(上)人工細胞(リポソーム)内に形成DNA凝集体の模式図と3Dスキャン画像。
(下)リポソームの顕微鏡写真。中にDNA凝集体ができ、そこからGFPが発現している。
背景
近年、真核細胞にみられる複雑な階層構造を再現し、ボトムアップ的に人工細胞を構築しようとする研究が急速に発展しています。細胞内に存在する小器官(オルガネラ)が持つ特有の機能や性質は、脂質膜などによる区画への局在化により制御が行われることが知られています。特に、近年、水溶性高分子凝集による液液相分離(LLPS)[用語7]による区画化が、細胞質とは異なる環境を局所的に提供していることが発見され、精力的な研究がなされています。
さまざまなLLPS系のうち、人工的に設計・合成したDNAナノ構造からできるDNA凝集体(DNA液滴やDNAハイドロゲル)は、塩基配列の設計、分子修飾、環境制御によって、物理的性質や分子認識能力を精密に制御できるバイオナノ材料として注目を集めています。しかし、これらはナノスケールでの構造や働きのみが調べられており、マイクロスケールのDNA凝集体生成の制御や、人工細胞区画への組み込みは行われていませんでした。また、従来のDNA凝集体の調整方法は熱処理を用いていたため、人工細胞を構成する脂質膜やその内部に共封入したタンパク質などにダメージが加わってしまいます。これにより、生体の複雑な代謝反応系を組み込むことが難しいという課題もありました。
研究内容と成果
本研究グループは、これまでに、マイクロ流路デバイスを用いて、均一な人工細胞容器としての巨大リポソーム(細胞と同程度のサイズのリポソーム)を製造するシステムを開発していました[用語4]。これは、人工細胞を組み立てる製造ライン(アセンブリライン[用語3])と考えることができます。本研究では、この系を用いて、均一な人工細胞の中に人工核の材料としてのDNAナノ構造体を封入し、それを濃縮させて凝集体をつくることで、均一な核モデルを持つ人工細胞の構築を行いました。
具体的には、内液相、外液相、油相からなる3相流を実現するマイクロ流体デバイスを用いて、DNAナノスター(Yモチーフ)溶液を内封した均一サイズのリポソームを作製します(図1a)。その後、内液相と外液層との間に糖の濃度差を与えると、脂質二重膜を介した浸透現象が生じ、リポソームが収縮または膨張します。それに伴い、リポソームの内封溶液が濃縮または希釈されます。この内封溶液には、事前に配列設計された3種類の一本鎖DNAと塩が含まれています。3種類のDNAは、3本のアームを持つナノスター構造を形成し、DNA濃度および塩濃度が高まるに従って、各アームの端にあるDNAの粘着末端が結合して液滴のような凝集体になります(図1b)。
本研究グループは、このリポソーム内濃度制御方法により、温度変化を使わない均一サイズのDNA凝縮体の形成を実現しました。本論文では、均一なリポソームを内でのDNA凝縮体形成の制御(図2)、最終的なサイズ制御、可逆的な形成/溶解、配列設計による複数凝縮体の形成制御(図3)、およびDNA凝縮体に埋め込まれた遺伝子からのタンパク質合成(図4)を実証しました。
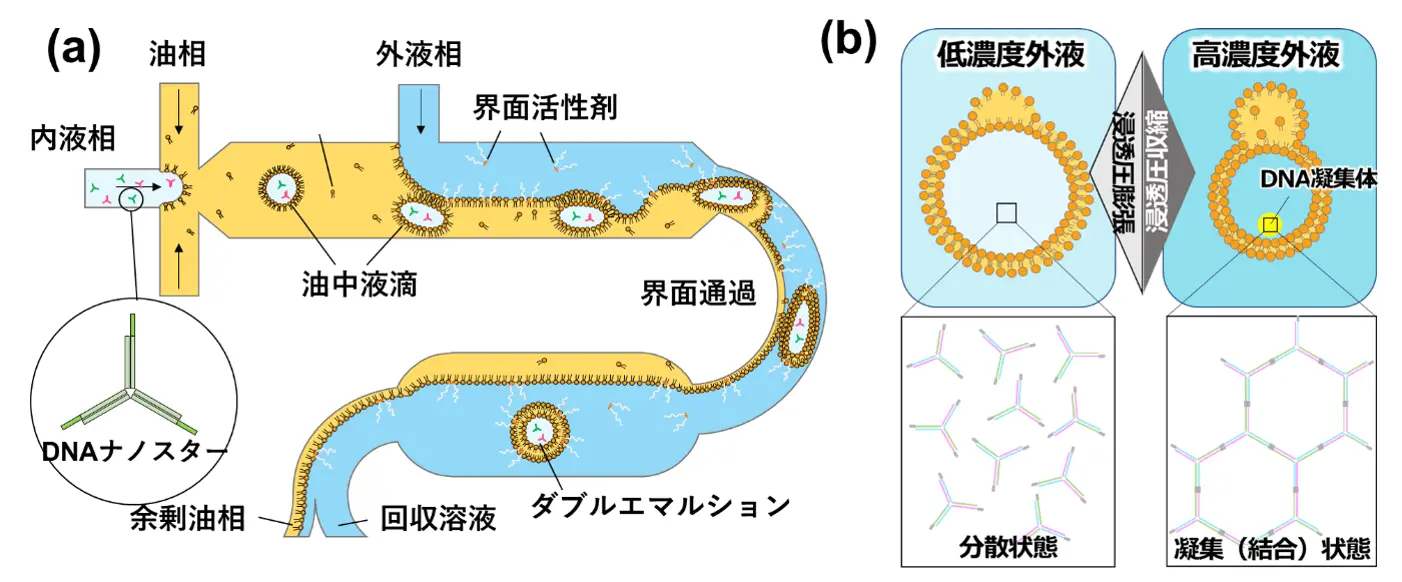
図1.マイクロ流体デバイスによる均一な人工細胞製造およびDNA凝集体の形成誘導
(a)既発表の均一リポソームを製造するマイクロ流路デバイスにおいて、内液相にDNA凝集体形成に必要な材料(DNAナノスターおよび塩など)を含む溶液を流し、均一なリポソームの前駆体液滴をつくる。(b)内液相と外液相との間に濃度差を加えることにより、リポソームに浸透圧収縮/膨張を与え、内液濃度を濃縮/希釈させ、DNA凝集体を形成/溶解させる。

図2.マイクロ流体デバイスで製造された均一な人工細胞の顕微鏡画像
(a)明視野画像、(b)蛍光画像。蛍光画像のうち、青は内部空間を示し、緑がDNA凝集体を示す。
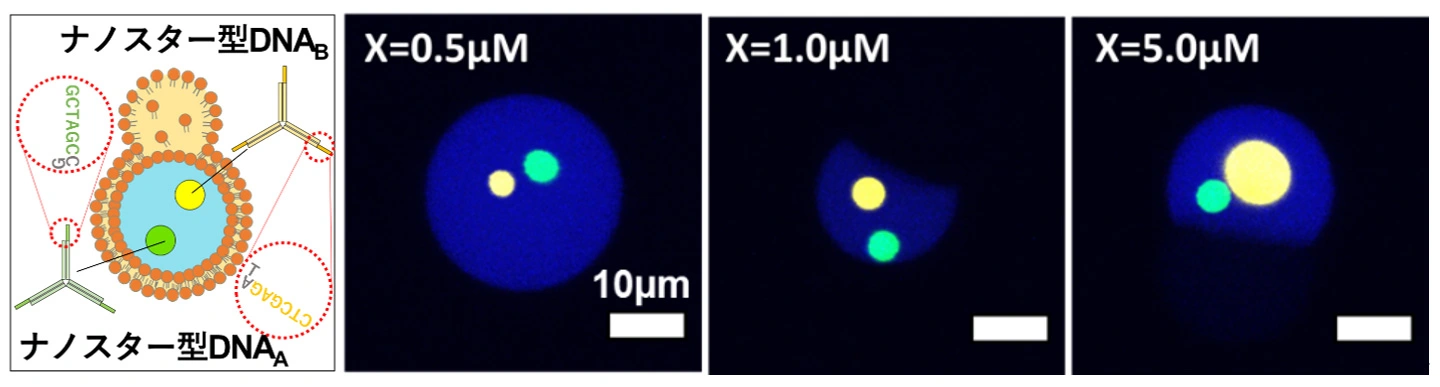
図3.配列設計した複数のDNA凝縮体の形成制御
(a)リポソーム内における2種類のDNA凝集体(直行DNA凝集体)の模式図。異なる粘着末端の塩基配列を持つナノスターDNAを2セット用いた。
(b)ナノスター型DNAAの封入濃度を一定として、ナノスターDNABの封入濃度(X)を変化させた場合の顕微鏡画像。形成される凝集体のサイズは、それぞれのナノスターDNAの濃度に基づいて決定され、互いに混ざり合わない独立した凝集体が形成されている。

図4.DNA凝縮体に埋め込まれた遺伝子の発現(タンパク質合成)
(a)遺伝子発現させる環境中でのDNA凝縮体形成。青と緑の蛍光色は、それぞれリポソームとDNA凝集体を示す。遺伝子発現させる環境内(リポソーム内)でもDNA凝集体が形成されていることを確認した。(b) ナノスターDNAなし、(c) ナノスター型DNAありでのタンパク発現。目的のタンパク質が発現されると緑蛍光を発する(GFPタンパク質)をリポソーム内に同封する。図は37℃で2時間インキュベートする前(上)と後(下)の画像を示す。赤と緑の蛍光色はそれぞれ脂質膜とタンパク質を示す。
今後の展開
マイクロスケールの均一なリポソーム内で、均一な核モデルとしてのDNA凝縮体を他の分子システムと共存させて構築する今回の研究成果は、これまでの人工細胞製造技術を大きく前進させ、実際の細胞が持つ、より複雑な構造や機能を有する人工細胞の製造へとつながります。
今後は、この人工細胞製造ラインのプラットフォームを用いて、細胞模倣環境における分子認識や環境応答など、さまざまな目的に利用できる自由度の高い人工細胞モデルを構築していきます。
この研究成果のもととなった研究経費(主管庁、配分機関等)
科学研究費補助金(文部科学省)
- 基盤研究(B)(鈴木宏明代表、24K01320)「マイクロ流路による多階層人工細胞構築基盤4.0」
- 学術変革領域(A)(瀧ノ上正浩代表、20H05935)「DNAナノスケールのモダリティ」
- 学術変革領域(A)公募研究(鈴木宏明代表、24H01155)、「超越バイオリアクターとしての均一非脂質ソームシステムの開発」
部分的な研究経費:基盤研究(B)(鈴木宏明代表、19H02576)「脂質二重膜バイオリアクタ形成デバイスの開発とバイオマーカ検出技術への応用」、基盤研究(A)(川野竜司代表、19H00901)「分子演算システムによる腫瘍由来核酸の高速パターン診断」、基盤研究(C)(津金麻実子代表、24K08214)「核酸医薬のDDSを指向した核酸封入膜小胞の新規作製法の開発」
科学研究費補助金以外の研究経費
中央大学理工学研究所共同研究研究プロジェクト計画 共同研究第Ⅰ類「マイクロ流路による多階層人工細胞構築基盤」(2023~2025年度)
- 用語説明
[用語1] 人工細胞、リポソーム: 既存の細胞に遺伝子組み換えなどの改変を加えるのではなく、タンパク質やDNA、エネルギー分子、膜を構成する分子、その他のさまざまな分子などを組み合わせて創られる、細胞の特徴を模擬した分子集合体を人工細胞と呼んでいます。目的によってさまざまな細胞の区画が使われますが、脂質二重膜でできたリポソーム(リン脂質の二重膜でできた袋)が最も生体膜に近く、多くの研究で使われます。リポソームの膜は、細胞とその外界を分け隔て、かつ、選択的な物質の流入出を制御したり、信号を受容したりする膜タンパク質の足場として働きます。リポソームの中にいろいろな分子を詰め込むことができ、細胞の部分的な機能を再現する研究が世界中で進められています。
[用語2] 細胞内小器官(オルガネラ):核、ミトコンドリア、小胞体、ゴルジ装置など、真核細胞の中にある脂質二重膜で区切られたそれぞれの区画内で、さまざまな役割を果たしています。一方、最近、細胞の中にある顆粒状の構造が、液液相分離(高分子の凝集)によってできていることが注目され、その構造や機能に関する研究が活発化しています。これらは、「膜なしオルガネラ(membranel-less organelle)」と呼ばれています。
[用語3] 人工細胞製造ライン(アセンブリライン):同種の細胞はサイズがおよそ均一ですが、従来の人工細胞研究で使われてきたリポソーム作製法では、基本的にサイズがばらばらのものしかできませんでした。また、人工細胞を構築する上で、生体高分子を高密度で封入できることも重要です。マイクロ流路を用いた製造法では、この2つの要件を満たすことができますが、これまでに汎用的な方法は普及していません。私たちは、精密機械の設計・製造を専門とする精密機械工学科に所属していることもあり、人工細胞製造のアセンブリラインと呼べるような、効率よく均質な人工細胞ができる技術開発を目指しています。
[用語4]
人工細胞製造用マイクロ流路デバイス(既発表):R. Ushiyama, K. Koiwai, H. Suzuki, “Plug-and-play microfluidic production of monodisperse giant unilamellar vesicles using droplet transfer across water-oil interface”, Sensors and Actuators B: Chemical, 355, 131281, 2021.
DOI: 10.1016/j.snb.2021.131281![]()
R. Ushiyama, S. Nanjo, M. Tsugane, R. Sato, T. Matsuura, H. Suzuki, “Identifying condition for protein synthesis inside giant vesicles using microfluidics toward standardized artificial cell production,” ACS Synthetic Biology, 13(1), 68-76, 2024.
DOI: 10.1021/acssynbio.3c00629![]()
[用語5] DNA凝集体:細胞内の染色体はDNAが高度に凝集したものですが、DNAナノテクノロジーの分野でも、DNAの凝集体が研究・応用されています。特に注目されているのが、DNAナノスターと呼ばれる、数本の短い一本鎖DNAを組み合わせて、Y型、X型など複数のアームを持ったDNAナノ構造の凝集体です。アームの先端に、4~10塩基の粘着末端を設けておくことで、ナノスター同士の結合を精密に制御でき、凝集や解離を制御し、かつ分子認識機能などを組み込むことができます。
[用語6] 緑色蛍光タンパク質(GFP, Green Fluorescent Protein):緑色に光る(蛍光を持つ)タンパク質です。2008年に下村脩教授がGFPの研究に関してノーベル化学賞を受賞したことは記憶に新しい。タンパク質合成の際に、合成量の確認が容易であるため、モデルタンパク質としてよく使われます。
[用語7] 液液相分離(LLPS):高分子がさまざまな相互作用により、水中で液滴状またはゲル状の凝集体を形成する現象。生命の起源はこのような現象の結果起こったという説もあります。
- 論文情報
| 雑誌名・出版社名: | JACS Au, American Chemical Society |
|---|---|
| タイトル: | Controlled Formation of DNA Condensates as Model Nuclei in Monodisperse Giant Vesicles |
| DOI: |
10.1021/jacsau.5c00568 |
関連リンク
- 複数のマイクロRNAを同時検出する「RNA液滴コンピュータ」の開発に成功|生命理工学系 News
- 酵素-DNA複合体ネットワークによる3種マイクロRNAの同時検出|生命理工学系 News
- 液滴の分裂によって、がんの可能性の有無を示す「DNA液滴コンピュータ」の開発に成功|生命理工学系 News
- 酵素反応が可能な細胞サイズの相分離DNAカプセルの構築に成功|生命理工学系 News
- エピゲノムの制御を受けた転写の方程式|生命理工学系 News
- 「DNA液滴」の形成と制御に成功|生命理工学系 News
- 粒子混雑効果による自発的なラチェット輸送に成功|生命理工学系 News
- DNAオリガミによる人工細胞微小カプセルの開発に成功|生命理工学系 News
- 骨格で支えられた人工細胞の形成に成功 薬用カプセルや化粧品などの応用に耐える補強が実現|旧・東京工業大学
- 人工細胞の中でDNAをコンピュータとして使うことに成功 —生体内で働く分子ロボットの実現に向けて—|旧・東京工業大学
- 鵜殿 寛岳 Hirotake Udono|研究者検索システム Science Tokyo STAR Search
- 瀧ノ上 正浩 Masahiro Takinoue|研究者検索システム Science Tokyo STAR Search
- 瀧ノ上研究室
- 情報理工学院 情報工学系
- 情報理工学院
お問い合わせ
東京科学大学 情報理工学院 情報工学系
教授 瀧ノ上 正浩
Tel 045-924-5653
Fax 045-924-5206
Email takinoue@comp.isct.ac.jp