生命理工学系 News
異種のドーパミン受容体が結合したD1-D2ヘテロ多量体の活性化によってインスリン分泌が調節される
糖尿病治療に向け、新たな発見
要点
- 膵臓β細胞に存在する異種のドーパミン受容体であるD1受容体とD2受容体が結合し、D1-D2ヘテロ多量体を形成してインスリン分泌を一時的に抑制。
- 同時に、β細胞をD2ホモ多量体の作用による細胞死から保護する。
- β細胞を過剰なインスリン分泌と細胞死から守り、正しい分泌を助ける。
概要
東京工業大学 生命理工学院 生命理工学系の上船史弥大学院生(博士後期課程3年)、坂野大介助教(生命理工学コース 主担当)、粂昭苑教授(生命理工学コース 主担当)らの研究グループは、同 情報理工学院 情報工学系の青西亨准教授、同 科学技術創成研究院の北口哲也准教授、神戸大学 医学研究科の清野進特命教授、高橋晴美特命准教授との共同研究により、血糖値を下げるインスリン[用語1]を分泌する膵臓β細胞[用語2]の働きが、2種の異なるドーパミン受容体[用語3]であるD1受容体とD2受容体が結合したD1-D2ヘテロ多量体[用語4]によって抑制、調節されることを明らかにした。
高血糖状態が慢性化し、過剰なインスリンの産生・分泌が続くと、分泌を担うβ細胞は疲弊して分泌障害や細胞死を起こすため、インスリン分泌の適切な調節は必須である。この調節を担う物質の1つがβ細胞にある細胞内小胞内でインスリンとともに貯蔵されているドーパミン[用語5]で、インスリン分泌時に同時に細胞外へ放出され、β細胞の表面にあるドーパミン受容体を介してβ細胞に作用し、インスリン分泌を抑制する。本研究では全反射照明蛍光顕微鏡(TIRFM)[用語6]による観察などを行い、複数あるドーパミン受容体のうちD2受容体に結合したドーパミンはインスリン分泌を抑制する一方で、シグナルが過剰に働くとβ細胞の機能不全と細胞死を招くことを明らかにした。また、D1受容体とD2受容体が結合したD1-D2ヘテロ多量体を活性化することでインスリン分泌が一時的に抑制されること、さらにこのD1-D2ヘテロ多量体の形成がD2受容体の過剰な働きによる細胞死からβ細胞を保護することも解明した。
β細胞がインスリン分泌能を維持し続けるための機構の一部を明らかにした本研究は、糖尿病に対する創薬研究や再生医療に役立つことが期待される。研究成果はアメリカ糖尿病学会誌「Diabetes」に6月22日付けでオンライン掲載された。
背景
膵臓β細胞で分泌されるインスリンというホルモン[用語7]は、血糖値を下げる役割を持ち、これが不足したり作用が不十分であったりすると高血糖状態になり、糖尿病の原因となる。慢性的な高血糖状態ではインスリンの要求性が高まり、β細胞では過剰なインスリンの産生・分泌が引き起こされるが、こうした過剰なインスリンの分泌が続くとβ細胞が疲弊し、正しく分泌が行えなくなったり、細胞死を起こしたりして長期的に正常な血糖値を持続することが難しくなる。そのため、インスリン分泌は適切に調整される必要がある。
β細胞は単糖類の一種であるグルコースの濃度に応じてインスリンを分泌しており、食事直後に第1段階となる大量の分泌を行って急激な血糖値の上昇を防いだ後、穏やかで持続的な第2段階の分泌を行い、血糖値を安定に保つ。
この第2段階のインスリン分泌の調節にはさまざまなホルモンや神経伝達物質が関わっており、神経伝達物質として知られるドーパミンもその一種である。
ドーパミンはβ細胞にも存在しており、Gタンパク質共役型受容体(GPCR)[用語8]の1つであるドーパミン受容体を介してインスリン分泌を抑制する。
その具体的な仕組みは次の通りだ。(1)ドーパミンは平時、β細胞内で合成され、インスリンが貯蔵されている細胞内小胞内にインスリンとともに取り込まれている。(2)食後などに、インスリンが分泌されるのと同時に細胞外へ放出される。(3)分泌されたドーパミンは、β細胞表面のドーパミン受容体を介して作用し、インスリン分泌を抑制する。
本研究にも参加している粂教授が率いる粂・白木研究室では、これまでにドーパミンの正常な貯蔵がβ細胞の機能維持に重要であることを明らかにしている(Sakano et al., 2020)。しかしながら、β細胞自身が産出、貯蔵、分泌するドーパミンがどのような形でβ細胞の機能を調節しているかの詳細なメカニズムについては不明な点が多かった。そこで同研究室の上船らは本研究を通じ、β細胞自身が合成・貯蔵し、分泌するドーパミンがどのようにインスリン分泌を制御しているのかの解明に取り組んだ。
研究の手法と成果
1. 蛍光イメージング法を用いた、全反射照明蛍光顕微鏡(TIRFM)による平常時のインスリン分泌動態の観察
上船らはドーパミンによるインスリン分泌制御の解明に向け、マウス膵臓β細胞を用い、まずはドーパミン受容体の阻害剤などを用いずに通常時のインスリン分泌動態の解析を行った。インスリンはβ細胞の細胞内分泌小胞に貯蔵されており、単糖類の一種であるグルコースなどの刺激があるとそれに反応し、開口放出[用語9]によって細胞外へと放出される。
本研究では、短いスパンにおける状況の変化を素早く観察するため、発光速度が速い蛍光タンパク質である「Venus」を利用した蛍光イメージング[用語10]法を使いながら、細胞膜近傍の観察を可能とする全反射照明蛍光顕微鏡(TIRFM)を用いることによって、分泌されたインスリン顆粒の開口放出の様子を可視化し、解析を行った。その仕組みと結果を図1に示す。
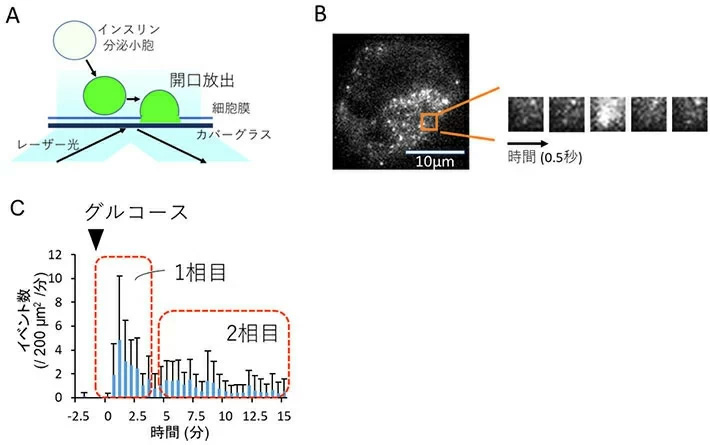
図1. 全反射照明蛍光顕微鏡(TIRFM)によるインスリン分泌顆粒の開口放出の観察
A. TIRFMによる観察の仕組み。緑色に明るく発光する蛍光タンパク質「Venus」を使い、Venusとインスリンとの融合タンパク質を膵臓β細胞に強制発現させた上で、TIRFMで観察する。これにより細胞膜近傍100 nm以内の範囲での蛍光確認が可能となり、細胞膜近傍でインスリン顆粒の開口放出が起きた際に可視化される。
B. 膵臓β細胞のTIRFM画像。右の小さな画像は、橙色の囲み内の0.5秒ごとの連続画像を拡大したもの。分泌顆粒が開口放出される際のpH変化に応じたVenusが明るい蛍光を発することによって、インスリンが分泌されたことがわかる。開口放出のイベント数については、数値計算ソフトMatlab(Mathworks)上で検出するプログラムを作成して、計測を行った。
C. マウス膵臓β細胞におけるグルコース応答性インスリン分泌を、TIRFMを用いて計測し、解析を行った結果。
図1Cを見ると、高グルコース濃度に対するβ細胞でのインスリン分泌は、素早く大量の分泌が行われる1相目(刺激後0~5分程度)と、その後の持続的で緩やかな2相目(5分以降)に分かれる2相性を呈していることが見て取れる。細胞内のドーパミンの合成や貯蔵を阻害すると2相目の分泌が増加したことから、合成・貯蔵されたドーパミンがインスリン分泌2相目を抑制していることが判明した。
2. 種類の異なるドーパミン受容体にそれぞれ対応した阻害剤を用いた際のインスリン分泌動態の観察
ドーパミンの作用はドーパミン受容体を介してもたらされる。このドーパミン受容体には、興奮性のD1様受容体(D1受容体、D5受容体)と抑制性のD2様受容体(D2受容体、D3受容体、D4受容体)があることが知られている。膵臓β細胞上にはこれらの双方が存在しているため、本研究では続いて双方がインスリン分泌にどのように関与するかを、それぞれの受容体に特異的な阻害剤を用いて調べたところ、D1受容体の阻害剤がインスリン分泌を亢進した。一般的にD1受容体はcAMPの合成を促し、cAMPはインスリン分泌を増加させると考えられているため、予想外の結果であった。これはD1受容体がドーパミンによるインスリン分泌の抑制に関与することを示すものであった。
3. D1受容体、およびD2受容体をそれぞれ強制発現させたβ細胞におけるインスリン分泌動態の観察
先の結果を受け、本研究ではD1受容体、D2受容体の双方によるインスリン分泌への影響を調べるため、D1受容体を強制発現させる作用を持つ(D1OE)アデノウイルス[用語11]と、D2受容体を強制発現させる作用を持つ(D2OE)アデノウイルスを作製し、それぞれβ細胞への強制発現を行った上で、全反射照明蛍光顕微鏡(TIRFM)によって両者のインスリン分泌を観察した。その結果、D1受容体を強制発現させたβ細胞は糖応答性インスリン分泌能(GSIS)を示し、ドーパミンによる分泌の阻害はないことが分かった。一方で、 D2受容体を強制発現させたβ細胞では、糖応答性インスリン分泌能が失われていることが明らかになった(図2)。
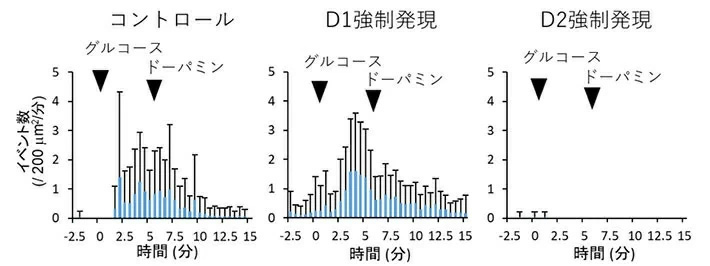
図2.全反射照明蛍光顕微鏡(TIRFM)による、D1受容体およびD2受容体を強制発現したβ細胞のインスリン分泌の観察結果
D1受容体およびD2受容体を強制発現したβ細胞におけるインスリン分泌を、それぞれTIRFMで観察した結果。強制発現を行わなかったコントロール、およびD1受容体の強制発現を行ったものでは糖応答性インスリン分泌能が観測されるが、D2受容体の強制発現を行ったものではインスリン分泌能が消失した。
4. D1受容体とD2受容体の結合により形成されたヘテロ多量体の有無の確認
粂・白木研究室ではこれまでの研究により、マウスβ細胞においてドーパミンD2受容体がアデノシンA2A受容体と結合してヘテロ多量体を形成し、D2受容体単体とは異なる形で下流過程にあるシグナルを調節することを明らかにしている(Sakano et al., 2016)。一方で、中枢神経ではD1受容体とD2受容体のヘテロ多量体形成が新たな下流シグナルを生むことが知られていた(Lee et al., 2004, So et al., 2005)。このことと、今回、野生型とD1受容体強制発現ではドーパミンを添加した時の結果が異なることから、当研究グループでは、D2受容体はD1受容体と結合することによっても、D2受容体単体とは異なる働きによってインスリン分泌を制御していると予想した。
そこで次にマウスβ細胞において、D1受容体とD2受容体が結合したD1-D2ヘテロ多量体の有無について、2種の異なるタンパク質同士が結合するなど非常に近接して存在するときに免疫組織化学的に可視化されるDuolink近接ライゲーションアッセイ(PLA)[用語12]を用いて確認した。その結果、PLAシグナルが検出されたことから、D1受容体とD2受容体が近接して存在することが確認され、双方の結合によるヘテロ多量体の形成が強く示唆された。特定のタンパク質とその分子の大きさを検出するウエスタンブロット法からもD1受容体とD2受容体のヘテロ多量体と一致する大きさのバンドが分離されたので、D1-D2ヘテロ多量体の存在が支持された。また、ドーパミンを添加すると、PLAシグナルの蛍光強度が増加したことから、ドーパミンがヘテロ多量体形成を促進することが分かった(図3)。
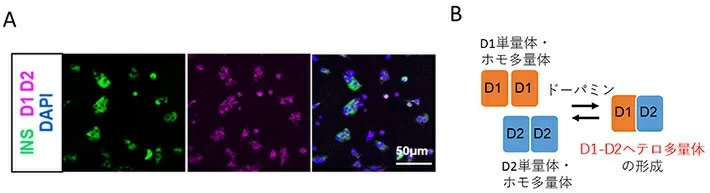
図3. Duolink近接ライゲーションアッセイを用いた、β細胞おけるD1受容体とD2受容体の相互作用(D1-D2ヘテロ多様体の形成)の観察
A. D1抗体とD2抗体を用いたPLAシグナル(赤)が観察されたことから、マウス生体から取り出したインスリン陽性のβ細胞(緑)において、D1受容体とD2受容体がD1-D2ヘテロ多量体を形成していることが分かった。
B. D1受容体、D2受容体は単量体またはホモ多量体からD1-D2ヘテロ多量体を形成する。このヘテロ多量体の形成は、ドーパミン存在下で促進される。
5. D1-D2ヘテロ多量体による、インスリン分泌およびβ細胞の生存に対する影響の確認
D1-D2ヘテロ多量体の存在が確認できたところで、そのインスリン分泌への影響を調べるため、D1-D2ヘテロ多量体を特異的に活性化する作用を持つSKF83959を加えた上で、全反射照明蛍光顕微鏡(TIRFM)を用いてインスリン分泌を観察した。その結果、高グルコース条件下において、SKF83959の添加から2.5分にわたり、インスリン分泌が減少したことが観察された(図4、赤点線枠内)。これはD1-D2ヘテロ多量体の働きによって、インスリン分泌が短期的に抑制されたことを示す。
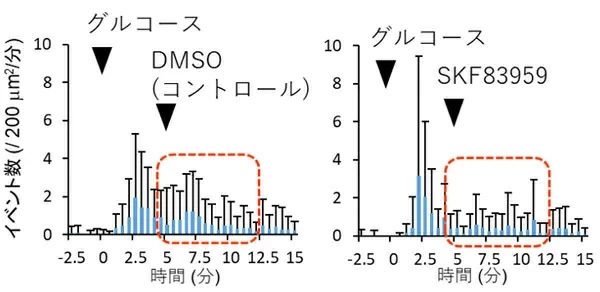
図4. D1-D2ヘテロ多様体を活性化するSKF83959を用いたインスリン分泌の観察
D1-D2ヘテロ多様体を活性化するSKF83959を加えた上で、全反射照明蛍光顕微鏡(TIRFM)を用いてインスリンの開口放出の観察を行った。その結果、SKF83959の代わりにその溶媒であるジメチルスルホキシド(DMSO)を加えたコントロール(左)と比較して、SKF83959を加えたD1-D2ヘテロ多様体(下)は添加直後の短時間内の分泌イベント数を減少させた(赤枠内)。
最後にD1受容体とD2受容体およびD1-D2ヘテロ多量体が、β細胞の生存に関与するかについて、酵素を使った蛍光色生成により細胞死した細胞を検出するTUNEL法を用いて確認した。具体的には、マウスβ細胞にD1受容体を強制発現させたもの(D1OE)、D2受容体を強制発現させたもの(D2OE)、さらにD1受容体とD2受容体の双方を同時に強制発現させたもの(D1D2OE)を用意し、TUNEL法で細胞死の有無を確認した。すると、D2受容体を強制発現させたもの(D2OE)ではドーパミン存在下で細胞死が増加する一方で、D1受容体とD2受容体を同時に強制発現させたもの(D1D2OE)については細胞死が阻害されていることが明らかになった(図5)。
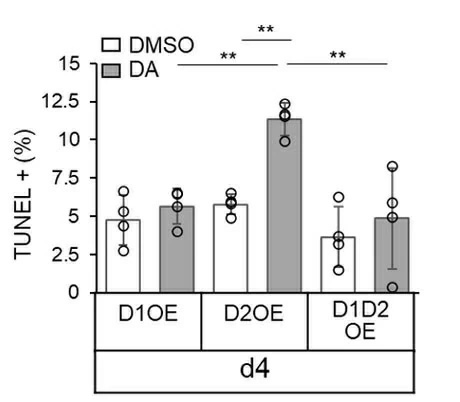
図5. D1受容体を強制発現させた(D1OE)β細胞、D2受容体を強制発現させた(D2OE)β細胞、D1とD2の両方の受容体を同時強制発現させた(D1D2OE)β細胞における、培養4日目(d4)のTUNEL法での陽性細胞の割合
D2OEではドーパミン(DA)存在下でのTUNEL陽性率が増加するが、D1D2OEではTUNEL陽性率の増加は見られなかった。D2受容体の強制発現は細胞死を誘導するが、D1受容体を同時に強制発現させることで阻害されることが分かる。
このことから、D2受容体を介したドーパミンの作用によってインスリン分泌阻害システムが過剰に働くと、β細胞の機能不全と細胞死が誘導されることが分かった明らかになった。さらに、形成されたD1-D2ヘテロ多量体によって、インスリン分泌を適切に抑制しながら、β細胞機能不全や細胞死が誘導されないように調節が行われていることが推察された (図6)。
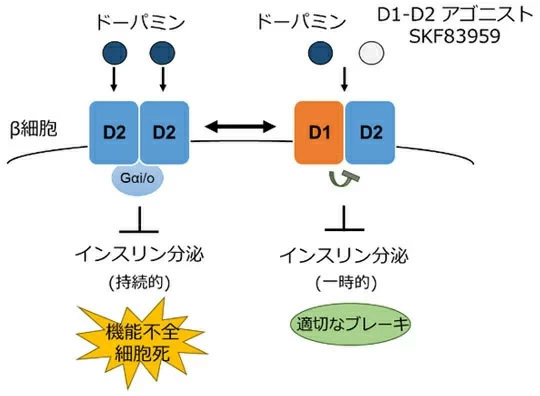
図6. D1-D2ヘテロ多量体によるβ細胞の機能調節機構
D2受容体はドーパミンによって持続的にインスリン分泌を抑制する一方で、過剰に働きすぎれば機能不全と細胞死を誘導する。しかし、D1受容体が同時に存在することで、D1-D2ヘテロ多量体を形成し、一時的な分泌抑制を示しながら細胞死を誘導することなく、適切なブレーキ機構として働く。
今後の展開
本研究によって、膵臓β細胞の機能がドーパミンのD1受容体とD2受容体という2つのGタンパク質共役型受容体(GPCR)の相互作用によって調節されていることが明らかとなった。D2受容体は、“ハブ受容体”として、多くの異なるGPCRと会合することが知られている。個々のGPCRはβ細胞の機能を調節する機構の一端にすぎず、実際には複数のGPCRが協調して働くことで機能を緻密にコントロールしていると予想している。今後、ドーパミン受容体を含めたGPCR同士の相互作用への理解をさらに深めていくことによって、糖尿病治療の新たな治療標的になると期待している。
- 用語説明
[用語1] インスリン : 膵臓のランゲルハンス島(膵島)にあるβ細胞において合成・分泌されるペプチドホルモンの一種。食後、単糖類の1つであるグルコースの血液中の量が増えることで分泌される。肝臓、脂肪細胞、骨格筋などに作用し、グルコースの取り込みを促進させ、血糖値を下げる働きをする。
[用語2] 膵臓β細胞 : 膵臓のランゲルハンス島(膵島)にあって、インスリンの合成と分泌を行う細胞。単にβ細胞とも言う。ヒトでは膵島の細胞の50〜70%を占める。糖尿病になるとこのβ細胞の細胞量や機能が低下し、インスリン分泌不全や慢性的な高血糖が引き起こされる。
[用語3] ドーパミン受容体 : Gタンパク質共役型受容体(GPCR)の一種。ドーパミンと結合することで活性化し、信号が伝達される。現在5つのドーパミン受容体が知られており、興奮性のD1様受容体(D1受容体、D5受容体)と抑制性のD2様受容体(D2受容体、D3受容体、D4受容体)に大別されるが、興奮性作用と抑制性作用については実際にはそう単純なものではないとされている。
[用語4] 多量体 : 構成単位となる低分子化合物(単量体)が複数、化学的に結合して構成される分子量の大きい物質。ホモ多量体は同種の化合物が結合したもので、ヘテロ多量体は異なる種類の化合物が結合したもの。
[用語5] ドーパミン : 生体内で合成されるアドレナリン、ノルアドレナリンの前駆物質。神経の細胞間で信号を伝えるために使われる神経伝達物質としても働き、ドーパミンD1受容体(D1受容体)、ドーパミンD2受容体(D2受容体)といったそれぞれに異なる機能を持つ受容体と結合して作用する。
[用語6] 全反射照明蛍光顕微鏡(Total Internal Reflection Fluorescence Microscopy/TIRFM) : カバーガラス上で励起光を全反射させることで、細胞膜近傍の現象を可視化する顕微鏡。励起光をこの条件で照射すると、境界面にエバネッセント光が生じる。この光は厚さ数百ナノメートルの範囲のみに沁み出すので、細胞膜近傍の数百ナノメートルの範囲だけが励起され、これによってインスリン分泌のような膜近傍で生じる現象を高解像で観察することが可能となる。
[用語7] ホルモン : 動物や植物にある特殊な組織で生産され、産出部位から離れた特定の細胞で生理的変化を起こす物質を言う。動物ホルモンと植物ホルモンに大別され、動物では下垂体、副腎、甲状腺、膵臓などの内分泌腺から分泌される。
[用語8] Gタンパク質共役型受容体(GPCR) : 細胞膜上あるいは細胞内の構成膜上に存在する受容体の一種。細胞外のホルモンや神経伝達物質と結合し、そのシグナルを細胞内に伝える。その際にGタンパク質と呼ばれる三量体タンパク質を介してシグナルを伝達する。現在、ヒトでは800種類以上など、数多くのさまざまなGPCRが発見されており、多くの疾患に関与し、多くの創薬標的となっている。
[用語9] 開口放出 : 細胞内の分泌小胞が細胞膜に融合することで分泌小胞の内容物が細胞外へ放出される一連の現象のこと。エキソサイトーシスとも呼ばれる。
[用語10] 蛍光イメージング : 特定の分子と反応すると強い蛍光を発したり、蛍光の色調が変わる蛍光タンパク質などを使って、生体中の目的分子の動きを可視化する技術。
[用語11] アデノウイルス : 咽頭炎、角結膜炎等を起こす、アデノウイルス科の二重鎖直鎖上DNAウイルス。ゲノムDNAに遺伝子を組み込むことがないため、一過的に遺伝子を過剰発現させる目的で細胞への遺伝子導入によく用いられる。増殖性細胞のみならずβ細胞のような非増殖性細胞にも効率よく遺伝子を導入することが可能である。
[用語12] Duolink近接ライゲーションアッセイ(PLA) : タンパク質間相互作用を免疫組織化学的に可視化する手法。2つの異なるタンパク質に対し、宿主動物種の異なる抗体と、宿主動物ごとに結合するプローブを反応させることで、タンパク質同士が40 nm以内に近接する場合に相互作用を検出することができる。
- 論文情報
| 掲載誌 : | Diabetes |
|---|---|
| 論文タイトル : | Dopamine negatively regulates insulin secretion through activation of D1-D2 receptor heteromer |
| 著者 : | Fumiya Uefune, Toru Aonishi, Tetsuya Kitaguchi, Harumi Takahashi, Susumu Seino, Daisuke Sakano, Shoen Kume |
| DOI : | 10.2337/db21-0644 |
- ヒトiPS細胞から小腸細胞の作製に成功|生命理工学系 News
- 膵臓β細胞のインスリン分泌時の活性酸素に対する保護作用を解明|生命理工学系 News
- 自然発症型糖尿病モデルマウスの作製に成功|生命理工学系 News
- iPS細胞由来インスリン産生細胞におけるオープンイノベーション研究を開始|生命理工学系 News
- 生命理工学の面白さを語る~動画「生命の真理を探り、新たなものを作り出す」~|生命理工学系 News
- 顔 東工大の研究者たち Vol. 37 粂昭苑|研究ストーリー|研究
- 粂・白木研究室
- 粂昭苑 Shoen Kume|研究者検索システム 東京工業大学STARサーチ
- 坂野大介 Daisuke Sakano|研究者検索システム 東京工業大学STARサーチ
- 青西亨 Toru Aonishi|研究者検索システム 東京工業大学STARサーチ
- 北口哲也 Tetsuya Kitaguchi|研究者検索システム 東京工業大学STARサーチ
- 生命理工学院 生命理工学系
- 情報理工学院 情報工学系
- 科学技術創成研究院 化学生命科学研究所
- 科学技術創成研究院(IIR)
- 神戸大学 大学院医学研究科・医学部
- 研究成果一覧
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
教授 粂昭苑
E-mail : skume@bio.titech.ac.jp
Tel : 045-924-5812 / Fax : 045-924-5813