生命理工学系 News
細胞内の状態を可視化するセンサーの開発
新開発のタンパク質の色の変化でストレスのたまり具合を捉える
要点
- 酸化還元状態の変化で色が変わる新設計の蛍光タンパク質センサーを開発
- 色の変化で細胞内の酸化ストレスのたまり具合や酸化還元状態がわかる
- 代謝機能の異なる細胞内の酸化還元状態の変化の検出が可能に
概要
東京工業大学 科学技術創成研究院 化学生命科学研究所の杉浦一徳研究員(研究当時。現・大阪大学 産業科学研究所 研究員)と久堀徹教授(ライフエンジニアリングコース主担当)らは細胞内の酸化還元状態[用語1]をリアルタイムにモニターできる新しい蛍光タンパク質センサー[用語2]を開発し、動物細胞や植物細胞内の酸化ストレスのたまり具合、光合成に伴う酸化還元状態が変化する様子などを捉えることに成功した。
細胞内の酸化還元状態の変化を探るために様々なタンパク質センサーが開発されてきたが、今回、還元状態から酸化状態の変化によって青から緑に色が変わる新しいセンサーを開発した。環境の変化によって色を変えるアオガエルにちなんで、このタンパク質センサーを「FROG/B」と命名した。
生体内では酸素が過剰な電子を受け取ると反応性が極めて高い活性酸素種(一般にROSと呼ばれる)[用語3]が生成し、これがタンパク質や脂質を酸化して障害をもたらす酸化ストレスの原因になる。一方、光合成をおこなう生物では、光照射によって水が分解されて還元力が生じ、NADPH[用語4]という還元物質が作られる。このNADPHを利用して二酸化炭素が還元され、糖が合成されている(光合成反応)。また、水の分解で生じる還元力の一部は細胞内の様々な酵素の機能の制御にも使われている。多くの酵素は還元されると、活性が上昇、つまり、スイッチがオンの状態になる。したがって、細胞内の酸化還元状態を知ることは、光合成をおこなう細胞の機能制御のメカニズムを探る大切な情報である。
研究成果は6月23日付(現地時間)「Proceedings of the National Academy of Sciences, USA(アメリカ科学アカデミー紀要)」(電子版)に掲載された。
背景
生体内の酸化還元状態は様々な生体分子の機能を調節する極めて重要な細胞内環境因子である。例えば、動物細胞内で酸素が電子を受け取る(還元される)と反応性の極めて高い活性酸素種(ROS)が生成し、これがタンパク質や脂質を酸化することによって機能障害を引き起こす。これを酸化ストレスという。実際、抗がん剤の中には、ROSを積極的に生成させることによって、がん細胞を殺すものがある。
一方、光合成生物では光エネルギーを利用して水を分解し、酸素と還元力を得ている。この還元力のほとんどは還元物質であるNADPHとなって二酸化炭素の還元に利用され、糖分子を生成しているが、一部の還元力は光合成生物の細胞内の様々なタンパク質分子(酵素分子)の機能の制御にも利用されている。これを酸化還元制御[用語5]という。光合成生物では、ほとんどの場合、光が当たると、細胞内に生じる還元力によって酵素分子が還元され、活性化する。これによって光合成反応に関わる多くの酵素が働くようになり、光が当たっているときには活発に糖を合成する。夜になると、これらの酵素分子は酸化されて休憩状態に入る。このような制御が行われることで無駄な逆反応を防ぐことができる。
従って、細胞内の酸化還元状態を知ることは、動物細胞でも植物細胞でも極めて重要である。そのため、これまでも細胞内の酸化還元状態変化を知るためのセンサータンパク質が数多く開発されてきた。しかし、杉浦研究員や久堀教授らが以前開発したOba-QやRe-Q[用語6]など単一のGFP(緑色蛍光タンパク質)分子に変異を導入したものでは、その細胞内の発現量によってシグナル強度が変化してしまう。
roGFP[用語7]というセンサーは蛍光強度の比を取って測定を行うので発現量には依存しない代わりに、2つの励起波長で測定を行う必要があるためリアルタイムの測定が難しい。また、2種類の蛍光タンパク質をリンカーペプチド[用語8]でつないで作ったセンサーは、2種類のタンパク質の細胞内の安定性が異なるなど、それぞれに欠点があり、かならずしも使い勝手のよいものではなかった。
研究成果
杉浦研究員らは緑色蛍光タンパク質(GFP)にさまざまな変異を導入し、環境の酸化還元状態が変化したときに蛍光のスペクトルが変化するセンサータンパク質を分子設計した。このセンサータンパク質は、周辺の酸化還元状態が変化すると、2つのシステイン(Cys)[用語9]がジスルフィド結合[用語10]を形成したり解離したりすることで構造が変化する。さらに、発色団周辺に導入したアミノ酸変異により、タンパク質の構造変化が発色団を出発点とする励起状態の分子内プロトン移動(ESIPT(Excited state intramolecular proton transfer))[用語11]過程に変化をもたらすようなセンサータンパク質分子を設計した。
こうして、タンパク質の分子表面にある2つのシステインが還元状態にあるときには青色の蛍光、酸化ストレスが生じると緑色の蛍光を発するタンパク質を得ることに成功した。このタンパク質はこれまで作られたいずれのセンサータンパク質よりも簡便に細胞内の状態変化を調べることができる。そこで、この蛍光タンパク質センサーを「FROG/B(Fluorescent protein with RedOx-dependent change in Green/Blue)」と名付けた。
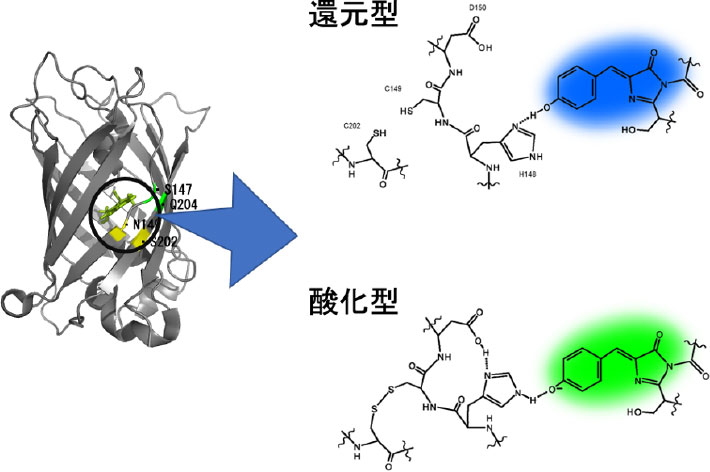
図1. ESIPT機構によるFROG/Bの蛍光色の変化の模式図
杉浦研究員らは、FROG/Bをがん細胞のモデル細胞であるHeLa細胞[用語12]に発現させ、細胞外から活性酸素種の一つである過酸化水素を与える、あるいは、活性酸素を発生させることでがん細胞を殺す働きをもつ抗がん剤Kp372-1を与えてみた。すると、細胞内が酸化されることを共焦点レーザー顕微鏡によって簡単に観察することができた。
このようにして誘導される酸化ストレスは、細胞内では結果的にグルタチオンという化合物の酸化を引き起こし、最終的にセンサータンパク質のシステインを酸化してジスルフィド結合を形成することが知られている。そこで、グルタチオンと還元力のやり取りを行うグルタレドキシン[用語13]という酸化還元タンパク質をFROG/Bに融合させたところ、HeLa細胞の酸化ストレスによって誘導される蛍光の変化の応答性が格段に向上することが分かった。
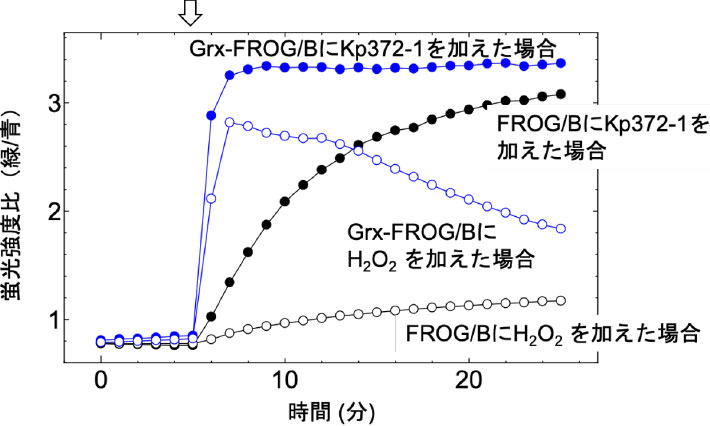
図2. Kp372-1とH2O2によるHeLa細胞内のFROG/Bの酸化シグナルの変化グルタレドキシン(Grx)を融合したセンサーの応答は圧倒的に速くなる。
次に、このFROG/B分子をシアノバクテリアAnabaena sp. 7120[用語14]の細胞内に発現させた。このシアノバクテリアは、細胞が数珠状に連なる糸状性の藻類であるが、培養液から窒素源を除くと数珠状に連なった細胞(これを栄養細胞という)の中に10~20個に1個の割合でヘテロシスト[用語15]という特殊な細胞を形成する。このヘテロシスト細胞内では、ニトロゲナーゼ[用語16]という酵素が大気中の窒素を直接アンモニアに変換する窒素同化反応を行うことができる。
ところが、ニトロゲナーゼの反応中心は酸素に極めて弱いため、ヘテロシストの細胞内は酸素濃度の低い特殊な環境に保たれている。栄養細胞とヘテロシスト、それぞれで発現したFROG/Bのシグナルの変化を明暗条件で調べてみると、光が当たったときには栄養細胞の方の還元が早く進むが、暗所に移した時にはヘテロシストの方が早く酸化されるなど、興味深い挙動を示すことがわかった。
今後の展開
このように、このセンサーの開発によって、細胞内の酸化還元状態の変化を簡単、かつ経時的に調べることが可能になった。従って、このセンサーをがん細胞に利用すれば、効果がある抗がん剤のスクリーニングが簡単にできるようになると考えられる。また、光合成生物では様々な環境の変化に対して、代謝系酵素の活性制御に直接影響を及ぼす因子の解析に研究をさらに展開できるものと期待される。
謝辞
本研究は、科学研究費助成事業 新学術領域研究「新光合成:光エネルギー変換システムの再最適化」(計画班代表:久堀徹教授)の支援を受けて行われた。
- 用語説明
[用語1] 酸化還元状態 : 生体内では、ある物質から電子が奪われる(酸化)と別の物質が電子を受け取る(還元)。両者は必ず対になるので、酸化還元という。この現象が系の外側からの要因によって引き起こされると、多くの物質が酸化されたり、逆に還元されたりすることが起こる。このように変化する生体内の状態を酸化還元状態とよぶ。
[用語2] 蛍光タンパク質センサーFROG/B : FROG/BはFluorescent protein with RedOx-dependent change in Green/Blueの略。本研究で新たに作成した酸化還元状態の変化を蛍光の色の変化としてモニターできるようにしたセンサータンパク質。
[用語3] 活性酸素種 : Reactive Oxygen Species(ROS)。酸素分子が電子を受け取ることで生成する反応性の高い一連の分子種。一重項酸素、過酸化水素、ペルオキシラジカルなどが知られている。細胞はこれらに対する防御機構としてROS消去系を備えている。
[用語4] NADPH : ニコチンアミドアデニンジヌクレオチドリン酸。他の分子と電子のやり取りをすることで、酸化型のNADPと還元型NADPHの間で相互変換する。NADPHは光合成生物では、炭素固定反応の還元力供給源となる。
[用語5] 酸化還元制御 : 生体内の酸化還元状態に応じて、タンパク質分子の持っているジスルフィド結合の形成・開裂などを制御することにより、そのタンパク質の酵素活性を調節する分子機構。タンパク質の翻訳後修飾のひとつ。
[用語6] Oba-QやRe-Q : 杉浦研究員らがGFPに変異を導入して開発した酸化還元応答性の蛍光タンパク質。Oba-Qの蛍光はタンパク質を酸化すると消光し、Re-Qは還元すると消光する。
[用語7] roGFP : GFPの研究で下村脩博士と一緒にノーベル化学賞を受賞したRoger Yonchien Tsien(ロジャー・ヨンジェン・チエン)博士が2004年に発表した酸化還元応答GFP(緑色蛍光タンパク質)。分子表面にシステインを2個導入し、その酸化還元状態の変化によって励起スペクトルが変化する。
[用語8] リンカーペプチド : 2つのタンパク質を人工的につないで新しいタンパク質を作成するときに両方の機能を損ねずかつ適当な相互作用を誘導できるようにするアミノ酸配列。分子の機能によって短いもの(2アミノ酸)から長いもの(数十アミノ酸)まで用いられる。。
[用語9] システイン(Cys) : cysteine(2-アミノ-3-スルファニルプロピオン酸)はアミノ酸の1つ。側鎖にあるチオール基(SH基)は反応性が高く、酸化されると他のCysが持つチオール基とジスルフィド結合という共有結合を形成するため、タンパク質の立体構造変化に直接影響する。また、チオール基単独でも、スルフェン基(SOH基)やスルフィン基(SOOH基)などに酸化される。
[用語10] ジスルフィド結合 : 2つのCysが持つチオール基がタンパク質分子内で適当な距離にある時に、酸化によって電子を奪われるとチオール基を構成するS原子が直接共有結合する。これをジスルフィド結合とよぶ。
[用語11] 分子内プロトン移動 ESIPT(Excited state intramolecular proton transfer) : 発色団分子のπ共役系の励起に伴いプロトンが脱離して電離型になる反応。非電離型のGFP発色団の場合、ESIPTが起きなければ、本来の青色蛍光を示すが、ESIPTが起きて電離型発色団になることで緑色蛍光を発する。
[用語12] HeLa細胞 : 1951年に子宮頸癌で亡くなった女性の腫瘍から分離され、株化されたヒト由来の最初の細胞株。現在も、様々な哺乳類細胞の研究に用いられている。
[用語13] グルタレドキシン : システインのチオール基をもつトリペプチドであるグルタチオンから還元力を受け取り、還元力を必要とするペルオキシレドキシンや他の化合物に還元力を受け渡す。
[用語14] シアノバクテリアAnabaena sp. 7120 : 糸状性のシアノバクテリア(ラン色細菌)の一種。窒素飢餓条件でヘテロシスト(異型細胞)を形成し、ここで窒素固定反応を行う。窒素固定をおこなうニトロゲナーゼは酸素に弱いため、ヘテロシストの細胞壁は分厚くできており、外部からの酸素の侵入を防いでいる。
[用語15] ヘテロシスト : 異型細胞。糖脂質を主成分とする分厚い細胞壁をもち、酸素の侵入を防いで、ここで働くニトロゲナーゼを守っている。光合成電子伝達系のうち、酸素発生を担う光化学系IIを発現していない。
[用語16] ニトロゲナーゼ : 窒素同化を行う微生物が持っている酵素。分子上窒素(N2)を還元しアンモニアを生成する。作られたアンモニアはグルタミン合成酵素によりグルタミンに変換され、様々な代謝物に用いられる。
- 論文情報
| 掲載誌 : | Proceedings of the National Academy of Sciences, USA |
|---|---|
| 論文タイトル : | Real-time monitoring of the in vivo redox state transition using the ratiometric redox state sensor protein FROG/B |
| 著者 : | Sugiura K, Mihara S, Fu N, Hisabori T |
| DOI : |
- 植物の酸化還元状態をリアルタイムで検知|生命理工学系News
- 高感度な酸素センサータンパク質を開発|生命理工学系News
- 植物はどのようにして眠るのか|生命理工学系News
- ラン藻による有用物質の大規模生産に道を拓く―高価な誘導剤使わずに遺伝子発現を誘導するネットワークを構築―|生命理工学系News
- 葉緑体機能の制御に重要な新たな還元力伝達経路―二つの経路の協調が光合成や生育に必須―|生命理工学系News
- 藻類の「眼」が正しく光を察知する機能を解明|生命理工学系News
- 藻類を使ったアンモニア生産の可能性―ラン藻の遺伝子発現を制御して放出させることに成功―|東工大ニュース
- 生体内のタンパク質の酸化還元状態を可視化 ―DNAを着脱自在にした修飾化合物を利用して総合的分析を実現―|東工大ニュース
- 久堀・若林研究室
- 研究者詳細情報(STAR Search) - 久堀 徹 Toru Hisabori
- 科学技術創成研究院 化学生命科学研究所
- 科学技術創成研究院
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 化学生命科学研究所
教授 久堀徹
E-mail : thisabor@res.titech.ac.jp
Tel / Fax : 03-5734-2365