生命理工学系 News
【研究室紹介】 藤井・石内研究室(~2024.3)
生命理工学系にはライフサイエンスとテクノロジーに関連した様々な研究室があり、基礎科学と工学分野の研究のみならず、医学や薬学、農学等、幅広い分野で最先端の研究が活発に展開されています。
研究室紹介シリーズでは、ひとつの研究室にスポットを当てて研究テーマや研究成果を紹介。今回は、レーザー分光で生体分子の機能に迫る、藤井・石内研究室です。
※ 2020年6月30日:石内准教授は生命理工学院担当外となりました。
※ 2024年3月31日:藤井教授は東工大を退職されました。
| キーワード | レーザー分光、分子クラスター、超高速分光、反応ダイナミクス |
|---|---|
| Webサイト | 藤井・石内研究室 |
研究紹介
はじめに(背景)
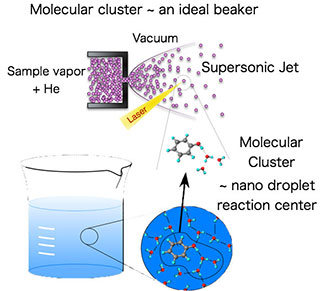
私たちの研究室では分子や分子が水素結合など分子間力で集合した分子クラスターの構造や反応を調べています。分子クラスターは溶質と溶媒分子など複数の分子の蒸気を真空中に噴射するとできる分子集合体です。真空中に噴射すると断熱膨張で分子の温度がゼロKに近い極低温まで下がり、しかも衝突がないので、水素結合やvan der Waals力のような弱い分子間力で結びついている溶液の反応中心を真空中に取り出したような状態と考えられています。しかもこの状態だと溶液と異なり分子数や分子同士の配向が固定されているので、分子の構造や反応を研究する場合、理想的なビーカーのようなものです。この状態にピコ秒レーザーを照射して時間分解赤外分光を行うと、化学反応を分子振動の時間変化でパラパラマンガのように追跡可能です。これにより光励起で引き起こされる励起状態プロトン・水素原子移動反応や溶媒和ダイナミクスといった化学・生物で基本的な化学反応の解明を現在も行っています。(分子クラスターを反応ビーカーとする時間分解分光をご覧ください)。
生体分子の気相分光への発展 ― 素朴な疑問
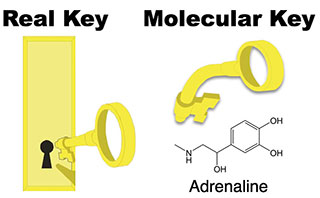
一方、分子クラスターのように分子同士が水素結合などの分子間力で結合する現象は生命現象で重要な役割を果たしています。特に生命現象では特定の分子同士だけが高い選択性で結合する分子認識が極めて重要です。例えばDNAによる遺伝情報伝達は核酸塩基A、T、G、CがA-T、G-Cという対を選択的に作ることで実現されていますし、神経伝達過程、抗原抗体反応など分子認識なしでは機能しない現象に溢れています。こういった分子認識は分子選択性の高さからしばしば「鍵と鍵穴」の関係と例えられています。
しかし、用いられている分子は我々の思う「鍵」とは随分異なるものです。例えば、神経伝達物質の一種であるアドレナリンはβ2-アドレナリン受容体というタンパク質で認識されて神経を動かしています。アドレナリン受容体は他の神経伝達物質を認識しないのでアドレナリンは確かに鍵の役目をしています。しかし、図からわかるようにこの分子はたくさんの単結合を持つ柔らかな分子で、どうしてこの分子が鍵の役目を果たせるのか、素朴な疑問が生じます。
気相分光の利点
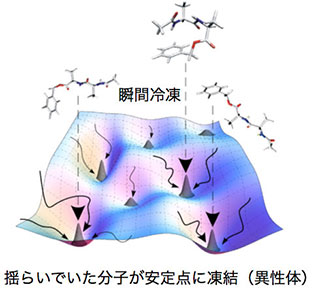
こういった生体分子の分子認識のメカニズムを知るには、まず柔らかな生体分子が取り得る形(コンフォメーション)を知る必要があります。しかし、常温で特に溶液では分子は様々なコンフォメーションを揺らいでしまい、何種類の安定な形があるか、とかそのうちどれが安定なのかを調べるのは容易ではありません。私たちは気相レーザー分光を使うとこの問題を解決できるのではないかと発想しました。つまり、生体分子を気体にして断熱膨張などで「瞬間冷凍」すれば、コンフォメーションの揺らぎが止まって安定な形(異性体)に凍結できます。こうなればレーザー分光と量子化学計算を使って分子の安定な形の数やその形を決めることができます。このような情報を元に生命現象に関連した分子認識がどうやって高い分子選択性が実現しているか理解できるのではないかと着想したのです。
生体分子の気化と気相レーザー分光
しかし、生体分子を気化させて真空中に取り出すのは非常に難しく、単純に加熱するだけでは熱分解して壊れてしまいます。このため、発想はあるものの実際に研究を進めることができませんでした。
大きく状況が変化したのがレーザーによる生体分子の蒸発法(Laser DesorptionやMatrix Assisted Laser Desorption / Ionization)や溶液から生体分子を真空中に取り出せるエレクトロスプレー法(Electrospray, ESI)の出現でした。特にESI法は溶液サンプルを直接使える点でとても優れており応用範囲が一気に広がりました。この方法は真空中にサンプル溶液を液滴として噴霧し、溶液の中にいる生体分子イオンが電場に引かれて移動するときに溶媒が蒸発し、イオン単体として真空に取り出せる、という原理です。
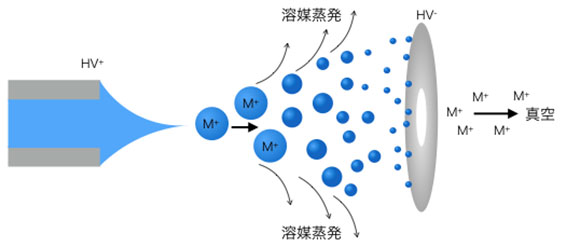
ESI法の原理
特に、真空に取り出した生体分子イオンをイオントラップという装置で捕捉し、これを極低温のヘリウムガスで冷却してやることでペプチドやタンパク質など従来全く手がつけられなかった生体分子に分子クラスターで培った非常に明確で感度の高いレーザー分光法を適用可能になり、レーザー分光の世界が大きく変化しつつあります。私たちも装置を工夫しながらこの方向で世界トップを走っている研究室と競争して、生体分子に対する新しい分光分野を切り開こうとしています。
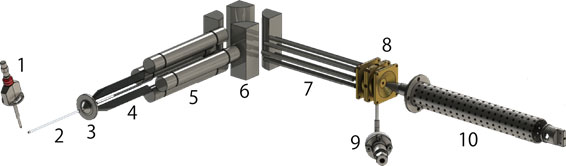
本研究室で開発したESI/冷却イオントラップ・レーザー分光装置
1:ESIエミッター、2:脱溶媒キャピラリー、3:スキマー(低真空側と高真空側を隔てる)、4:イオンガイド、5:四重極質量分析器(特定の質量のイオンを選択する)、6:イオンベンダー(イオンだけを直角に曲げ、中性分子を除去する)、7:イオンガイド、8:冷却イオントラップ(ここにレーザーを導入する)、9:バッファーガス導入バルブ(ヘリウムを導入し、イオンのトラップと冷却を促す)、10:飛行時間型質量分析装置(光解離生成物を検出する)
(S. Ishiuchi et al., J. Mol. Spectrosc. 332, 45 (2016), H. Wako et al., PCCP in press)
研究成果
以下、今まで私たちが明らかにした事柄を生体分子を中心に簡単に説明します。
a)神経伝達物質カテコールアミンの特異的なコンフォメーション数減少
代表的な神経伝達物質であるカテコールアミンは図の下の列ようにベンゼン環に2個水酸基が置換されているカテコール環を持っています。レーザーを2台使うHole-Burning分光法という方法でこれらが取り得る安定なコンフォメーションの数を調べると、図に示す数であることがわかりました(ドーパは1種類、ドーパミンは5種類…)。そこでカテコール環から1個OHを除いた類似体分子に対して同じ方法で安定コンフォメーション数を調べたら、なんと大幅に数が増えることがわかったのです。言い換えると神経伝達に使われている分子は、類似した分子と比べて取り得るコンフォメーションが大幅に少なくなっているのです。神経伝達物質は受容体の中で認識される時は特定の形をとっているはずなので、これらの分子のコンフォメーションの数が少ないのは生物の仕組みとして理にかなっているように思えます。現時点で厳密な解釈はまだ確立していませんが、こう行った生体分子の特異性はレーザー分光を気相の生体分子に適用して初めてわかる成果の例と思います。また、受容体と神経伝達物質の分子認識の理解に大きなヒントを与える結果ですが、このメカニズムは大局的には創薬に対する基礎理学でもあり、とても重要と考えています。
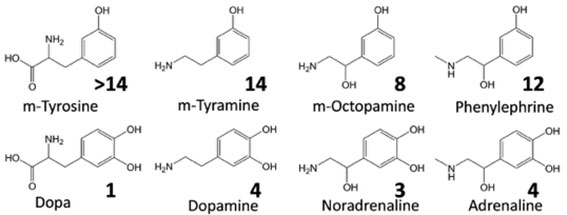
参考文献:S. Ishiuchi et al., PCCP 2011; JPCA 2011; Chem. Lett., 2013, H. Mitsuda, et al.,JPCL.2010, K. Makara, et al., JPCA 2008,
b)受容体・分子認識部位(ポケット)の部分ペプチドの構造
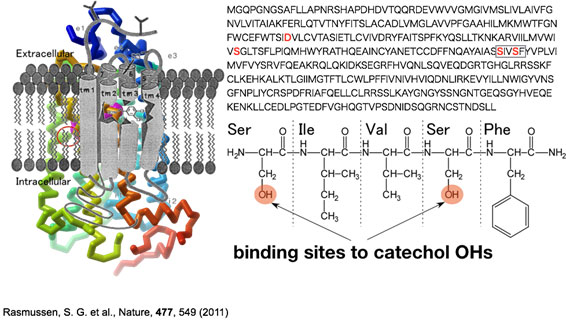
アドレナリンの受容体は7本のαヘリックスで構成される巨大な膜タンパクですが、分子認識を行なっている部位は生化学により明らかになっています。上のβ2アドレナリン受容体の場合、SIVSFという部位でカテコール環を認識していることがわかっており、さらに、アドレナリンを結合した場合の構造もX線構造解析で明らかにされています。しかし、依然として、どうして他の分子は認識されないのか、という点は明らかではありません。そこで、私たちは分子認識部位だけを取り出してこの部分ペプチドの構造を決め、次の段階で神経伝達物質を含む様々な分子と分子クラスターを作らせてその構造が分子ごとにどのように変化するかを調べると高い分子選択性のメカニズムがわかるのではないかと考えました。実際にこのSIVSFを真空中のイオントラップに閉じ込めて赤外分光から構造を決めると、単結合だらけの部分ペプチドですが、取り得る形は1種類に決まり、それもαヘリックスであることもわかりました。(S. Ishiuchi et al., PCCP 18, 23277 (2016), H. Otaki, et al., JPCB 120, 10199 (2016))
次なる段階はもちろんコンプレックス形成後の構造変化です。もう結果は出はじめており、このわずかな部分だけでも分子選択性がある、という「衝撃の結果」ですが、論文を書く前なのでここでは説明しません。興味があったら研究室に来てください。喜んでお見せします。
c)向精神薬リーマス(炭酸リチウム)の神経伝達物質への作用
炭酸リチウムは最古の向精神薬の一つで今でも躁鬱病の治療に使われていますが、その作用機序はわかっていません。そこで、ノルアドレナリン単体とリチウム、ナトリウムなどアルカリ金属との分子クラスターを測定してコンフォメーションを決めてみると、リチウムと結合した時だけ他とは異なるコンフォメーション分布になることがわかりました。(H. Wako et al., PCCP in press.)
d)ペプチド結合周りの水の運動

タンパク質はその周囲に水分子を水素結合させており、このbiological waterはその性質に大きな影響があるのではないか、と言われています。一方、タンパク質の水和水がどのくらいの時間で交換されていくのか、その寿命や運動は測定方法で大きく変わり、biological waterは氷のようだ、という意見からピコ秒で変わるという見解まで様々な説が言われています。これは溶液の中では特定の水だけを測定できない、という問題をよく表していると思います。そこで、私たちは非常に簡単なCO-NH結合を有するアセトアニリド分子に時間分解分光を適用し、イオン化をきっかけとしておよそ5ピコ秒でCOに結合した水分子がNH側に移動することを初めて明らかにしました。
e)プロトン・水素原子移動反応

プロトンや水素原子が移動する反応は化学・生物で基本的な反応です。私たちは光励起によるプロトン・水素移動反応を時間分解赤外・近赤外分光で追跡しています。最も新しい研究では水素原子の移動と思っていたものが、電子が移動し、プロトンがそれを追跡するという2段階の反応であることを初めて見出しています。
研究成果
代表論文
- [1] "Conformational study of protonated noradrenaline by UV-UV and IR dip double resonance laser spectroscopy combined with an electrospray and a cold ion trap methods", Hiromichi Wako, Shun-ichi Ishiuchi, Daichi Kato, Géraldine Feraud, Claude Dedonder-Lardeux, Christophe Jouvet, and Masaaki Fujii, Phys. Chem. Chem. Phys., (2017) in press.
- [2] "High-cooling-efficiency cryogenic quadrupole ion trap and UV-UV hole burning spectroscopy of protonated tyrosine", Shun-ichi Ishiuchi, Hiromichi Wako, Daichi Kato, and Masaaki Fujii, J. Mol. Spectrosc., 332, 45-51 (2016).
- [3] "Anharmonic Vibrational Analyses of Pentapeptide Conformations Explored with Enhanced Sampling Simulations", Hiroki Otaki, Kiyoshi Yagi, Shun-ichi Ishiuchi, Masaaki Fujii and Yuji Sugita, J. Chem. Phys. B, 120 (39), 10199-10213 (2016).
- [4] "Photoionization-induced π ↔ H site switching dynamics in phenol+-Rg (Rg = Ar, Kr) dimers probed by picosecond time-resolved infrared spectroscopy", Mitsuhiko Miyazaki, Yuri Sakata, Markus Schütz, Otto Dopfer and Masaaki Fujii, Phys. Chem. Chem. Phys., 18 (35), 24746-24754 (2016).
- [5] "Theoretical Study on the Size Dependence of Ground-State Proton Transfer in 1-Naphthol-Ammonia Clusters", Toshihiko Shimizu, Mitsuhiko Miyazaki and Masaaki Fujii, J. Phys. Chem. A, 120 (36), 7167-7174 (2016).
- [6] "Gas phase ultraviolet and infrared spectroscopy on a partial peptide of β2-adrenoceptor SIVSF-NH2 by a laser desorption supersonic jet technique", Shun-ichi Ishiuchi, Kohei Yamada, Hikari Oba, Hiromichi Wako and Masaaki Fujii, Phys. Chem. Chem. Phys., 18 (33), 23277-23284 (2016).
- [7] "Probing Solvation Dynamics around Aromatic and Biological Molecules at the Single-Molecular Level", Otto Dopfer and Masaaki Fujii, Chemical Reviews, 116(9), 5432-5463 (2016).
- [8] "Electron-Proton Decoupling in Excited State Hydrogen Atom Transfer in the Gas Phase", Mitsuhiko Miyazaki, Ryuhei Ohara, Kota Daigoku, Kenro Hashimoto, Jonathan R. Woodward, Claude Dedonder, Christophe Jouvet and Masaaki Fujii, Angew. Chem/ Int. Ed., 54(50), 15089-15093 (2015).
- [9] "Single Water Solvation Dynamics in the 4-Aminobenzonitrile-Water Cluster Cation Revealed by Picosecond Time-Resolved Infrared Spectroscopy", Mitsuhiko Miyazaki, Takashi Nakamura, Matthias Wohlgemuth, Roland Mitrić, Otto Dopfer and Masaaki Fujii, Phys. Chem. Chem. Phys., 17(44), 29969-29977 (2015).
- [10] "Real time observation of the excimer formation dynamics of a gas phase benzene dimer by picosecond pump-probe spectroscopy", Mitsuhiko Miyazaki and Masaaki Fujii, Phys. Chem. Chem. Phys.s, 17(39), 25989-25997 (2015).
- [11] "Solvation Dynamics of a Single Water Molecule Probed by Infrared Spectra — Theory Meets Experiment", Matthias Wohlgemuth, Mitsuhiko Miyazaki, Martin Weiler, Makoto Sakai, Otto Dopfer, Masaaki Fujii, and Roland Mitric', Angew. Chem. Int. Ed., 53(52), 14601-14604 (2014).
- [12] "Mass Analyzed Threshold Ionization Detected Infrared Spectroscopy: Isomerization Activity of the Phenol-Ar Cluster near the Ionization Threshold", Mitsuhiko Miyazaki, Shunpei Yoshikawa, François Michels, Kentaro Misawa, Shun-ichi Ishiuchi, Makoto Sakai, Otto Dopfer, Klaus Müller-Dethlefs, and Masaaki Fujii, Phys. Chem. Chem. Phys., 17(4), 2949-2503 (2015).
- [13] "Solvent Migration in Microhydrated Aromatic Aggregates:Ionization-Induced Site Switching in the 4-Aminobenzonitrile-Water Cluster", Takashi Nakamura, Matthias Schmies, Alexander Patzer, Mitsuhiko Miyazaki, Shunichi Ishiuchi, Martin Weiler, Otto Dopfer, and Masaaki Fujii, Chem. Euro. J., 20(7), 2031-2039 (2014).
- [14] Revised conformational assignments and conformational evolution of tyrosine by laser desorption supersonic jet laser spectroscopy", Yoko Shimozono, Kohei Yamada, Shun-ichi Ishiuchi, Koichi Tsukiyama, and Masaaki Fujii, Phys. Chem. Chem. Phys., 15(14), 5163-5175 (2013) .
- [15] "Watching Water Migration around a Peptide Bond", Kohei Tanabe, Mitsuhiko Miyazaki, Matthias Schmies, Alexander Patzer, Markus Schütz, Hiroshi Sekiya, Makoto Sakai, Otto Dopfer, and Masaaki Fujii. Angew. Chem. Int. Ed. 51 (27), 6604-6607 (2012).
- [16] "Ionisation-induced site switching dynamics in solvated aromatic clusters: phenol-(rare gas)n clusters as prototypical example", Masaaki Fujii and Otto Dopfer.Int. Rev. Phys. Chem., 31(1), 131-173 (2012).
- [17] "Photoionization-induced large-amplitude pendular motion in phenol(+)-Kr", Mitsuhiko Miyazaki, A. Takeda, Shun-ichi Ishiuchi, Makoto Sakai, Otto Dopfer, and Masaaki Fujii., Phys. Chem. Chem. Phys., 13 (7), 2744-2747 (2011).
- [18] "Conformational reduction of DOPA in the gas phase studied by laser desorption supersonic jet laser spectroscopy", Shun-ichi Ishiuchi, H. Mitsuda, T. Asakawa, Mitsuhiko Miyazaki, and Masaaki Fujii., Phys. Chem. Chem. Phys., 13 (17), 7812-7820 (2011).
- [19] "Gas-Phase Spectroscopy of Synephrine by Laser Desorption Supersonic Jet Technique", Shun-ichi Ishiuchi, T. Asakawa, H. Mitsuda, Mitsuhiko Miyazaki, Shamik Chakraborty, and Masaaki Fujii., J. Phys. Chem. A, 115 (37), 10363-10369 (2011).
- [20] "Evidence for Catechol Ring-Induced Conformational Restriction in Neurotransmitters", Haruhiko Mitsuda, Mitsuhiko Miyazaki, Iben B. Nielsen, Pierre ÇarÇabal, Claude Dedonder, Christophe Jouvet, Shun-ichi Ishiuchi, and Masaaki Fujii., J. Phys. Chem. Lett., 1 (7), 1130-1133 (2010).
教員紹介
藤井正明 教授 博士(理学)
| 1982年 | 東北大学 理学部化学科 卒業 |
|---|---|
| 1985年 | 東北大学 大学院理学研究科 博士後期課程 中退 |
| 1988年 | 学位取得(理学博士) |
| 1985 - 1993年 | 東北大学 理学部 助手 |
|---|---|
| 1993 - 1997年 | 早稲田大学 理工学部 助教授 |
| 1997 - 2003年 | 国立共同研究機構 分子科学研究所 教授 |
| 1999 - 2003年 | 同研究所 分子制御レーザー開発研究センター長 |
| 2003 - 2016年 | 東京工業大学 資源化学研究所 教授 |
| 2004 - 2010年 | JST先端計測分析技術・機器開発事業・機器開発プログラム・チームリーダー |
| 2007 - 2012年 | 特定領域研究「高次系分子科学」領域代表 |
| 2010 - 2015年 | 日本学術振興会 先端研究拠点事業 日本側コーディネーター |
| 2014 - 2016年 | 分子科学会 会長 |
| 2014年より | 公益社団法人日本分光学会 理事 |
| 2016年より | 東京工業大学 科学技術創成研究院 化学生命科学研究所 教授 |
| 1992年 | 日本化学会進歩賞、山下太郎学術奨励賞 |
|---|---|
| 1996年 | 分子科学奨励森野基金 |
| 2007年 | 手島記念論文賞 |
| 2008年 |
市村学術賞貢献賞 Gordon Research Conference on Molecular & Ionic Cluster(MIC2008) 副議長 |
| 2010年 | MIC2010 議長 |
| 2014年 | 日本化学会学術賞 |
| 2015年 | 日本分光学会賞 |
- 所属学会
- 日本化学会、分子科学会、日本分光学会、米国化学会
石内俊一 准教授 博士(理学)
| 1996年 | 早稲田大学 理工学部化学科 卒業 |
|---|---|
| 1998年 | 早稲田大学 大学院理工学研究科 修了 |
| 2001年 | 総合研究大学院大学 数物科学研究科 修了、博士(理学)取得 |
| 1998年 | 日本学術振興会 特別研究員 |
|---|---|
| 2001年 | 慶応義塾大学 理工学部 助手 |
| 2003年 | 科学技術振興機構専任研究員 |
| 2004年 | 東京工業大学 資源化学研究所 助教 |
| 2016年 | 東京工業大学 科学技術創成研究院 特任准教授 |
| 2017年より | 東京工業大学 科学技術創成研究院 化学生命科学研究所 准教授 |
教員からのメッセージ
- 藤井教授より
-
准教授の石内俊一さん、助教の宮崎充彦さんと一緒に研究室を運営しています。私たちは複数のレーザーを使う分光法や新装置を開発して神経伝達物質の分子認識機構解明や溶媒和クラスターでの反応実時間観測に挑んでいます。生命理工の中でも物理寄りの研究室で、物理化学、理論化学が好きな人、装置作りに興味がある人に向いています。測定にマシンタイムがあるので実験の期間は忙しいですが、そのあとはリラックスするメリハリよい研究生活です。外国との共同研究が多いので国際共同研究を体験したい人や、個人的にはテニスが大好きなのでスポーツ好きも歓迎です。「よく遊び、よく学べ」で研究生活を一緒に楽しみましょう。
お問い合わせ先
教授 藤井正明
すずかけ台キャンパス R1棟 312号室
E-mail : mfujii@res.titech.ac.jp
准教授 石内俊一
すずかけ台キャンパス R1棟 310号室・316号室
E-mail : shun@res.titech.ac.jp
※この内容は掲載日時点の情報です。最新の研究内容については研究室サイト![]() をご覧ください。
をご覧ください。