機械系 News
小腸における腸内細菌の流れを調べるデバイスを開発
プロバイオティクスに革命の兆し
要点
- 小腸の動きを再現し、内部の流体の流れを観察できるデバイスを開発。
- 小腸壁が変形する時に発生する、絨毛近傍での流体の動きを観察できることを実証。
- プロバイオティクスの効果的な送達などの研究・開発の発展への寄与に期待。
概要
東京工業大学 工学院 機械系の栗生識大学院生(研究当時。現 東京大学生産技術研究所 助教)と石田忠准教授(ライフエンジニアリングコース 主担当)、同 生命理工学院 生命理工学系の山本直之教授の研究チームは、マウスの小腸組織とアクチュエータ[用語1]を組み合わせたデバイスを開発し、小腸壁が変形する際に発生する流体の流れの様子を動画で撮影した。
哺乳類の健康は腸内微生物[用語2]と密接に関わっている。特に小腸には体内の免疫細胞全体の70%以上が集まる免疫中枢であり、乳酸菌に代表される善玉菌が絨毛[用語3]表面の細胞に取り込まれることで、免疫機能が活性化すると知られている。しかし、小腸には膨大な数の常在腸内微生物が生息しており、それらに覆われた絨毛表面に存在する取り込み細胞[用語4]は、小腸の細胞中1,000万分の1と希少であり、体外から摂取した善玉菌がどのように絨毛表面に辿り着くかは不明である。今回開発した小腸管をアクチュエータで動かすデバイスによって、小腸壁の絨毛付近の液体に流れを発生させ、内容物の動きの直接観察を可能とした。本デバイスの開発により、小腸内で微生物がどのように移動するのかを理解することができる。本デバイスの発展により、効果的なプロバイオティクス[用語5]送達方法や、送達した微生物取り込みによる免疫制御技術などに繋がることが期待できる。
本研究成果は、5月22日付の英国王立化学会発行「Lab on a Chip」オンライン版に掲載され、また掲載号の表紙を飾ることとなった。
背景
哺乳類の小腸には体内の70%以上の免疫細胞が集結しており、その免疫防御機能が注目されている。近年では、乳酸菌やビフィズス菌といった“善玉菌”を利用した食品(ヨーグルトなどの発酵食品が代表的)が開発されており、一般にプロバイオティクスとして認知されている。これらの善玉菌が小腸の免疫を活性化すると、病原菌などの活動を抑制する抗体が体内に放出される。コロナ禍における健康への関心の高まりも相まって、この市場規模は2027年までに9兆円を超えるまでに成長すると予測されている。
一方で、口から摂取した善玉菌が、胃を通って小腸に辿り着き、小腸表面の絨毛にある取り込み細胞まで、どのような経路やメカニズムで流れ着くかは不明であり、これまで研究者にとって未知であった。小腸の免疫活性化は善玉菌が小腸に取り込まれることで開始されるが、この取り込みを行う細胞の数は小腸の上皮細胞中1,000万分の1の割合であり、極めて希少である。さらに小腸内部には絨毛が無数に林立し、消化された食物や水分・粘膜が混ざった上に、膨大な数の常在腸内微生物が生態系を形成している。このような小腸内の極めて複雑な環境下で善玉菌が取り込み細胞に辿り着くまでの流れに関する知見を集めることが、小腸免疫研究の深化に向けて重要であると考えられる。
このような背景の下、これまでに本研究チームは、マウスの小腸組織をトンネル状の流路に加工し、小腸内部を顕微鏡上で観察可能なデバイスを開発した(Kuriu et al., 2021. DOI: 10.3390/mi12060692![]() )。開発したデバイスを用い、腸内微生物と同等の大きさを持つ蛍光性マイクロビーズ[用語6]を流した際の絨毛近傍における流れの観察に成功した。この際、小腸組織の自己融解[用語7]を防ぐために化学固定[用語8]されており、小腸組織が動かない状態、つまり生体内では起こりえない状況でしか流れを観察することができなかった。
)。開発したデバイスを用い、腸内微生物と同等の大きさを持つ蛍光性マイクロビーズ[用語6]を流した際の絨毛近傍における流れの観察に成功した。この際、小腸組織の自己融解[用語7]を防ぐために化学固定[用語8]されており、小腸組織が動かない状態、つまり生体内では起こりえない状況でしか流れを観察することができなかった。
研究成果
今回研究グループは、図1に示すように化学固定した小腸に、空気圧で膨らむ風船のようなバルーンを有するアクチュエータを配置した。バルーンを順番に膨らませる、あるいは萎ませる動きを小腸に与えることで、小腸組織の蠕動運動[用語9]のような腸管運動を模擬するデバイスを開発した。複数のアクチュエータが駆動する時に小腸組織を変形することで、小腸内部の液体に流れを発生させることができる。
開発したデバイスは図2のようになっており、空気圧アクチュエータが小腸組織に実装してあり(図2a)、底面から小腸内部を顕微鏡で観察することができる(図2b、c)。流路内部は絨毛に覆われており、液体導入口付近には腸内微生物を取り込む組織として有名な“パイエル板[用語10]”、液体排出口付近には天井側に大きく窪んだ構造など、人工的には作製できない不均一な構造が確認できる(図2d)。また、小腸組織に実装したアクチュエータは小腸管を塞ぐ程度膨らみ、7時間にわたり精度良く、再現性良く動作することを確認した。
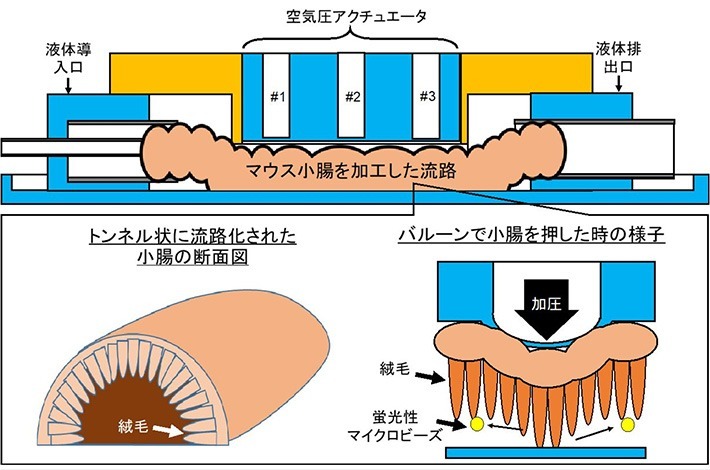
図1. 開発デバイスの概念図

- 図2.開発したデバイス。(a)デバイス側面。黒い点線で囲まれた部分はマウス小腸を加工した流路を変形するための“空気圧アクチュエータ”。(b)デバイス底面。(c)顕微鏡にセットされたデバイス。(d)デバイスに実装した小腸の様子(蛍光顕微鏡写真)。
今回は本デバイスを用いて、#1→#2→#3の順にアクチュエータを膨らませることで小腸組織を変形させ、それにより発生する流れの観察と解析を実践した。その結果、小腸組織の変形に合わせ、蛍光性マイクロビーズが多数の絨毛の間を縫うように移動したり(図3)、旋回する様子(図4)が観察された。絨毛の間を流れるビーズは、絨毛を這うようにゆっくり流れる群(Group1)、絨毛近傍で減速する群(Group2)、速度を落とさず通過する群(Group3)に分類でき、絨毛に辿り着く流れの候補が絞り込めた。小腸では微生物や食物、消化液などがかき混ぜられると言われているが、旋回流はそれに関連する可能性がある。
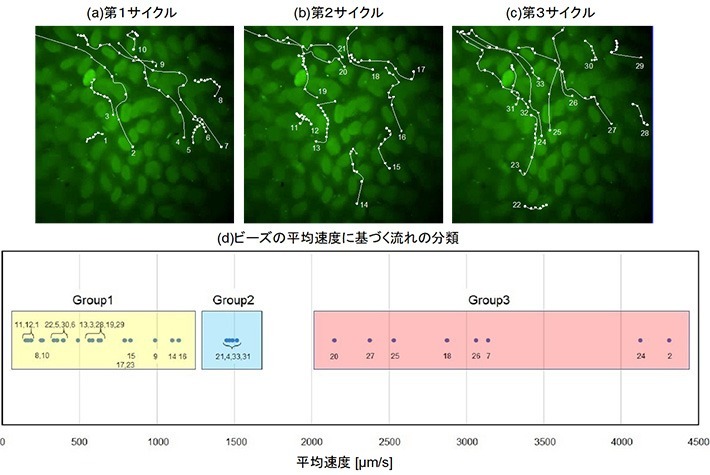
- 図3.絨毛の間の流れ. 小腸壁変形の(a)第1、(b)第2、(c)第3サイクル。 (d)ビーズの平均速度に基づく流れの分類。
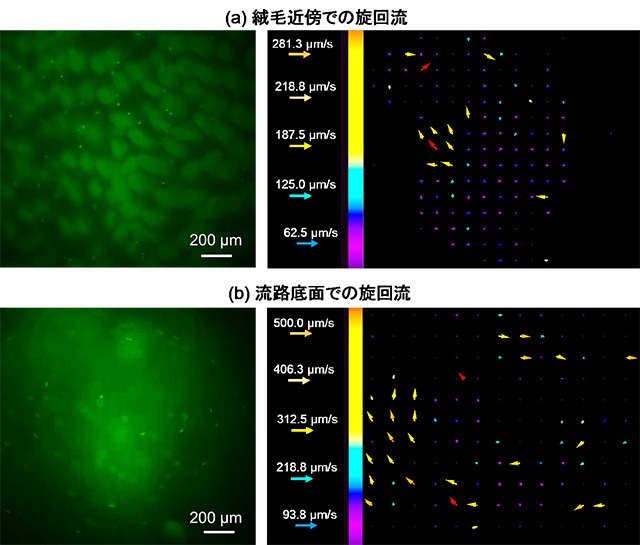
図4. 窪み下で観察された旋回流。(a)絨毛近傍での旋回流。(b)流路底面での旋回流。
社会的インパクト
プロバイオティクスの食品研究では、どのような細菌が絨毛表面の細胞に付着しやすいか、細菌が取り込まれた後にどのような免疫防御機能が活性化するかなどが研究されてきたが、どうすれば効率的に細菌を柔毛表面の細胞に送達できるかという観点での研究は行われてこなかった。本デバイスは、小腸内部に存在する流れをマイクロメートル(100万分の1メートル)レベルで観察可能としており、非常に複雑な流体環境を有する小腸内部を調べることを実現した。これまで謎の多かった“体外から摂取した善玉菌の小腸細胞への到達機構”が直接観察できるようになれば、善玉菌を効率的に柔毛表面の細胞に送達するための条件の解明につながると期待される。さらに、特定した流れをうまく活用することや錠剤の形状を設計することで、高効率なプロバイオティクスや特定免疫防御機能の活性化法の開発実現性が高まると考えられる。
今後の展開
本デバイスは、これまで観察することができなかった小腸内の細菌の流れを観察することを可能とするものであり、今後は、実験で用いる小腸内環境を生体内に近づけていく予定である。例えば、変形モードを生体内の蠕動運動のように設定し、腸内を粘膜と同粘度の人工粘液[用語11]に置換したうえで常在菌を培養し、蛍光ビーズを乳酸菌に置き換えたりすることを考えている。さらには、生命活動を維持した状態での小腸組織のデバイス化などを目指し、実際の小腸内で発生する善玉菌の絨毛表面の細胞への付着までの現象を解明するために研究を進めている。
- 用語説明
[用語1] アクチュエータ : 物を動かす装置。
[用語2] 腸内微生物 : 哺乳類の腸内に常に存在する微生物のこと。特にヒトの腸には100兆個もの微生物が生息している。
[用語3] 絨毛 : 小腸の内側を覆う突起上の構造。この構造によりヒトの場合、小腸の表面はテニスコート一面分に匹敵する。
[用語4] 腸内微生物の取り込み細胞 : 通常の小腸の細胞は、腸内微生物を体内に入れないための壁となっている。しかしその細胞の中には、1,000万分の1の確率で腸内微生物を積極的に取り込むことに特化した細胞が存在する。
[用語5] プロバイオティクス : 十分な量を接種したとき、我々の健康に有益な効果を与える生きた微生物のこと。
[用語6] 蛍光性マイクロビーズ : 光を発して観察しやすいビーズのこと。
[用語7] 小腸組織の自己融解 : 体から切り離された小腸は、自身が分泌する消化液で溶けてしまう。
[用語8] 化学固定 : 小腸が溶けてしまわないよう、薬品で小腸の形を保存すること。ホルマリン固定。
[用語9] 蠕動運動 : 腸が周期的に縮んだり膨らんだりして、腸の中の物を移動させる運動。
[用語10] パイエル板 : 体の免疫細胞が集まった円盤状に膨らんだ構造のこと。
[用語11] 人工粘液 : 腸が分泌するドロドロした液体を人工的に再現したもの。
- 論文情報
| 掲載誌 : | Lab on a Chip |
|---|---|
| 論文タイトル : | Development of a microfluidic device to observe dynamic flow around the villi generated by deformation of small intestinal tissue |
| 著者 : | Satoru Kuriu, Naoyuki Yamamoto and Tadashi Ishida |
| DOI : |
10.1039/D3LC00172E |
- 小俣・石田研究室
- 石田研究室
- 山本研究室
- 【研究室紹介】 山本研究室|生命理工学系 News
- 石田忠 Tadashi Ishida|研究者検索システム 東京工業大学STARサーチ
- 山本直之 Naoyuki Yamamoto|研究者検索システム 東京工業大学STARサーチ
- ライフエンジニアリングコース(大学院課程)|教育|工学院 機械系
- 機械コース(大学院課程)|教育|工学院 機械系
- 機械系(学士課程)|教育|工学院 機械系
- 生命理工学院 生命理工学系
- 東京大学 生産技術研究所
- 研究成果一覧
お問い合わせ先
東京工業大学 工学院 機械系
准教授 石田忠
Email ishida.t.ai@m.titech.ac.jp
東京大学 生産技術研究所
助教 栗生識
Email kuriu@iis.u-tokyo.ac.jp
Tel 080-4431-9846