生命理工学系 News
Gタンパク質共役受容体(GPCR)が複数種のGタンパク質と結合する仕組みを解明
GPCRを標的とした安全で選択性の高い治療薬設計に期待
要点
- 薬物標的となるGPCRの一種であるヒトのアデノシンA2A受容体(A2AR)が複数種のGタンパク質と結合して活性化する仕組みを解明
- A2ARが特定の立体構造を巧妙に制御する長距離情報伝達の詳細なメカニズムを発見
- 計算やAIに基づいたGPCRの活性化メカニズム研究や新世代の創薬を可能にすると期待
概要
東京工業大学 生命理工学院 生命理工学系のTran Phuoc Duy(チャン・フ・ズイ)助教(生命理工学コース 主担当)、萩本紗理大学院生、北尾彰朗教授(生命理工学コース 主担当)、理化学研究所のアドナン・スリオカ研究員、トロント大学のスコット・プロッサー教授らの国際共同研究チームは、実験的・計算科学的手法を用いて、ヒトアデノシンA2A受容体(A2AR)が持つGタンパク質[用語1]の選択性と機能性の土台となる仕組みを明らかにした。
A2ARは、代表的な薬物標的であるGタンパク質共役型受容体(GPCR)の一種であり、Gタンパク質と結合して細胞シグナル伝達を開始し、心臓の健康状態や、炎症・がん・脳疾患に影響を与えている。本研究では、このA2ARがどのようにして複数種のGタンパク質と結合して活性化するのかという、結合混在性[用語2]のメカニズムを解明した。具体的には、活性状態のA2ARの立体構造変化が直接的に結合混在性をもたらすことを発見し、A2ARが動的に取りうるさまざまな立体構造の中で、特定の立体構造を巧妙に制御する長距離情報伝達(いわゆるアロステリー[用語3])の詳細な仕組みも明らかにした。
本研究は、GPCRが持つ選択性とシグナル伝達に関する深い洞察を提供するものであり、得られた知見は、がんや神経変性疾患など、ヒトに影響を及ぼすさまざまな疾患の治療において、GPCRを標的とした新規治療戦略への道を開くものと期待される。また計算やAIに基づいた研究を用いることで、従来の限界を打破するGPCRの活性化メカニズム研究や新世代の創薬を可能にすると期待される。
本研究成果は、7月31日付(現地時間)の「Nature Chemical Biology」に掲載された。
背景
Gタンパク質共役型受容体(GPCR)は、ヒトのさまざまな生理学的側面に影響を及ぼす、多くの種類からなる受容体であり、承認されている医薬品の35%はGPCRに作用する。GPCRは感覚や神経細胞のシグナル伝達を制御し、細胞の恒常性、成長、免疫反応に関連する無数のプロセスを制御している。またGPCRは主に細胞を取り囲む細胞膜に存在している。GPCRに作用する薬物やホルモン・神経伝達物質など(リガンド)が、細胞外側に向いたGPCRのポケットに結合すると、結合するリガンドの種類によってGPCRが活性化または非活性化される。GPCRが活性化されると細胞膜の内側でGPCRがGタンパク質等と複合体を形成し、細胞内でシグナル伝達を開始する。このように、GPCRを標的とした薬剤は細胞内に入ることなく細胞内にシグナルを伝達できるので、GPCRは創薬の標的として有用である。
GPCRの活性化は、リガンドが結合してからGタンパク質が活性化されるまでの間に生じるさまざまな動的なイベントや、取りうる重要な中間状態や活性化状態と関係している。多くのGPCRは、異なる種類のGタンパク質と選択的に相互作用し、それぞれが特有の細胞応答に影響を与える混在性を持っている。Gタンパク質の選択性は、GPCRに関する生物学において最も理解されていない側面の一つである。GPCRの立体構造ダイナミクスとさまざまな機能状態、Gタンパク質の選択性における長距離情報伝達(アロステリー)の役割、結合混在性、活性化とシグナル伝達機構を理解することは難しい課題であり、医薬品開発においてGPCRの挙動を予測し、制御することを困難にしている。
こうしたGPCRのGタンパク質選択性の背後にあるメカニズムを解明するため、国際共同研究チームは今回の研究で、ヒトのアデノシンA2A受容体(A2AR)に焦点を当てた。A2ARは、神経系や血小板、免疫細胞、肺、心臓・血管系に分布するGPCRで、典型的な結合相手であるGsタンパク質に加えて、いくつかの別のGタンパク質(特にGo)と相互作用する(図1)。A2ARに作用する薬は、炎症やがんに加えて、創傷治癒や、アテローム性動脈硬化症、再狭窄、血小板活性化などの血管疾患に対処するために開発されてきた。薬理学的には、薬はA2AR-Gs複合体に対する拮抗薬または作動薬としてのみ作用すると考えられている。したがって、A2ARにおけるGタンパク質の選択性と有効性のメカニズムや活性化のメカニズムを理解することは、薬理学における新たな可能性をもたらす可能性がある。
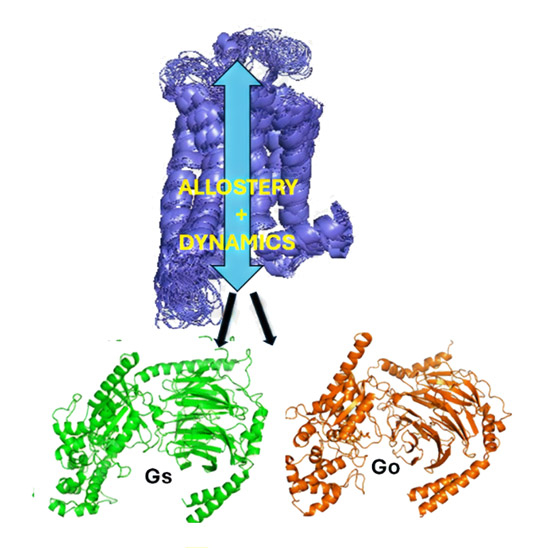
- 図1. アデノシンA2A受容体(A2AR、紫色で示す)のアロステリーとダイナミクスは、Gタンパク質(Gs:緑とGo:オレンジ)の活性化に重要な役割を果たしている。
研究成果
この研究では、機能アッセイ、フッ素19核磁気共鳴法[用語4]、数理剛性理論[用語5]、分子動力学シミュレーション[用語6]やdPaCS-MD/MSM法[用語7]、剛性と形状のモンテカルロ・シミュレーション[用語8]などの実験的・計算的手法を用いて、A2ARのGタンパク質選択性を調べた。具体的には、同じ作動薬を用いて、A2ARをGsおよびGoと複合化させ、A2ARの立体構造状態とダイナミクスを研究した。
まずフッ素19核磁気共鳴法によって、A2ARがGsおよびGoと結合したときに取りうる複数の活性化状態を明らかにした。A2ARがGsと結合すると、受容体は長寿命で高密度な活性化状態を示す。しかし、Goと結合した場合は、活性化構造は著しく減少した。しかも活性化状態の一つは、A2ARがGsと結合したときに主に観察されたが、Goと結合したときには観察されなかった(図2)。
次に、東京工業大学で行われた分子動力学シミュレーション・dPaCS-MD/MSM法から、Gsの方がA2ARとの相互作用が多く、結合親和性も高いことが明らかになった。また、この分子動力学シミュレーションと、理化学研究所で行われたモンテカルロ・シミュレーションから、GsとGoのどちらに結合するかによって、A2ARのダイナミクスが大きく変化することが確認され、長距離情報伝達(アロステリー)が作用しているのではないかという仮説が導かれた。
この仮説について、スリオカ研究員が開発した数理剛性理論を利用した結果、A2ARがGsとGoと結合する際に、それぞれ異なる情報伝達経路が存在することが示された(図3)。このメカニズムによって、異なる機能状態のダイナミクスの違いと状態間の遷移が直接制御されており、Gタンパク質の選択と結合に大きな役割を果たしている。
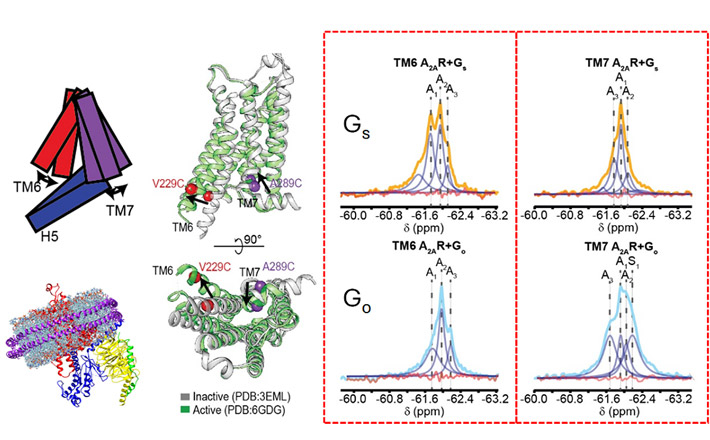
- 図2. フッ素19核磁気共鳴法で得られたスペクトル(赤いボックスの中)で示すように、A2ARがGsと結合した際に見られるTM6部位の2つの活性化状態(左のオレンジ色のピーク)と、Goと結合した際の1つの状態(薄青色のピーク)とTM7部位の主に1つの状態には、ダイナミクスに違いがみられる。
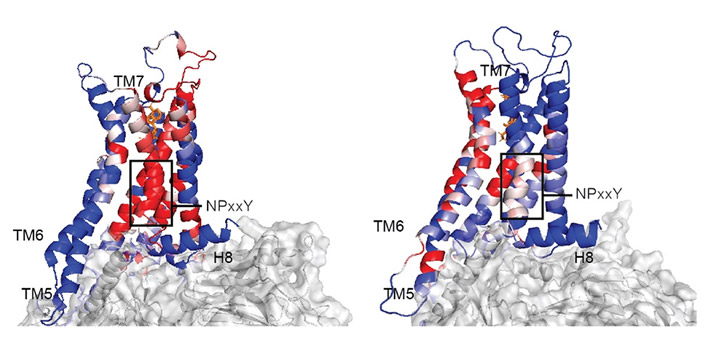
- 図3. モデリングと数理剛性理論で得られた活性化の情報伝達経路(赤)には、A2AR-Gs複合体(左)とA2AR-Go複合体(右)で違いが見られる。
社会的インパクト
GPCRが異なる活性化状態を通じて複数種のタンパク質と結合する能力は、私たちの体の細胞がシグナルを伝達して反応するプロセスの複雑さと可能性を浮き彫りにしており、これをうまく活用すればより良い治療法につながる可能性がある。本研究で得られた知見は、GPCRの選択性、アロステリー、部分作動性、シグナル伝達に関する重要な知見もたらし、創薬に大きな示唆を与えるものである。
今後の展開
今回の研究は、これまで未解明だったA2ARの結合混在性メカニズムを解明したものであったが、今後の研究ではこのメカニズムを他のGPCRへ一般化し、高度なAIモデルを取り入れることに焦点を当てる。また今回の成果は、将来的にGPCRを標的としたより安全で選択性の高い治療薬の設計に役立つものと思われる。今後の研究によって、細胞内シグナル伝達機構の全体的な理解をさらに深めることを目指す。
- 付記
本研究は、以下の事業・研究領域・研究課題などの支援を受けて行われた。
- 科学研究費助成事業(課題番号:JP19K23721、JP23K14154、JP19H03191、JP22H04745、JP23H02445、JP23H02445)
- 本研究の一部は、文部科学省「富岳」成果創出加速プログラム「富岳で目指すシミュレーション・AI駆動型次世代医療・創薬」(JPMXP1020230120) の一環として実施されたものである。また、本研究の一部は、スーパーコンピュータ「富岳」[用語9]の計算資源の提供を受け、実施した(課題番号:hp230077、hp230216、hp240024)。
- これ以外にも、本研究の計算においては、北尾研究室のPCクラスターに加え、東京工業大学TSUBAME3.0、東京大学物性研究所のスーパーコンピュータ(課題番号:2023-Ca-0019)、自然科学研究機構計算科学研究センターのスーパーコンピュータ(課題番号:23-IMS- C045)の計算資源の提供を受けた。
- 用語説明
[用語1] Gタンパク質 : 細胞内の情報伝達に関わるタンパク質で、GPCRやGTP・GDP等と結合することで活性化・非活性化される。Gタンパク質にはさまざまな種類があり、その種類によって結合しやすいGPCRの種類が異なる。
[用語2] 結合混在性 : この場合は、GPCRが異なる複数のタイプのGタンパク質と結合することを意味し、英語ではcoupling promiscuityと言う。
[用語3] アロステリー : タンパク質へのある分子の結合が、結合部位から離れたタンパク質の別の部位に影響を与えること。この場合は、GPCRのGタンパク質結合部位に変化をもたらしている。
[用語4] フッ素19核磁気共鳴法 : 注目する部位に結合させたフッ素19(安定同位体)から生じる核スピンの共鳴現象の信号を磁場の中で測定し、分子構造や物性を測定する手法。
[用語5] 数理剛性理論 : 例えば、二次元平面において□の形に組まれた枠組みは、力を加えて変形させることができるが、もう一本加えて〼にすると変形できない剛体になる。このような性質を数理的に解析する理論を数理剛性理論という。
[用語6] 分子動力学シミュレーション : 対象とするシステムを原子の集合体としてコンピュータ上でモデル化し、運動方程式を数値的に解くことで、原子の位置や速度の時間的変化を計算するシミュレーション法。
[用語7] dPaCS-MD/MSM法 : dPaCS-MD(解離型並列カスケード選択分子動力学)とMSM(マルコフ状態モデル)を組み合わせた計算法。dPaCS-MDでは、多数の独立な分子動力学を並列で短時間実行し、より解離状態に近い構造を複数選択し、それらを出発構造として分子動力学を再実行するサイクルを繰り返すことで、実時間より数桁短いシミュレーション時間で複合体の解離現象を観察できる。一方MSMでは、多数の分子動力学で得られた結果を統合して状態の確率や自由エネルギーを計算できる。これらを組み合わせたdPaCS-MD/MSM法では、分子複合体の結合親和性(結合自由エネルギー、解離速度定数など)を高精度に予測できる。
[用語8] モンテカルロ・シミュレーション : 乱数を用いて行うシミュレーション法。本研究では、数理剛性理論と立体構造に基づいて、タンパク質複合体が取りうる多数の立体構造のサンプリングを行った。
[用語9] スーパーコンピュータ「富岳」 : スーパーコンピュータ「京」の後継機。2020年代に、社会的・科学的課題の解決で日本の成長に貢献し、世界をリードする成果を生み出すことを目的とし、電力性能、計算性能、ユーザーの利便性・使い勝手の良さ、画期的な成果創出、ビッグデータやAIの加速機能の総合力において世界最高レベルのスーパーコンピュータとして2021年3月に共用を開始した。
- 論文情報
| 掲載誌 : | Nature Chemical Biology |
|---|---|
| 論文タイトル : | Balancing G Protein Selectivity and Efficacy in the Adenosine A2A Receptor |
| 著者 : | Louis-Philippe Picard, Alexander Orazietti, Duy Phuoc Tran, Andrejs Tucs, Sari Hagimoto, Zhenzhou Qi, Shuya Kate Huang, Koji Tsuda, Akio Kitao, Adnan Sljoka, R. Scott Prosser |
| DOI : | 10.1038/s41589-024-01682-6 |
- 「並行世界でタイムリープを繰り返す」ことで効率的なシミュレーションを可能にするソフトウエアツールを開発・公開|生命理工学系 News
- がん抑制タンパク質がDNAから解離する過程を可視化|生命理工学系 News
- 新型コロナウイルスの新薬開発につながる候補化合物を発見|生命理工学系 News
- Gタンパク質共役受容体活性化の鍵となる仕組みを解明|生命理工学系 News
- 北尾彰朗 Akio Kitao|研究者検索システム 東京工業大学STARサーチ
- チャン・フ・ズイ Tran Phuoc Duy|研究者検索システム 東京工業大学STARサーチ
- 北尾研究室
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
教授 北尾彰朗
Email akitao@bio.titech.ac.jp
Tel 03-5734-3373 / Fax 03-5734-3372