生命理工学系 News
マクロファージに着目した乳がんの増殖・転移抑制法を開発
難治性がんの術後再発・転移を防ぐ新規治療法確立を推進
要点
- 乳房組織に常在するマクロファージが、乳がん細胞の増殖を助けていることを発見。
- 乳腺組織のマクロファージを枯渇・阻害することで、乳がんの増殖や再発・転移が抑制されることを実証。
- 組織に常在するマクロファージ阻害は乳がん以外の組織・臓器のがんの再発・転移抑制にも有効である可能性があり、難治性がん治療の推進に期待。
概要
東京工業大学 生命理工学院 生命理工学系の近藤科江教授(ライフエンジニアリングコース主担当)らの研究チームは、難治性で悪性度の高いトリプルネガティブ乳がん(TNBC)[用語1]において、乳腺に常在するマクロファージを枯渇・阻害することで、がん細胞の再発・転移を抑制できることを見いだした。
TNBCは、特異的な治療標的がなく、がん細胞の性質も極めて不均一で、有効な治療法が限られているため、他の乳がんサブタイプに比べて生存率が低い。近藤教授らは、乳がんに共通した治療標的として、組織常在性マクロファージ[用語2]に注目し、乳腺マクロファージの腫瘍への侵入を阻害剤で抑制すると、腫瘍の増殖が著しく抑制されることを見いだした。さらに、マウス乳がん再発モデルを用いて、乳がん切除後に切除部位の乳腺のマクロファージを阻害することで、再発と遠隔転移を顕著に抑制できることを示した。
本研究成果は、再発のリスクを減らすために全乳房を摘出する手術を選択することが多い難治性の乳がんにおいて、乳房温存療法[用語3]への選択を容易にすることにつながる知見を提供している。また、各組織に存在する組織特異的なマクロファージが、がんの発生に寄与していることを強く示唆しており、それらのマクロファージを特異的に攻撃する細胞標的治療法[用語4]が確立できれば、現在有効な治療法のない難治性がんの治療に新たな道を開くことが期待できる。
本研究成果は、2月3日付の「Communications Biology」にオンライン掲載された。
背景
乳がんは、2020年時点で女性のがん罹患率、死亡率ともに世界1位となっている。中でもトリプルネガティブ乳がん(TNBC)は、他の乳がんサブタイプと比較して術後の早期再発とその後の遠隔転移の頻度が高く、予後が最も悪い。また、TNBC細胞は性質が極めて不均一で、治療標的となる特異的な分子が存在しないため、薬剤を使った治療でTNBC細胞を死滅させることが難しく、再発や転移を防ぐためには乳房全体を摘出する全摘手術が推奨される状況にある。その他の治療法として乳房温存療法があり、乳房温存療法を施した患者は、乳房全摘手術後に再建手術を受けた患者と比較して、より良好な社会心理的・性的健康を得られるというメリットがある。乳がん患者のQuality of life(QOL)の観点から乳房温存療法が確立されることが望ましいが、再発・転移リスクが無視できないため、乳房温存療法を推進する有効な治療法の開発が求められている。
研究成果
多様なマクロファージがある中で、近藤教授らは乳腺組織に常在するマクロファージが乳がん細胞の増殖の初期段階を手助けしていることを見いだし、がん細胞には作用しないマクロファージ阻害薬(CL)を用いて、乳腺に常在するマクロファージを死滅させたところ、TNBC増殖が顕著に抑制された。この実験結果をもとに、TNBCの術後再発および転移に対するマクロファージ阻害の影響を検討した。具体的には、まずマウスの乳房にTNBC細胞を移植後、腫瘍の大きさが1 cmに達したとき、その95%を切除し、乳がんの再発モデルとした。そのモデル(各治療群8匹)を用いてTNBCの増殖および他の臓器の転移におけるマクロファージ阻害の効果を検討したところ、マクロファージ阻害によって、TNBCの増殖および肺や肝臓への遠隔転移が顕著に抑えられることがわかった。さらに、汎用されている抗癌剤と併用して、マクロファージとがん細胞を同時に攻撃したところ、さらなる抑制効果が観察された(図1)。
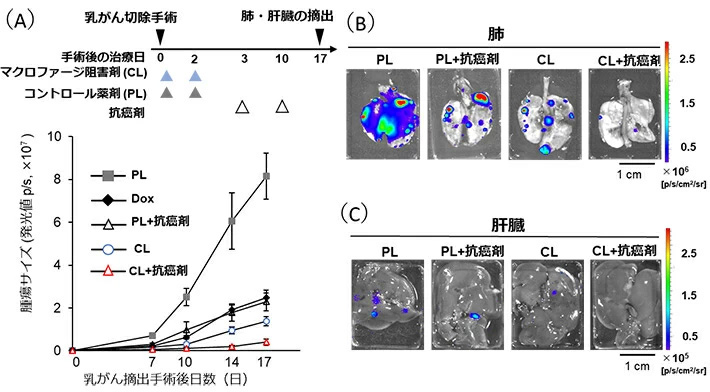
図1.乳腺常在マクロファージ阻害によるTNBC術後再発・転移抑制
(A)乳がん腫瘍摘出後の再発腫瘍の大きさの変化(使用したマウス:各治療群8匹) (B, C)腫瘍摘出手術後17日目
の肺および肝臓における転移TNBC細胞の分布(着色されている箇所が転移したTNBC細胞)
これらの結果より、「乳腺に常在するマクロファージが腫瘍の増殖や悪性化の手助けをすること」と「TNBC腫瘍の摘出手術時にマクロファージを阻害することで、抗がん剤の再発治療効果が大幅に増強されること」を見いだした。
社会的インパクト
本研究で見いだされた、マクロファージ阻害によるTNBCの再発および転移抑制手法を確立することができれば、乳房全体を切除することなく、悪性腫瘍のみの除去にとどめた治療が可能となることが期待される。現在、有効な治療法がなく、再発やそれに伴う遠隔転移による死亡リスクが高いTNBCに対し、より効果的に再発を抑制する治療法の開発を推進する研究成果である。また、乳房温存療法を選択しやすくする治療法の確立に大きく貢献し、乳がん患者のQOLの改善につながることが期待される。
また本研究は、がん細胞自体を攻撃するのではなく、がん細胞の増殖を助ける組織特異的な組織常在性マクロファージを標的にする治療法を提案している点に新規性がある。乳房以外の組織にも常在マクロファージが存在しているため、マクロファージ阻害の悪性腫瘍増殖抑制効果は他の臓器・組織のがん治療・予防にも役立つと考えられる。すなわち、現在有効な治療法がない他の臓器のがんにおいても、同様のアプローチで抗癌剤の治療効果を高める可能性があり、難治性がんの治療法に新たな道を開くことが期待される。
今後の展開
本研究で用いたマクロファージ阻害剤は、組織特異性はなく汎用性のマクロファージ阻害剤である。一方で、マクロファージには多くのサブタイプがあり、中には抗腫瘍機能を持った有用なマクロファージもある。今後の研究で、腫瘍増殖を助けるマクロファージのサブタイプを特定し、そのマクロファージにのみ働く特異的な阻害剤を開発することで、より効果が高く、副作用のない治療薬の創製が期待できる。
- 付記
本研究は、高松宮妃癌研究基金、上原記念生命科学財団、ノバルティス科学振興財団、文部科学省/JST 光・量子飛躍フラッグシッププログラム(Q-LEAP)JPMXS0120330644 の支援を受けて実施された。
- 用語説明
[用語1] トリプルネガティブ乳がん(TNBC) : 乳がんの治療標的となる3つの受容体が免疫組織化学染色評価で陰性の乳がんサブタイプで、乳がんの約20%を占めている。TNBCは、がん細胞の不均一性が高く、悪性度も他のサブタイプより高い。特異的な治療薬はなく、治療抵抗性も高いことが知られている。
[用語2] 組織常在性マクロファージ : マクロファージは免疫細胞の一種であり、血中や各組織に存在する多様な細胞集団。組織常在性マクロファージは、組織の機能や恒常性の維持、病原体の攻撃・処理を行う。
[用語3] 乳房温存療法 : 乳房温存手術と術後の放射線療法、そして全身的な補助療法(化学療法・ホルモン療法)からなり、乳房内でのがん再発率を高めることなく、美容的にも満足できる乳房を残すことを目的とする治療法。
[用語4] 細胞標的治療法 : 分子標的治療法に対応した造語。分子標的治療が、特定の分子を標的にして、その分子のシグナル伝達や結合機能などを抑制するのに対し、ここでの細胞標的治療は、特定の細胞の特徴を利用して攻撃し、死滅させることを目的とする治療法。
- 論文情報
| 掲載誌 : | Communications Biology |
|---|---|
| 論文タイトル : | Tissue-resident macrophages are major tumor-associated macrophage resources, contributing to early TNBC development, recurrence, and metastases |
| 著者 : | Ryuichiro Hirano, Koki Okamoto, Miyu Shinke, Marika Sato, Shigeaki Watanabe, Hitomi Watanabe, Gen Kondoh, Tetsuya Kadonosono, Shinae Kizaka-Kondoh |
| DOI : |
- 簡便、確実、短時間に骨転移モデルマウスを構築|生命理工学系 News
- 悪性化したがん細胞をその場で可視化—近赤外発光分子で高感度かつ迅速ながん検出手法を開発—|生命理工学系 News
- 体の深部を探る世界初の近赤外発光基質を開発—生体発光イメージングの感度を飛躍的に高め、創薬研究の推進に貢献—|生命理工学系 News
- 飽くなき探究心でがん治療の新境地に挑む―近藤科江教授|生命理工学系 News
- 【研究室紹介】 近藤研究室|生命理工学系 News
- 近藤研究室
- 近藤 科江 Shinae Kondoh|研究者検索システム 東京工業大学STARサーチ
- 生命理工学院 生命理工学系
- 研究成果一覧