生命理工学系 News
魚類が「ホウ酸」を体外に排出して 海水に適応するメカニズムを解明
持続可能な海水魚の養殖等への応用を期待
要点
- 海水魚が飲み込んだ海水に含まれるホウ酸は腸で吸収され、腎臓で尿中に濃縮・排出されることを発見。ホウ酸は過剰摂取・蓄積により毒性を示す。
- 動物の体内で働く起電性のホウ酸輸送体「Slc4a11A」を同定し、ホウ酸排出の分子メカニズムを明らかに。
- 海洋生物の環境適応機構の解明や、持続可能な海水魚の養殖等への応用に寄与することを期待。
概要
東京工業大学 生命理工学院 生命理工学系の加藤明准教授(生命理工学コース主担当)、メイヨー医科大学(米国)のマイケル・F・ロメロ教授、東京大学 農学生命科学研究科の藤原徹教授、株式会社海遊館ニフレル事業部の土井啓行博士らの研究グループは、海産真骨魚(以下、海水魚)がホウ酸を尿中に濃縮して排出すること、また、腎臓に発現する膜輸送体[用語1]「Solute carrier family 4 member 11A(Slc4a11A)」がホウ酸の排出に対して重要な役割を果たすことを明らかにした。
海水にはホウ酸が含まれ、ホウ酸は体内に蓄積すると毒性を示す。海水魚は、海水中の様々な塩分を積極的に排出することで、海水環境に順応することが知られているが、ホウ酸排出の機構は謎のままであった。本研究では、海水と淡水で飼育したフグの血液と尿のホウ酸濃度を測定し、比較したところ、海水飼育フグの尿中には淡水飼育フグより約1,000倍ものホウ酸が存在していることを見出した。また、海水飼育時に腎臓で発現量が上昇する膜輸送体「Slc4a11A」が、ホウ酸を濃度勾配に逆らって輸送することができる起電性ホウ酸輸送体であることを電気生理学[用語2]的手法によって明らかにした。この成果は、海水魚が尿を介してホウ酸を排出する際の体内メカニズムと経路を明らかにするもので、今後、海洋生物の環境適応機構の解明への寄与や、持続可能な海水魚の養殖等への応用が期待される。
本研究成果は、2022年11月23日に米国の生化学・分子生物学の専門誌「Journal of Biological Chemistry」にオンライン掲載された。
背景
ホウ素は様々な生物にとって有益な微量元素である。例えば高等植物において細胞壁の重要な構成成分であり、脊椎動物においては、ゼブラフィッシュやアフリカツメガエルの胚発生に寄与するとされる。また、哺乳類の骨の成長や維持、ホルモン機能などに対しても有益な役割を果たすことが分かっているが、その一方で、ホウ酸の過剰摂取は、動物にも植物にも毒性を示すことが知られている。しかし、これらの作用メカニズムは、まだ謎のままである。
海水中で生活している海水魚は、海水に対して約3分の1の体液浸透圧を維持している。また、脱水や塩分の過剰摂取を避けるため、大量の海水を飲み、腸で水分と塩分を吸収し、余分な塩分をエラ塩類細胞や腎臓から排出することにより、水電解質バランスを保っている。これまでの研究から、エラ塩類細胞が塩化物イオン、ナトリウムイオン、カリウムイオンを排出し、腎臓が硫酸イオン、マグネシウムイオンを排出することが明らかになっている。そして、海水は約0.4 mMのホウ酸を含む。海水魚は海水を毎日大量に飲み、ホウ酸の大量摂取は毒性を示すことから、海水魚は何らかの形でホウ酸を排出する必要があるが、その経路について研究された事例はなかった。
研究成果
本研究で使用した天然海水は、450 μMのホウ酸を含んでいた。海水飼育したメフグの腸内液のホウ酸濃度は150 μMであり、海水のホウ酸濃度より著しく低いことから、メフグはホウ酸を腸から吸収していることが明らかになった。また、海水飼育したメフグの血中ホウ酸濃度は60 μMであったことに対し、尿は19,000 μMものホウ酸を含んでいた。これらのことから、海水飼育したメフグの尿は、海水に対して40倍、血液に対して約300倍ものホウ酸を含むことが示された(図1)。一方、淡水飼育したメフグの尿は20 μMのホウ酸を含んでいた。従って、海水飼育したフグの尿は淡水飼育したフグの尿に比べて、約1,000倍ものホウ酸を有することが明らかになった。
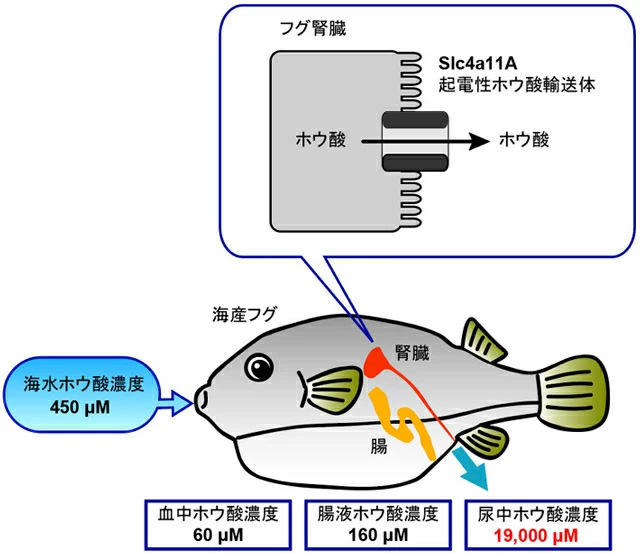
図1海水魚によるホウ酸排出機構。海水魚腎臓に発現するSlc4a11Aが起電性ホウ酸輸送体として機能し、尿中にホウ酸を濃縮して排出する。
ホウ酸を高濃度に含む尿を産生するには、腎臓の細胞がホウ酸を濃度勾配に逆らって尿中に分泌するメカニズムが必要になる。本研究グループは、海水と淡水で飼育したメフグ腎臓における網羅的な発現解析の過程で、海水飼育時に発現量が上昇する遺伝子の中にSlc4a11A遺伝子が存在することを見出していた。Slc4a11Aが属するSlc4ファミリーには、陰イオン交換輸送体やナトリウム重炭酸共輸送体が含まれる。2002年、藤原らの研究グループが植物から初めてホウ素輸送体Bor-1を同定したが、植物のBor-1と動物のSlc4ファミリーとの間にはアミノ酸配列の相同性が存在する。そこでSlc4a11Aがホウ酸輸送体として機能するかどうかを確認するために、本研究グループはSlc4a11Aをアフリカツメガエル卵母細胞に発現させ、電気生理学的な手法により活性を測定した(図2)。Slc4a11Aを発現させた卵母細胞の膜電位を固定した状態で微小pH電極を細胞に刺入し、培地中にホウ酸を添加した。これにより、pHの上昇と外向き電流が観察され、また、解析に用いた卵母細胞を誘導結合プラズマ質量分析法(ICP-MS)により解析したところ、細胞内ホウ素の有意な上昇が観察された。これらの結果は、Slc4a11Aが起電性のホウ酸輸送体であることを示している。一方、Slc4a11Aがどのような輸送体であるかについては、B(OH)4- 輸送体、B(OH)3-OH-共輸送体、B(OH)3/H+交換輸送体のどれかであると考えられる。
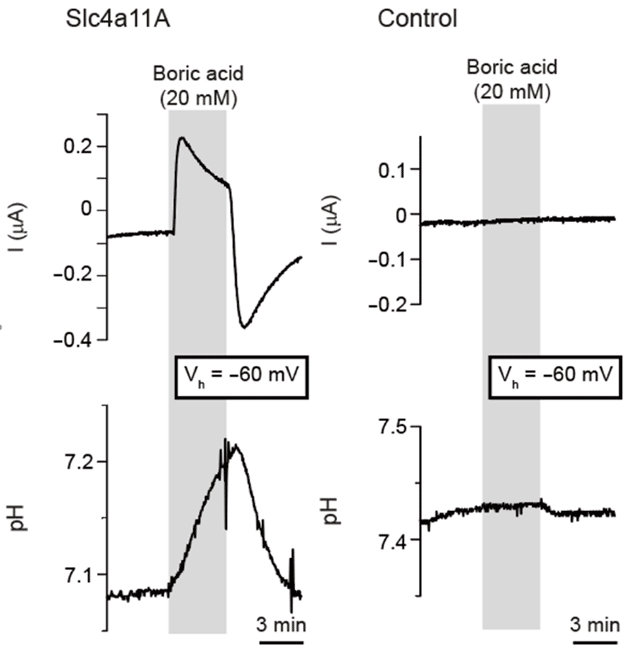
図2アフリカツメガエル卵母細胞に発現させたメフグSlc4a11Aの活性測定。Slc4a11Aが起電性のホウ酸輸送体であることが明らかになった。Slc4a11Aを発現させた卵母細胞の培地にホウ酸を添加すると、外向き膜電流と細胞内pHの上昇を観察した。また培地からホウ酸を除くと内向きの膜電流とpHの下降を観察した。これらの結果はSlc4a11Aが、ホウ酸に応答する起電性の輸送体であることを示している。
Slc4a11Aの発現部位をRT-PCR、in situ hybridization、蛍光免疫組織染色により解析したところ、Slc4a11Aは近位尿細管と集合管[用語3]の頂端膜(管腔側の細胞膜)に局在することが分かった(図3)。海水魚の尿のpHは5.7–6.6程度の酸性であることが知られている。本研究により、Slc4a11Aの活性と局在から、Slc4a11Aが集合管細胞において、細胞内外のpH勾配と電位差を駆動力に、ホウ酸を尿中に能動輸送しうることが明らかになった。
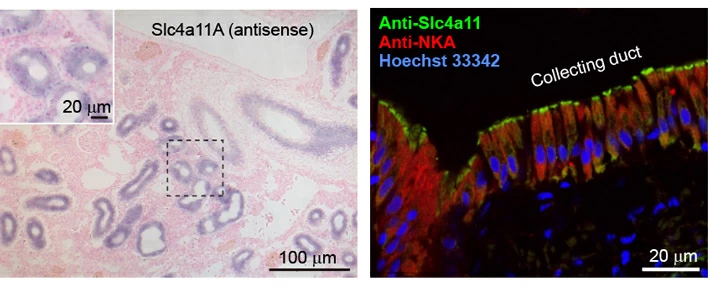
図3メフグ腎臓におけるSlc4a11Aの発現部位。(左)in situ hybridization法によるメフグ腎臓組織切片におけるSlc4a11Aの発現部位の解析。(右)蛍光免疫法によるメフグ腎臓組織切片におけるSlc4a11Aの発現部位の解析。
社会的インパクト
本研究は、魚類の海水適応におけるホウ酸排出の重要性を初めて示し、その排出経路と分子メカニズムを解明する新たな発見である。また動物の遺伝子に由来する起電性ホウ酸輸送体の活性を測定した初めての報告としても重要である。この結研究果は、魚類の海水適応機構の解明に寄与し、海洋生物の多様な生存戦略の理解や生物多様性の保全に繋がることが期待される。
また、本研究成果は、持続可能な海水魚の養殖等への応用が期待される。
今後の展開
Slc4a11遺伝子はヒトにも存在し、Slc4a11遺伝子変異はフックス角膜内皮ジストロフィーなどの原因になることが知られている。2004年にヒトSlc4a11はナトリウムホウ酸共輸送体であるという論文が発表されたが、追試に成功したグループはなく、2013~2016年には、ヒトやマウスのSlc4a11にはホウ酸を輸送する活性がないことが世界の4つの独立した研究グループにより示されている。本研究により、フグのSlc4a11Aの起電性ホウ酸輸送活性が示されたことから、Slc4a11の活性は哺乳動物と魚類の間で異なることが示された。脊椎動物の進化の過程で、哺乳動物のSlc4a11がホウ酸輸送活性を喪失したのか、魚類のSlc4a11Aがホウ酸輸送活性を獲得したのか、今後の解析により明らかになることが期待される。
- 付記
本研究は、文部科学省科学研究費助成事業(22370029、25650114、26292113、17H03870、21H02281)等の助成を受けて行われた。
- 用語説明
[用語1] 膜輸送体 : 細胞膜や細胞内膜系など生体膜に存在するタンパク質で、生体膜をイオンや低分子有機化合物などが通過するときの経路となる。受動拡散を促進するものや、濃度勾配に逆らった輸送(能動輸送)を担うものなどが含まれ、ヒトゲノム中には1,200遺伝子存在する。
[用語2] 電気生理学 : 生体膜が電解質を輸送するときに発生する電流や電位差を微小電極により検出して生理現象を解析する手法。様々なイオン濃度を検出する性質をもつ微小電極を細胞に刺し、細胞内のイオン濃度やその変化を直接測定する方法なども含まれる。
[用語3] 近位尿細管、集合管 : 腎臓において、尿はろ過、分泌、再吸収により形成される。分泌と再吸収は尿細管と呼ばれる管状の組織により行われる。近位尿細管は、尿細管の最上流に位置し、ろ過されたばかりの原尿から栄養素を再吸収する役割を担う。集合管は尿細管の最下流に位置し、最終的な尿の成分を決める役割を担う。
- 論文情報
| 掲載誌 : | The Journal of Biological Chemistry |
|---|---|
| 論文タイトル : | Seawater fish use an electrogenic boric acid transporter, Slc4a11A, for boric acid excretion by the kidney |
| 著者 : | Akira Kato, Yuuri Kimura, Yukihiro Kurita, Min-Hwang Chang, Koji Kasai, Toru Fujiwara, Taku Hirata, Hiroyuki Doi, Shigehisa Hirose, and Michael F. Romero |
| DOI : |
- 魚が淡水中のわずかな栄養素を取り込む機構を解明|東工大ニュース
- 【研究室紹介】 加藤研究室|生命理工学系 News
- 加藤研究室
- 加藤明 Akira Kato|研究者検索システム 東京工業大学STARサーチ
- 生命理工学院 生命理工学系
- メイヨー医科大学
- 東京大学
- 海遊館
- 研究成果一覧
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
准教授 加藤明
E-mail : akirkato@bio.titech.ac.jp
TEL:045-924-5794 FAX:045-924-5310