生命理工学系 News
哺乳類の胎盤獲得に至る分子進化プロセスの一端を解明
進化学の発展や、妊娠時の異常診断・治療への応用にも期待
要点
- 胎盤形成を制御するタンパク質NRKの哺乳類祖先における大規模かつ急速な分子進化を発見
- 分子進化により獲得した配列を介してNRKが胎盤細胞の増殖を抑制する分子機構を解明
- 胎盤細胞の増殖制御メカニズムの解明により、胎盤形成異常が胎児に与える影響などの診断や治療法確立にも期待
概要
東京工業大学 生命理工学院 生命理工学系のベニ・レスタリ(Beni Lestari)大学院生、内藤聡美大学院生、同 科学技術創成研究院 細胞制御工学研究センターの福嶋俊明助教(生命理工学コース主担当)らの研究グループは、タンパク質リン酸化酵素(プロテインキナーゼ)の一種であるNIK-related kinase(NRK)[用語1]が哺乳類の祖先で大規模かつ急速な分子進化を受け、胎盤形成に重要な役割を果たすようになったことを突き止めた。
本研究グループのこれまでの研究で、胎盤に特異的に発現するNRKが胎盤の過形成を防ぐことがわかっていた。今回の研究では、哺乳類の出現以前から存在していたNRKの機能が、鳥類から哺乳類への進化の過程で大規模かつ急速に変化したことを示す証拠を見つけた。この分子進化によって獲得した複数の配列を利用して、NRKが細胞増殖を促すタンパク質の働きを抑えることで、胎盤の発達を制御していることも、本研究によって明らかとなった。この結果は、胎盤形成と関わりのなかった祖先型NRKが分子進化によって新規機能を獲得し、胎盤形成の制御に転用されたことを示している。
本研究成果は英国の科学誌「Molecular Biology and Evolution」に2月24日(現地時間)に掲載された。
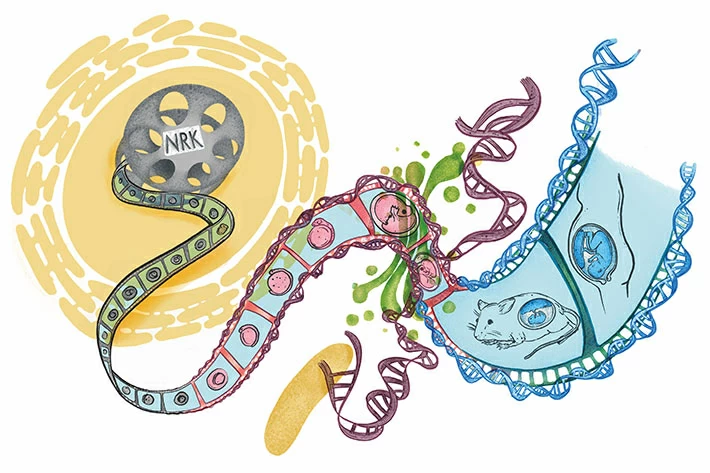
図. NRKの分子進化をモチーフにしたアートワーク
進化の各段階でのNRKの働きを、映画のフィルムの一コマ一コマに描いた。フレームがDNAの二重らせん構造になっているフィルムの右端には、マウスやヒトの胎盤の発達が描かれている。赤いフレームから青いフレームへの変化は、NRKの発現に寄与する遺伝子(Nrk遺伝子)のDNA配列が鳥類から哺乳類になる直前に大きく変化したことをイメージしている。論文著者のコンセプトをもとに、イラストレーターであるフェリペ・セラーノ氏が作成した。
背景
胎生は、母親が体内の胚に継続的に栄養を与えて十分に成長させてから出産する生殖戦略である。卵生と比較して、胎児の生存率を高めることができる。真獣類[用語2]の胎盤は、胎児に栄養を供給する代表的な組織であり、進化的に新しく獲得されたものである。
「胎盤はどのようにして獲得されたのだろうか?」という問いには未だ謎が残されており、多くの進化生物学者の興味を惹きつけてきたテーマである。さらに、胎盤獲得の背景にある分子進化を解明することは、胎盤発達を制御する分子の働きの理解につながり、医療への応用にも期待が持たれる。例えば、ヒトでは胎盤の肥大化が胎児の健康状態に悪影響を及ぼすことが知られている。具体的には、胎盤肥大が胎児の発育不良や死亡とよく相関しており、胎児が成人した後の高血圧・心血管疾患・糖尿病のリスクも高めることがわかっている。胎盤肥大の発症率が、高齢出産の増加に伴い増加しているという社会的背景もある。そのため、胎盤に関わる分子機能の進化に関する研究は、胎盤の形成異常によって起こる胎児発育遅延などの妊娠合併症の診断・治療法の開発にも役立つと考えられる。
研究の経緯
2011年、本研究グループの一人である伝田博士は、プロテインキナーゼの一種であるNIK-related kinase(NRK)がマウスの胎盤に特異的に発現しており、胎盤の過形成を防ぐ役割を果たすことを突き止めた(図1)。
2017年には森岡裕香博士(現 神戸大学准教授)らのグループが、NRKが細胞増殖の促進に関わるタンパク質AKT[用語3]の機能を抑える効果を持つことを明らかとした。しかし、NRKがAKTの機能を減弱させる詳細な分子機構は不明なままであった。
そこで2017〜2021年において進められた本研究では、NRKが胎盤過形成を防ぐメカニズムの解明を試みるとともに、NRKの分子進化についても解析した。
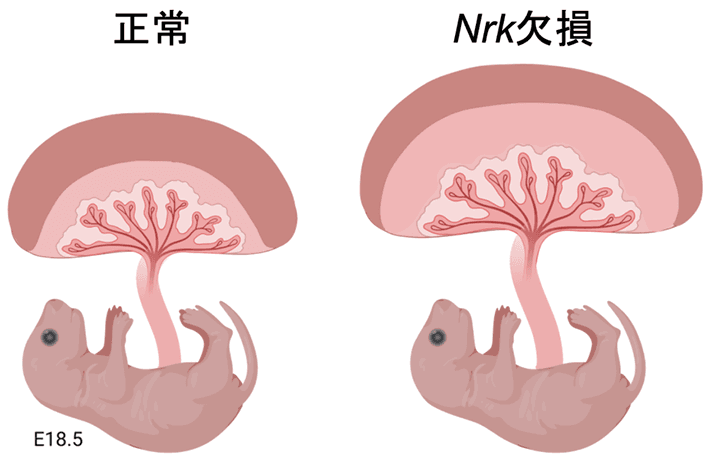
図1. 正常なマウスとNrk欠損マウスの胎盤と胎仔
Nrk欠損マウスでは、胎盤が通常の約2倍の重量となり、分娩も困難となる。NRKが胎盤の過形成を抑制する働きをもつことがわかる。
研究成果
本研究は、タンパク質解析に長けた研究者から、分子進化や進化学を専門とする研究者まで、幅広い分野の専門家が関わり進められた。
NRKの細胞増殖抑制メカニズムの解明
はじめに、タンパク質大規模解析技術(プロテオミクス)の専門家である遠藤研究員が、さまざまなタンパク質とマウスのNRKとの結合のしやすさを網羅的に調べ、プロテインキナーゼの一種であるcasein kinase-2(CK2)がNRKと相互作用を持つことを見いだした。
次に、マウスNRKのどの部位がCK2と相互作用するのかを調べるため、内藤氏と福嶋助教が、アミノ酸配列を部分的に欠いたNRKの変異体を多数作製して生化学的な解析を行った。その結果、NRKの分子中央の短いアミノ酸配列がCK2に結合してCK2の酵素活性を阻害することを明らかとした。そして、このアミノ酸配列領域をCK2-inhibitory region(CIR)と命名した。
また、Beni氏はマウスNRKのCNHドメインにリン脂質と結合する性質を見つけ、これによってNRKが細胞膜付近に局在する(集まりやすい)ことを示した。Beni氏、内藤氏、福嶋助教の3人が中心となってさらに詳細な解析を行い、マウスのNRKは細胞膜付近でCK2を阻害し、図2に示すような一連のしくみを介して細胞増殖を制御していることを初めて明らかにした。
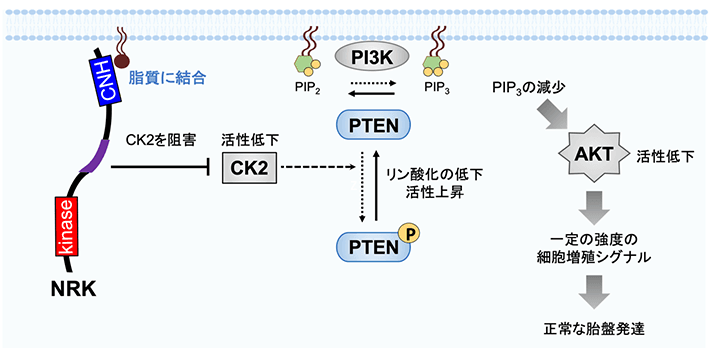
図2 NRKが細胞増殖シグナルを抑制する分子機構
NRKはCNHドメインを介して細胞膜の脂質に結合し、CIRを介してその付近のCK2を阻害する。すると、CK2がPTENというタンパク質をリン酸化できなくなり、PTENの活性が上昇する。PTENはホスファチジルイノシトール三リン酸(PIP3)という細胞膜に含まれる脂質を脱リン酸化する。 こうしてPIP3が減少するとAKTの活性が低下し、細胞増殖シグナルが一定の強度に保たれ、胎盤の過形成が防がれる。
真獣類への進化におけるNRK機能の変異過程の解明
本研究グループの一人で比較生理学を専門とする加藤博士は、脊椎動物のNRK発現に寄与する遺伝子(Nrk遺伝子)の配列を比較し、哺乳類の配列が魚類や鳥類と比べて著しく異なっていることに気がついた。そこで、分子進化研究に詳しい西原博士をグループに迎えて解析を進めたところ、鳥類から有袋類・単孔類への進化、さらに真獣類への進化過程において、Nrk遺伝子に驚くほど多数の変異が短期間に生じており、NRKタンパク質に数多くのアミノ酸の挿入や置換が起きていることを明らかにした(図3)。重要なことに、激しい配列変化が生じた部位を調べると、CIRやCNHドメインというマウスNRKの機能に関わる重要な部位と重なっていた。
さらに、動物の形態進化を研究している田中幹子教授(東京工業大学)の協力によりニワトリのNrk遺伝子を単離し、マウスとニワトリのNRKの機能を比較したところ、予想通り、ニワトリのNRKにはCIRがなく、CNHドメインは存在するが脂質結合能をもってないことが実験的に証明された。
NRKは真獣類の出現以前から存在していた動物でも発現していた酵素であり、もともと胎盤形成に特化したものではなかった。本研究の結果から、そのNRKが真獣類の祖先で大規模かつ急速な分子進化を遂げ、機能的なCIRやCNHドメインを獲得して細胞増殖抑制能を持つようになり、胎盤形成の制御に転用されるようになったと考えられる。
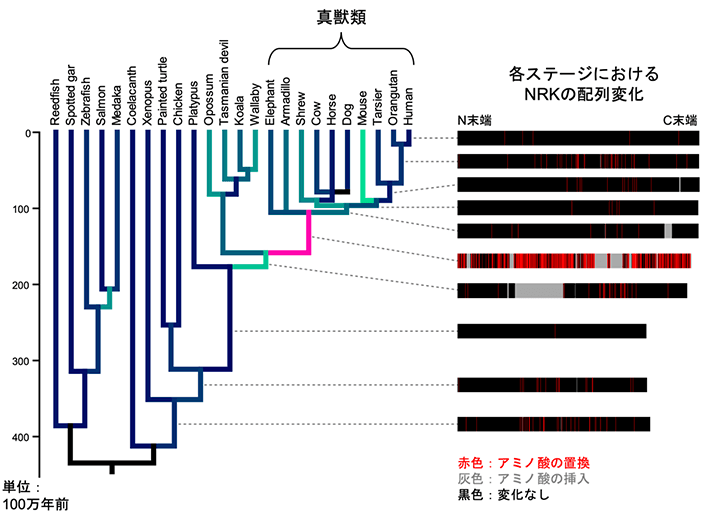
図2. NRKが細胞増殖シグナルを抑制する分子機構
脊椎動物の進化系統樹(左)とその各ステージにおけるNRKの配列変化(右)。真獣類の祖先の時期を、系統樹上でピンクで示している。その時期に、NRKの配列に多数のアミノ酸置換/挿入が起きていたことがわかる。
今後の展開
今回、NRKがマウスの胎盤の過形成を抑制するメカニズムと、その背景にある分子進化が明らかとなった。今後、胎盤の進化におけるNRKの関与をより深く理解するために、マウス以外の生物のNRKの発現部位や機能を調べることは大切である。特に、哺乳類の胎盤と進化上の起源が同じとされる爬虫類や鳥類の絨毛膜や、有袋類の原始的な胎盤などでNRKが果たす役割を明らかにするのは興味深い。
さらに、ヒトの胎盤異常とNRKの関係を調べることは医学上の重要課題であり、NRKやその下流経路の異常が、胎盤肥大とそれに関わる健康問題の原因となっているかを検討することで、妊娠・出産に関する現代の課題の解決を目指すことも必要と考えられる。
- 用語説明
[用語1] NIK-related kinase(NRK) : NIKと呼ばれる別のプロテインキナーゼと似た構造をもつプロテインキナーゼで、脊椎動物の細胞内に発現しているが、その機能は十分にはわかっていなかった。マウスでは胎盤に特異的に発現しており、胎盤の過形成を防ぐ役割を果たす。
[用語2] 真獣類 : 単孔類(カモノハシやハリモグラ)と有袋類(カンガルーやコアラなど)以外の哺乳類の総称。発達した胎盤をもち、有胎盤類とも呼ばれる。真獣類の胎盤は進化的に新しく、絨毛膜に由来し、その形態は種によって大きく異なる。母体と胎児の間の栄養とガスの交換を仲介し、内分泌組織として妊娠を調節し、母体の免疫系を抑制する役割も担っている。なお、単孔類は卵生であり、有袋類は原始的な胎盤しかもたず育児嚢を使って未熟な新生仔を育てる。
[用語3] AKT : 細胞内に存在するセリン/スレオニンキナーゼの一種で、広範な細胞種に発現している。他の様々なタンパク質をリン酸化してその機能を変化させ、結果として細胞増殖を促進したり細胞死を抑制することがよく知られている。AKTが過剰に活性化すると、組織の過形成や腫瘍化の原因になる。
- 論文情報
| 掲載誌 : | Molecular Biology and Evolution |
|---|---|
| 論文タイトル : | Placental mammals acquired functional sequences in NRK for regulating the CK2–PTEN–AKT pathway and placental cell proliferation |
| 著者 : | Beni Lestari、内藤聡美、遠藤彬則、西原秀典、加藤明、渡邊恵理香、伝田公紀、駒田雅之、福嶋俊明 |
| DOI : |
- 難治性疾患クッシング病の発症分子機構の一部を解明|生命理工系 News
- 細胞のコラーゲン分泌機構の一部を解明|生命理工系 News
- ストレス顆粒の消失促す脱ユビキチン化酵素を発見|生命理工系 News
- 駒田研究室
- 福嶋俊明 Toshiaki Fukushima|研究者検索システム 東京工業大学STARサーチ
- 科学技術創成研究院 細胞制御工学研究センター
- 科学技術創成研究院(IIR)
- 生命理工学院 生命理工学系
- 研究成果一覧