生命理工学系 News
がんの光温熱療法に適した金ナノ粒子を、ペプチドを用いて簡便に合成
常温・常圧で、環境負荷を抑えながら、生体適合性の高い三角金ナノプレートを合成
要点
- ペプチドと金イオンを混ぜるだけで、がんの光温熱療法に適した金ナノ粒子である三角金ナノプレートの合成に成功
- ペプチドの濃度と配列の改変で、三角金ナノプレートのサイズや円形度を調整
- 合成された金ナノ粒子は優れた生体適合性を持ち、近赤外光を照射することで発熱してがん細胞を死滅させる
概要
東京工業大学 物質理工学院 応用化学系の田中祐圭助教、大河内美奈教授、大学院生の林美伶、桐木友花、同大学 科学技術創成研究院 化学生命科学研究所の野本貴大助教(ライフエンジニアリングコース主担当)、西山伸宏教授(ライフエンジニアリングコース主担当)、生命理工学院 生命理工学系の門之園哲哉助教(ライフエンジニアリングコース主担当)との異分野融合共同研究グループは、英国Leeds大学、韓国Chung-Ang大学との国際共同研究を通じて、金イオンと特定のペプチド[用語1]を混ぜるだけで、がん光温熱療法[用語2]に適した形状の金ナノ粒子[用語3]である三角金ナノプレートを合成できる新しい方法を開発した。
金をナノメートル(10億分の1メートル)単位まで小さくした金ナノ粒子は、その安定性の高さと毒性の低さによって、医療分野で高い注目を集めている。ただし実用化にあたっては、その安全性を高め、十分な効果を引き出すため、目的に応じて粒子の形やサイズを最適化する必要性があった。
三角形をした薄いプレート状の金ナノ粒子である三角金ナノプレートは、生体を透過しやすい近赤外光[用語4]を吸収することによって発熱の効果が得られるため、患部以外の生体部分へ余分な負担を掛けることなく、がんの光温熱療法へ利用できる可能性が高いと期待を寄せられている。しかし、三角金ナノプレートの合成は従来、細胞毒性の高い界面活性剤や還元剤を用いて行われていたため、そのままでは生体に用いることは難しく、生体毒性のない原料による粒子合成技術の開発が求められていた。
本研究グループでは、これまで「ASHQWAWKWE(A:アラニン、S:セリン、H:ヒスチジン、Q:グルタミン、W:トリプトファン、K:リジン、E:グルタミン酸)」というアミノ酸配列[用語5]をもったペプチドを用いて、高温・高圧環境での操作や細胞毒性の強い反応剤を必要とせずに、同ペプチドと金イオンを室温で混合するだけで金ナノ粒子が合成できる手法を開発している。
今回は粒子合成を行う際、このASHQWAWKWEのアミノ酸配列をもつペプチドの濃度を変更するだけで粒子サイズを制御し、さらにこのアミノ酸配列の一部を置換することによって、円形度の調整も施した三角金ナノプレートを合成した。合成によって得られた粒子は生体適合性が非常に高く、近赤外光を照射することでがん細胞を死滅させることができた。
室温で中性に近いpHという環境のもと、混ぜるだけで三角金ナノプレートを合成できる本研究は、環境調和型の機能性金ナノ粒子合成技術として、バイオメディカル分野においてさまざまな形での応用が期待される。
この研究成果は6月15日付で、生体材料科学の国際誌「ACTA Biomaterialia」に掲載された。

本研究成果のイメージ図
背景
金属や半導体などのナノ粒子は、それぞれ独自の有用な特性を持ち、工業用素材や触媒などとして幅広い分野で活用されている。特に金ナノ粒子は、優れた安定性や生体適合性から多くの分野で注目されており、バイオメディカル分野からの関心も高い。
その応用可能性の一つとして期待を集めているのが、金ナノ粒子に近赤外光を照射し、粒子上に発生した熱によってがん細胞を死滅させるがんの光温熱療法である。金ナノ粒子の物性はサイズ、形状によって変化するため、これまでにさまざまな形状の金ナノ粒子が合成されており、なかでも棒状の金ナノロッド、とげ状の構造をもつ金ナノスター、そして平らなプレート状の金ナノプレートなどが近赤外光を吸収する材料として知られている。
ただし、このような形態に制御された金ナノ粒子の合成は、一般的に、細胞毒性の高いヘキサデシルトリメチルアンモニウムクロリド(Hexadecyltrimethylammonium chloride/CTAC)などの界面活性剤や、水素化ホウ素ナトリウム(NaBH4)などの強い還元剤を使用し、高温・高圧で行われているため実際の利用は難しく、人体に影響の少ない原料によって、より環境に負荷のかからない条件で行える粒子合成技術の開発が求められていた。
本研究グループではこれまでに、ASHQWAWKWEのアミノ酸配列を持つ「B3」と呼ばれるペプチドを発見し、金イオンと混ぜることによって、細胞毒性の高い界面活性剤や強い還元剤などを使わず、高温・高圧での操作も必要とせずに、室温・常圧、中性溶液中で金ナノ粒子を製造する方法を開発している(Tanaka M. et al., Nanoscale Adv., 48(8):978-981(2019), Tanaka M. et al., Acta Biomater., 49:495-506(2017))。今回はこのB3ペプチドを用いて、近赤外光を吸収し、金ナノロッドや金ナノスターより細胞への取り込み活性が高いとされる三角金ナノプレートの合成条件を検討した。
研究の手法と成果
本研究では、B3ペプチドと金イオンの混和によって合成される金ナノ粒子が、どのような条件のもとで三角金ナノプレートの形状を取るのかを明らかにするため、(1)使用するB3ペプチドの濃度をさまざまに変えながら金イオンと混和し、各濃度のペプチドによって合成された金ナノ粒子の形状を調べ、三角金ナノプレートの形成に適したペプチドの濃度を確認した。さらに、(2)詳細な形状制御の条件を明らかにするため、B3ペプチドのアミノ酸配列の一部を置換した改変ペプチドを使い、三角金ナノプレートの形態、特に円形度の変化を確認した。
また、合成された三角金ナノプレートのがん光温熱療法への応用を見据え、(3)ペプチドを使って合成された三角金ナノプレートについての生体適合性の評価と、(4)光温熱療法を試みた場合のがん細胞に対する効果の評価を実施した。
その結果、ペプチド濃度0.14~0.30 mM[用語6]の範囲で合成することで三角金ナノプレートが合成できることと、B3ペプチドのアミノ酸配列(ASHQWAWKWE)の3番目に位置するヒスチジンが三角金ナノプレートの円形度の調整に大きな役割を果たしていることが示された。あわせて、B3ペプチドによって合成される金ナノ粒子が優れた生体適合性を示し、近赤外光の照射によってがんを死滅させることも確認され、がん細胞の光温熱療法に利用できる三角金ナノプレートを、ペプチドと金イオンを室温かつ中性に近いpHで混和するだけで合成できることが確認された。
研究内容の詳細
(1)異なる濃度のペプチドを用いた、三角金ナノプレートの合成条件の検討
まずはB3ペプチド(アミノ酸配列:ASHQWAWKWE)の濃度をさまざまに変えながら金イオンと混和し、近赤外光を吸収する三角金ナノプレートの合成に適したペプチドの濃度を検討した。
具体的には、pH7.4のトリス緩衝生理食塩水(Tris-buffered saline)に溶解させる形で、金の化合物である四塩化金酸(HAuCl4)0.5 mMと、それぞれ濃度を変えたB3ペプチドを室温で混和し、静置することで金ナノ粒子を合成した。
合成された粒子について、紫外可視分光(UV-Vis)スペクトルと透過型電子顕微鏡観察による評価を行ったところ、540 nm近傍の光を吸収する正十面体と、650 nm以上の近赤外光を吸収する三角ナノプレートの2種類が合成されることが示された。それぞれの粒子は、結晶の格子中における結晶面を示すミラー指数で表記すると主に{111}面[用語7]を有することから、このB3ペプチドはこの{111}面という結晶面をもつ粒子の形態制御に寄与することが示唆された。さらに、ペプチド濃度0.18~0.30 mMの範囲で合成することにより、ペプチド濃度を薄くするにつれて粒径が大きく、さらに吸収する波長がより長い三角金ナノプレートを合成できることが示された(図1、表1)。
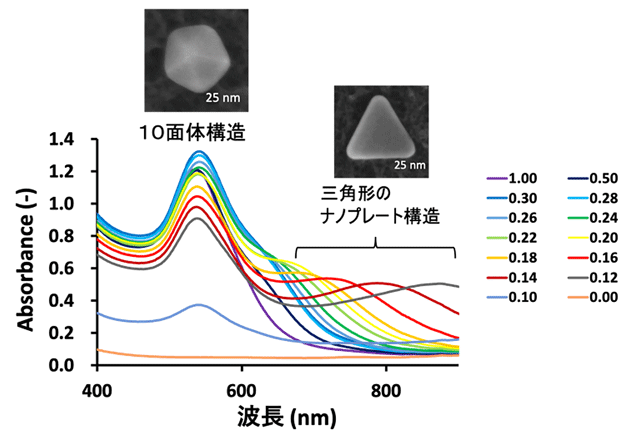
図1. 異なるペプチド濃度(0~1.00 mM)で合成された金ナノ粒子の紫外可視分光(UV-Vis)スペクトル
表1. 異なるペプチド濃度で合成された金ナノ粒子の粒径分布
| ペプチド濃度(mM) | 0.14 | 0.18 | 0.22 | 0.26 | 0.30 | |
|---|---|---|---|---|---|---|
| フェレー径 (nm) |
正十面体 | 32 ± 13 | 41 ± 7 | 32 ± 6 | 29 ± 6 | 24 ± 4 |
| 三角ナノプレート | 60 ± 42 (22%)* |
67 ± 27 (24%) |
52 ± 21 (21%) |
46 ± 17 (17%) |
37 ± 12 (12%) |
|
*溶液中に見られる全粒子における三角金ナノプレートの割合
(2)アミノ酸配列の一部を置換した、改変ペプチドによる粒子合成の検討
次に、B3ペプチド(アミノ酸配列:ASHQWAWKWE/A:アラニン、S:セリン、H:ヒスチジン、Q:グルタミン、W:トリプトファン、K:リジン、E:グルタミン酸)を構成する10連のアミノ酸のうち、どの部分が形状制御への影響が大きいのかを確認するため、アミノ酸の一部を置換した改変ペプチドによる粒子合成を検討した。
まずB3ペプチドのうち、金属イオンと結合することが知られる3番目にあるヒスチジン(H)、塩基性アミノ酸である8番目のリジン(K)、酸性アミノ酸である10番目のグルタミン酸(E)に着目し、これらのアミノ酸を、それぞれ中性アミノ酸であるアラニン(A)に置換した改変ペプチド3種(H3A、 K8A、 E10A)を用いて金ナノ粒子を合成した。
その結果、合成された粒子が示す紫外可視分光(UV-Vis)スペクトルの結果から、3番目のヒスチジン(H)を置換したH3Aと、8番目のリジン(K)を置換したK8Aで合成した粒子が、オリジナルのB3ペプチドで合成した粒子とは異なるスペクトルを示すことが示された(図2)。そのため、この3番目のヒスチジンと8番目のリジンが金ナノ粒子の形態制御に重要であることが示唆された。一方で、リジン(K)を置換したK8Aにより合成された粒子は分散性が著しく低下したため、評価が困難であり応用に向けても不利であると判断されたことから、ヒスチジン(H)を置換したH3Aペプチドについてより詳細に検討を進めた。
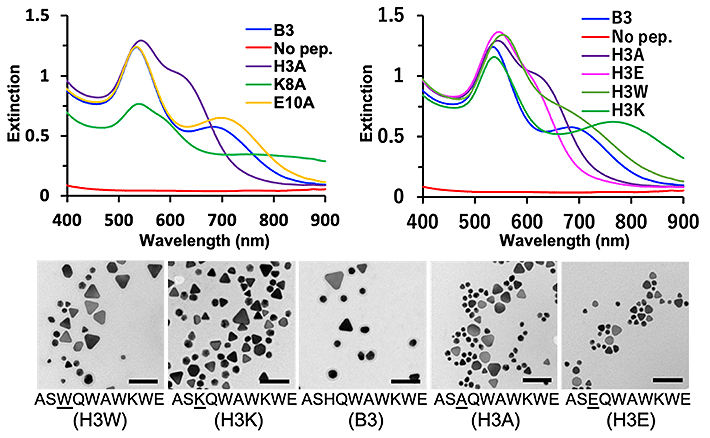
- 図2.B3改変ペプチドにより合成された金ナノ粒子の紫外可視分光(UV-Vis)スペクトルと透過型電子顕微鏡による画像(Scale bar:100 nm)
先の改変では、B3ペプチド(アミノ酸配列:ASHQWAWKWE)の3番目にあるヒスチジン(H)をアラニン(A)に変更したが、今度はヒスチジンが重要な役割を果たしているかについて、より入念な検討を行うため、このヒスチジン(H)を、酸性アミノ酸であるグルタミン酸(E)、芳香族アミノ酸であるトリプトファン(W)、塩基性アミノ酸であるリジン(K)に改変した3通りのペプチド(H3E、 H3W、 H3K)を用意して金ナノ粒子を合成した。その結果、各改変ペプチドによって合成された粒子はそれぞれ異なる紫外可視分光(UV-Vis)スペクトルを示すことが確認された。そこで、透過型電子顕微鏡を用いて、合成された粒子の画像を観察したところ、非常に興味深いことに、改変されたペプチドの配列の違いによって、合成される三角金ナノプレートの「円形度」が変化することが確認された(図2、表2)。以上より、B3ペプチドの3番目に位置するヒスチジンが、このペプチドにより合成される三角金ナノプレートの「円形度」の制御に重要な役割を果たしていることが示された。
表2.B3改変ペプチドにより合成された三角金ナノプレートの円形度と粒子径分布
| ペプチド* | ASWQWAWKWE (H3W) |
ASKQWAWKWE (H3K) |
ASHQWAWKWE (B3) |
ASAQWAWKWE (H3A) |
ASEQWAWKWE (H3E) |
|---|---|---|---|---|---|
| 円形度 | 0.82 ± 0.05 | 0.82 ± 0.05 | 0.83 ± 0.05 | 0.86 ± 0.04 | 0.88 ± 0.03 |
| フェレー径(nm) | 39 ± 15 | 34 ± 15 | 41 ± 15 | 30 ± 7 | 25 ± 6 |
*もとのB3ペプチドから改変されたアミノ酸はアンダーラインで表記
(3)ペプチドを使って合成された、三角金ナノプレートの生体適合性の評価
次に、B3ペプチドによって合成される三角金ナノプレートの生体適合性を評価するため、合成された三角金ナノプレートを含む金ナノ粒子とヒト皮膚線維芽(NHDF)細胞株を混合し、24時間後の生細胞の割合を確認した。対照として、一般的な金ナノ粒子の合成に用いられる界面活性剤である、ヘキサデシルトリメチルアンモニウムクロリド(CTAC)によって被覆された金ナノロッドとヒト皮膚線維芽を混合した場合の生細胞の割合もあわせて確認した。
その結果、B3ペプチドによって合成された金ナノ粒子では、80 μg/ml(金元素濃度)を混合した場合においてもほぼすべての細胞が生育していたのに対して、一般に広く研究が進められているCTAC被覆ナノロッドでは10 μg/mlの混合でも、ほぼすべての細胞が死滅することが確認された(図3)。以上の結果より、B3によって合成される三角金ナノプレートが優れた生体適合性を示すことが確認された。
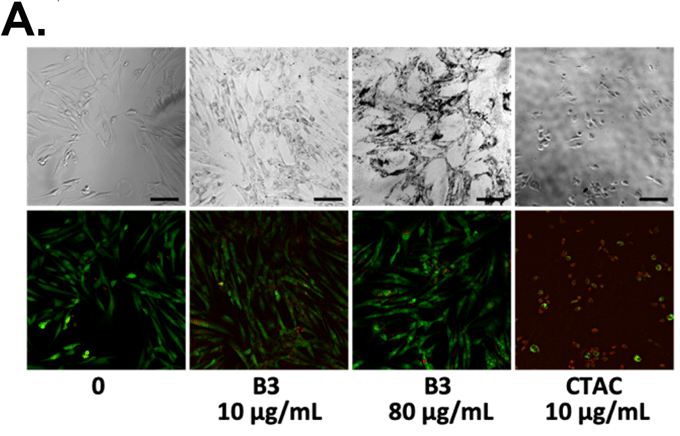
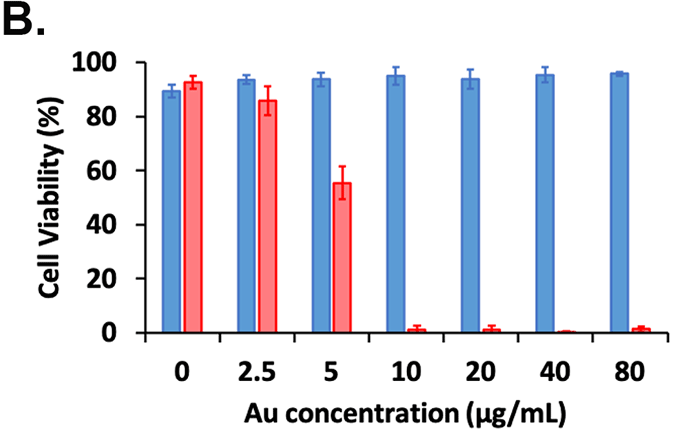
図3. B3により合成された異なる濃度の金ナノ粒子による生体適合性評価
A. の上パネルは位相差画像、下パネルは蛍光顕微鏡画像(緑:Calcein-AMで染色した生細胞、赤:Propidium iodideで染色した死細胞)(Scale bar:100 μm)、B. は蛍光顕微鏡画像により計数された生細胞の割合。対照実験としてCTACで被覆された金ナノロッドを使用(赤いバーで表記)。
(4)光温熱療法を試みた場合のがん細胞に対する効果の評価
最後に、B3ペプチドによって合成された三角金ナノプレートを用い、がん細胞に対する近赤外光照射による光温熱療法の評価を実施した。合成された三角金ナノプレートをヒト子宮頸がん(Hela)細胞株を培養した培養液に添加し、近赤外光を1.8 W/cm2で5分間照射した。その結果、三角金ナノプレートを加えたサンプルでのみ細胞が死滅することが確認された(図4)。これによりB3ペプチドにより合成される三角金ナノプレートが、がん細胞の光温熱療法に利用できる可能性が示唆された。
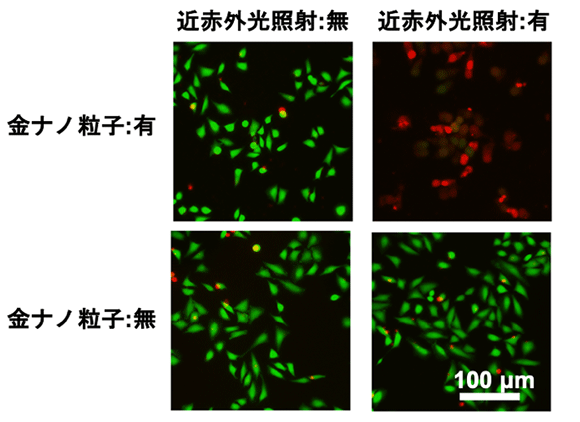
図4. B3により合成された三角金ナノプレートによるHela細胞株に対する光温熱療法の評価
左は近赤外光の照射無し、右は照射有り、上は三角金ナノプレートあり、下は三角金ナノプレートなし。緑:Calcein-AMで染色した生細胞、赤:Propidium iodideで染色した死細胞。
今後の展開
本研究により、がん細胞の光温熱療法に利用できる三角金ナノプレートを室温、中性に近いpHという条件において、生体分子であるペプチドと金イオンを混和するだけで合成できることが確認された。この環境調和型の合成法で得られる粒子は生体適合性が高いことが示されたことから、バイオメディカル分野での利用が広く期待される。今後は、ペプチドにより合成される金ナノ粒子の形態制御機構の詳細な研究を進めることによって、さらに多様な形態の粒子が合成可能となり、また、目的の形態やサイズの金ナノ粒子の合成効率も向上できるものと予測している。これらにより、バイオメディカル分野を含め、さまざまな用途に応じて、最適な形状と特性をもった金ナノ粒子を、環境に負荷のかからない条件で合成できる技術の確立を目指していく。
- 付記
本研究は、日本学術振興会(JSPS)科学研究費助成事業(課題番号18K04848、18H01795、18K18970、21H01725、21H01726)、公益法人池谷科学技術振興財団、日本学術振興会二国間交流事業(共同研究)、東京工業大学挑戦的研究賞、東京工業大学異分野融合支援などを受けて実施した。
- 用語説明
[用語1]ペプチド : 2個以上のアミノ酸が、ペプチド結合を行うことによってできた化合物。タンパク質は、多数のアミノ酸が結合したポリペプチド。
[用語2]がん光温熱療法 : 高熱に弱いがん細胞の性質を利用してがん細胞を叩く温熱療法のうち、金などのナノ粒子に近赤外光を照射して、光のエネルギーを吸収した粒子上に熱を発生させることでがん細胞を死滅させる療法。
[用語3]ナノ粒子 : 金属や半導体などの物質が、1メートルの10億分の1であるナノメートルレベルにまで微少になった粒子。物質をナノサイズまで小さくすると、溶融温度・焼成温度が大幅に低下する、触媒粒子の効率が上がるなど、サイズの大きな粒子で存在していたもとの物質とは異なった物理的、化学的特性を示すようになる。そのため有効な特性をもった高機能素材として、電子デバイス、エネルギーデバイス、薬品、セラミックス、化粧品といった製品の材料や各種触媒など幅広い場面で活用されている。
[用語4]近赤外光 : 近赤外線のこと。0.7~1000マイクロメートルの波長を持つ赤外線のうち、0.7~20マイクロメートル程度の短い波長のものをいう。物質中の原子やイオンの動きとの関わりが深い。近赤外域はヘモグロビンなどの有色タンパク質と水の吸収バンドに挟まれた波長域であり、近赤外光は生体組織に対する光透過性が可視光に比べて高いため、光温熱療法、光線力学療法に加え、バイオイメージングといった光を使った治療や診断に用いるのに好ましいとされている。
[用語5]アミノ酸配列 : ペプチドやタンパク質を構成している、アミノ酸の配列順序。この順序の違いによって、さまざまに異なる機能が発現する。
[用語6]M : 溶液の濃度を示す単位で、溶液1リットル中に溶けている溶質の物質量(モル数)を指す。代わりに「mol/l」という単位も用いられる。mMは1/1000 M。
[用語7]{111}面 : 結晶の格子中における結晶面や方向を記述する方法として、ミラー指数と呼ばれる表記法がある。金ナノ粒子において、正十面体表面は全て {111} であり、三角ナノプレートにおけるエッジの部分とは異なる上下に広がる表面も {111} である。
| 掲載誌 : | ACTA Biomaterialia |
|---|---|
| 論文タイトル : | Synthesis of near-infrared absorbing triangular Au nanoplates using biomineralisation peptides |
| 著者 : | Masayoshi Tanaka*, Mirei Hayashi, Lucien Roach, Yuka Kiriki, Tetsuya Kadonosono, Takahiro Nomoto, Nobuhiro Nishiyama, Jonghoon Choi, Kevin Critchley, Stephen D. Evans, and Mina Okochi* |
| DOI : |
- 生体膜の曲面構造を認識するタンパク質の網羅的な探索技術を開発|東工大ニュース
- 異分野融合研究支援 2019年度 3チームを支援|生命理工学系 News
- 2019年度「東工大挑戦的研究賞」授賞式-独創性豊かな若手研究者10名を表彰-|生命理工学系 News
- 大河内研究室
- 研究者詳細情報(STAR Search) - 田中祐圭 Masayoshi Tanaka
- 研究者詳細情報(STAR Search) - 大河内美奈 Mina Okochi
- 研究者詳細情報(STAR Search) - 野本貴大 Takahiro Nomoto
- 研究者詳細情報(STAR Search) - 西山伸宏 Nobuhiro Nishiyama
- 研究者詳細情報(STAR Search) - 門之園哲哉 Tetsuya Kadonosono
- 物質理工学院 応用化学系
- 科学技術創成研究院 化学生命科学研究所
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 物質理工学院 応用化学系
助教 田中祐圭
E-mail : tanaka.m.bn@m.titech.ac.jp
東京工業大学 物質理工学院 応用化学系
教授 大河内美奈
E-mail : okochi.m.aa@m.titech.ac.jp
Tel : 03-5734-2140 / Fax : 03-5734-2116