生命理工学系 News
カビによる肝障害悪化メカニズムを解明
カンジダ菌は活性酸素を産生しタンパク質架橋酵素の核移行を招く
要点
理化学研究所(理研)ライフサイエンス技術基盤研究センター微量シグナル制御技術開発特別ユニットの小嶋聡一特別ユニットリーダー、ロナク・シュレスタ国際プログラム・アソシエイト(研究当時)と、加藤分子物性研究室の大島勇吾専任研究員、東京工業大学生命理工学院の梶原将教授らの共同研究グループは、肝臓に侵入した真菌(カビ)が活性酸素[用語1-1]、特にヒドロキシルラジカル[用語1-2]を作り、その酸化ストレス[用語2]を介して肝細胞死を引き起こす分子メカニズムを明らかにしました。
日本における肝がん(肝臓がん)の主な原因は、肝炎ウイルスの感染(いわゆるウイルス性肝炎)ですが、欧米ではアルコールの過剰摂取によるアルコール性脂肪性肝炎(ASH)[用語3-1]が大きなウエイトを占めています。さらに、近い将来には世界的にメタボリックシンドローム[用語4]の肝臓での表現型である非アルコール性脂肪性肝炎(NASH)[用語3-2] が主な原因になるといわれています注1。ASH/NASH患者においては、腸内に生息する病原性真菌の一種カンジダ菌が肝臓に到達することが報告されています注2。小嶋特別ユニットリーダーらの先行研究から、ASH/NASH患者の肝細胞では、通常は細胞質に存在するタンパク質架橋酵素「トランスグルタミナーゼ(TG2)[用語5]」が細胞核に局在することで肝細胞死を引き起こし、肝障害を悪化(増悪)させることが判明しています注3。しかし、肝臓に到達したカンジダ菌がこの病態形成機構に及ぼす影響は分かっていませんでした。
今回、共同研究グループは、病原性カンジダ菌と非病原性の酵母菌を、肝細胞と共培養しました。その結果、カンジダ菌は活性酸素、特にヒドロキシルラジカルを産生し、これを介して肝細胞におけるTG2の核局在と活性促進を招き、肝細胞死を引き起こすことが分かりました。同様の結果は、カンジダ菌を感染させたマウスの肝細胞においても観察されました。
今回の発見は、ASH/NASHの患者において観察される肝障害の新たな発症機構と想定されます。今後、TG2の核局在を標的とした肝障害を抑える新しい薬剤の開発につながる可能性があります。
本研究成果は、英国の科学雑誌『Scientific Reports』のオンライン版(7月6日付け:日本時間7月7日)に掲載されました。
- 注1日本肝臓学会「肝がん白書 平成27年版」

- 注2Yang A-M, Inamine T, Hochrath K, Chen P, Wang L, Llorente C, Bluemel S, Hartmann P, Xu J, Koyama Y, Kisseleva T, Torralba MG, Mncera K, Beeri K, Chen C-S, Freese K, Hellerbrand C, Lee SML, Hoffman HM, Mehal WZ, Garcia-Tsao G, Mutlu EA, Keshavarzian A, Brown GD, Ho SB, Bataller R, Stärkel P, Fouts DE, Schnabl B; Intestinal "fungi contribute to development of alcoholic liver disease.", J Clin Invest 2017 Jun 30;127(7):2829-2841.
- 注32009年5月1日プレスリリース「タンパク質の架橋反応が細胞死を招き、アルコール性肝障害に」

共同研究グループ
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門
イメージング応用研究グループ 微量シグナル制御技術開発特別ユニット

(左)小嶋聡一、(右)ロナク・シュレスタ
- 特別ユニットリーダー 小嶋聡一(こじまそういち)
- 国際プログラム・アソシエイト(研究当時)ロナク・シュレスタ(Ronak Shrestha)
- 国際プログラム・アソシエイト(研究当時)ラジャン・シュレスタ(Rajan Shrestha)
- 特別研究員 秦咸陽(しんせいよう)
加藤分子物性研究室
- 専任研究員 大島勇吾(おおしまゆうご)
東京工業大学 生命理工学院
- 教授 梶原将(かじわらすすむ)
千葉大学真菌医学研究センター
- 准教授 知花博治(ちばなひろじ)
中国食品発酵工業研究院
- 院長 蔡木易(さいもくい)
- 主任研究員 魯軍(ろくん)
研究の背景
現在、日本における肝がん(肝臓がん)の主な原因は、肝炎ウイルスの感染(いわゆるウイルス性肝炎)ですが、欧米ではアルコールの過剰摂取によるアルコール性脂肪性肝炎(ASH)が大きなウエイトを占めています。さらに近い将来は、世界的にメタボリックシンドロームの肝臓での表現型である非アルコール性脂肪性肝炎(NASH)が主な原因になるといわれています。ASHやNASHは、断酒や生活習慣の改善以外に有効な治療法は確立されておらず、その病態の解明や新薬の開発が課題となっています。
ASH/NASH患者においては、過度のアルコール摂取や遊離脂肪酸によって十二指腸のバリアがボロボロになり、腸内にいた真菌(カビ)や大腸菌が肝臓に到達することが報告されています。特に、病原性真菌の一種であるカンジダ菌が増えることが今年報告されました。2009年に小嶋特別ユニットリーダーらは、ASH/NASH患者の肝細胞では、通常は細胞質に存在するタンパク質架橋酵素トランスグルタミナーゼ(TG2)が細胞核に局在し、肝細胞の生存に必須の肝細胞増殖因子受容体c-Met[用語6]の発現をつかさどる転写因子Sp1[用語7]を過度に架橋結合[用語8]させて不活性化することで、肝細胞死を引き起こし肝障害を悪化(増悪)させることを報告しています。しかし、肝臓に到達したカンジダ菌がこの病態形成機構に及ぼす影響については不明でした。
研究手法と成果
肝臓への真菌感染のモデルとして、病原性カンジダ菌(カンジダアルビカンス Candida albicans もしくはグラブラータ Candida glabrata)をヒト肝細胞株であるHc細胞と共培養し、経過を観察しました。共培養を開始して24時間後にはTG2の核局在と活性化が観察され、さらに、共培養開始から48時間後には細胞死が誘導されました(図1)。一方、病原性のないパン酵母とHc細胞との共培養では、これらの現象は起こりませんでした(図2)。
次に、カンジダ菌が何を介して肝細胞に作用しているかを調べるため、TG2核局在の誘導が起きるための条件検討を行いました。低分子のみを透過させる透析膜を隔てて共培養した場合でもTG2核局在の誘導はみられましたが、熱で殺菌処理した菌体や、菌の培養上清液を肝細胞に投与すると同様の現象は起こりませんでした。このことから、生きたカンジタ菌が産生する半減期の短い低分子が肝細胞に作用していると考えられました。
活性酸素は、TG2を活性化させる因子の一つとして知られており、これらの条件に合致します。そこでヒドロキシルラジカルの原料となる過酸化水素を肝細胞に投与したところ、カンジダ菌と共培養した場合と同様の作用があることが分かりました。さらに、カンジダ菌との共培養時に、活性酸素を捕捉する抗酸化剤であるN-アセチルシステインを投与するとTG2核局在の誘導はブロックされました(図1)。
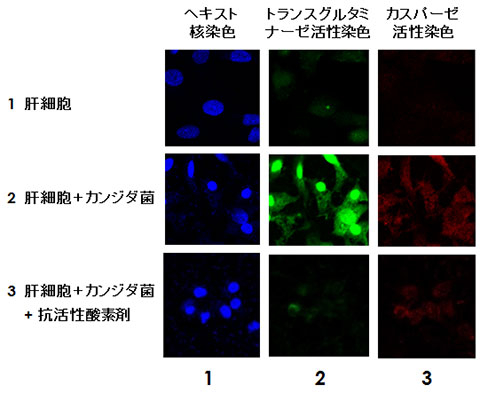
図1. カンジダ菌との共培養による肝細胞中のトランスグルタミナーゼ(TG2)核局在
ヒト肝細胞株Hc細胞の蛍光顕微鏡像。核はヘキスト(青)、活性化トランスグルタミナーゼはビオチン化基質5-(biotinamido)pentylamine(5BAPA)(緑)、細胞死の誘導はカスパーゼ活性(赤)の蛍光染色で観察した。Hc細胞をカンジダ菌と共培養すると、24時間後にTG2の発現誘導ならびに核局在(2段目2列目)、さらに48時間後にカスパーゼ3の誘導(2段目3列目)を伴う細胞死が観察された。このとき、抗活性酸素剤であるN-アセチルシステインを培養液中に添加して菌が産生する活性酸素をトラップすると、これらの変化を抑えることができた(3段目)。このことから、カンジダ菌が産生する活性酸素によって肝細胞においてTG2の発現と核局在が誘導され、肝細胞が細胞死に陥ることが示された。
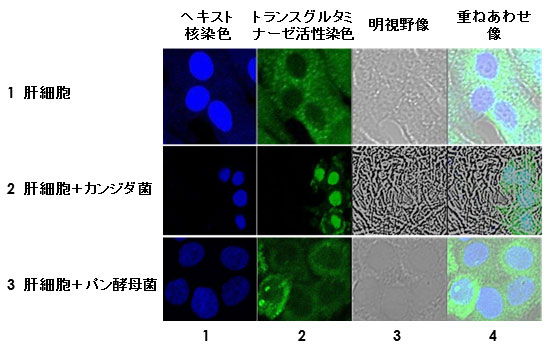
図2. パン酵母との共培養による肝細胞中のトランスグルタミナーゼ(TG2)
ヒト肝細胞株Hc細胞とカンジダ菌を共培養すると、24時間後にTG2の発現誘導ならびに核局在(2段目2列目)、が誘導されるが、カンジダ菌と同数のパン酵母(出芽酵母)と共培養しても、そのような変化はみられなかった(3段目2列目)。
カンジダ菌が活性酸素を介して肝細胞に作用する可能性をさらに検証するため、肝細胞での活性酸素の局在を蛍光顕微鏡で観察し、共培養液中に存在する活性酸素種の同定を電子スピン共鳴(ESR)[用語9]による解析で行いました。その結果、TG2核局在の誘導がみられる条件下でのみ活性酸素が核で顕著に検出され(図3)、そのときの培養液には活性酸素の一種ヒドロキシルラジカルが存在することが分かりました(図4)。このヒドロキシルラジカルがカンジタ菌に由来することは、ヒドロキシルラジカルを中心とした活性酸素の産生に働くNOX遺伝子[用語10]を欠損させた変異菌では同様の現象を誘導できなかったことからも示されました(図3、図4)。さらに、カンジダ菌を静脈注射したマウス個体を調べた結果、肝臓における活性酸素とTG2核局在の誘導が認められました。
以上の結果により、病原性真菌であるカンジダ菌は、活性酸素、特にヒドロキシルラジカルを産生し、その作用によって肝細胞内においてTG2の核局在を引き起こし、その結果として、転写因子Sp1の架橋不活性化を介する肝細胞死を引き起こすことを見いだしました(図5)。
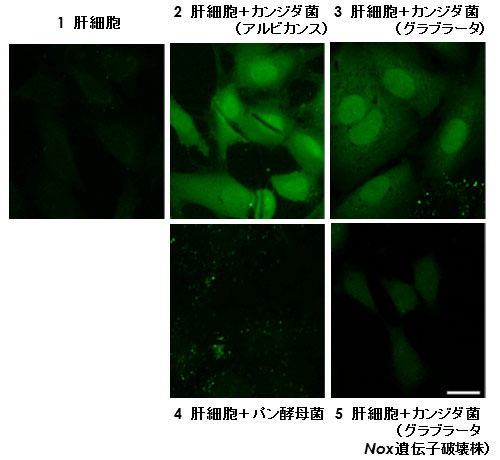
図3. 肝細胞とカンジダ菌との共培養系における活性酸素の産生
活性酸素、特にヒドロキシルラジカルと反応して蛍光を発する試薬CM-H2DCFDAを用いて、各条件下で8時間培養した後の活性酸素の産生量の様子を調べた結果。ヒト肝細胞株Hc細胞のみでは活性酸素の産生はみられなかった(1)が、病原性のあるカンジダアルビカンス菌(2)やカンジダグラブラータ菌(3)と共培養すると、活性酸素の産生が観察された。カンジダ菌と同数の病原性のないパン酵母(出芽酵母)(4)もしくは、ヒドロキシルラジカル産生に関わるNOX遺伝子を破壊したカンジダグラブラータ菌(5)と共培養しても、そのような変化はみられなかった。
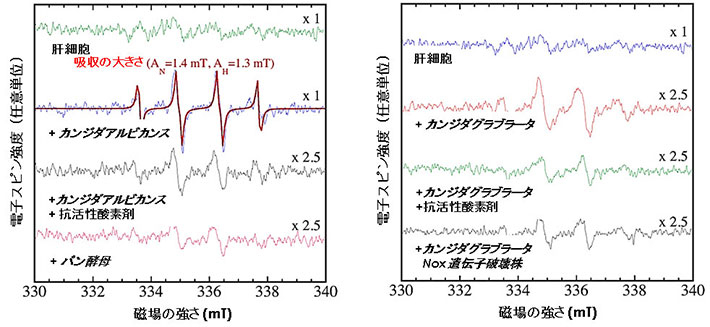
図4. 肝細胞とカンジダ菌との共培養液中に存在するヒドロキシルラジカルの同定
各条件下で8時間培養した後の培養液中のヒドロキシルラジカル量を、電子スピン共鳴によって半定量的に評価した結果。ヒト肝細胞株Hc細胞のみではヒドロキシルラジカルの産生はみられなかったが(左右)、カンジダアルビカンス菌(左)やカンジダグラブラータ菌(右)と共培養すると活性酸素の産生が観察された。カンジダ菌と同数のパン酵母(出芽酵母)(左)もしくは、活性酸素産生に関わるNOX遺伝子を破壊したカンジダグラブラータ菌(右)と共培養してもそのような変化はみられなかった。ヒドロキシルラジカルのスペクトル強度の比は、カンジダアルビカンス菌 10 : カンジダグラブラータ菌 3 : パン酵母菌 1であり、あるレベル以上のヒドロキシルラジカルが、肝細胞の核におけるトランスグルタミナーゼ活性誘導に働いていることが分かった。
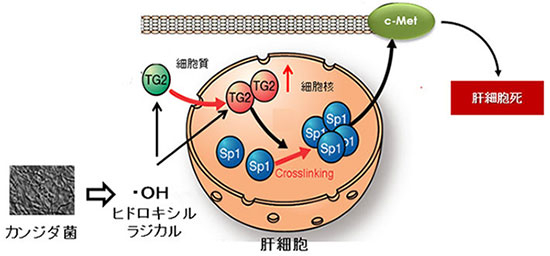
図5. 病原性真菌であるカンジダ菌が肝細胞死を引き起こす分子メカニズム
カンジダ菌は、活性酸素、特にヒドロキシルラジカルを産生し、その作用によって肝細胞内においてトランスグルタミナーゼ(TG2)の発現と核局在を誘導し、その結果として、肝細胞の生存に必須の肝細胞増殖因子受容体c-Metの発現をつかさどる転写因子Sp1の架橋不活性化を介する肝細胞死を引き起こす。
今後の期待
今回の発見により、ASH/NASHの患者における肝障害が、病原性真菌の産生する活性酸素を介して増悪する新たな発症機構の存在が浮かび上がりました。活性酸素を抑制する薬剤の投与により肝細胞でのTG2の核移行を阻害するなど、TG2の核局在を標的とした肝障害を抑える新たな治療法の開発が期待できます。
用語説明
[用語1-1] 活性酸素 [用語1-2] ヒドロキシルラジカル : 活性酸素は、普通の酸素に比べて著しく反応性が増した原子状態の酸素や電子状態が不安定な酸素分子をいう。生体内では白血球の殺菌作用など多くの生理現象に関与する。細胞を直接的あるいは間接的に傷つけ、老化の一因を作る。活性酸素の分子種のうち最も反応性が高く、最も酸化力が強いのが、ヒドロキシルラジカル(ヒドロキシ基=水酸基に対応するラジカル)で、•OHと表される。
[用語2] 酸化ストレス : 生体内で酸化還元状態の均衡が崩れたとき、過酸化水素やヒドロキシルラジカルを代表とする活性酸素が産生される。これらがタンパク質や脂質、あるいは核酸と反応し、生体にダメージを与える。
[用語3-1] アルコール性脂肪性肝炎(ASH)、 [用語3-2] 非アルコール性脂肪性肝炎(NASH) : 肝炎のうちアルコールの過剰摂取が原因で引き起こされる病態がアルコール性脂肪性肝炎(ASH)である。アルコールを飲んでいないのにASHと似たような病態を示すのが非アルコール性脂肪性肝炎(NASH)で、高脂肪食による遊離脂肪酸が原因で起こるとされている。線維化、大滴性の脂肪滴、壊死・炎症所見、肝細胞の風船様膨化、核空胞化、脂肪肉芽腫、胞体内凝集傾向、約30%にマロリー体(MB)がみられる。
[用語4] メタボリックシンドローム : 内臓性脂肪症候群のことで、内蔵肥満に高血圧、高血糖、脂質代謝異常が組み合わさり、心臓病や脳卒中などの動脈硬化性疾患や肝炎を招きやすい生活習慣病。
[用語5] 肝細胞増殖因子受容体c-Met : タンパク質同士を共有結合させる架橋反応を触媒する酵素。タンパク質中のアミノ酸のグルタミンを利用してペプチド結合を形成させるため、この名が付けられた。架橋反応にどのような生理学的な意味があるかは不明な点が多い。
[用語6] 肝細胞増殖因子受容体c-Met : 増殖因子とは生体内において特定の細胞の増殖や分化を促進するタンパク質の総称。さまざまな細胞学的・生理学的過程の調節を行い、細胞表面に存在する受容体タンパク質に特異的に結合することで、生命の維持に必要なシグナルを伝える細胞間の信号物質として働く。この受容体が増殖因子受容体である。肝細胞増殖因子の最も主要な受容体がc-Metである。
[用語7] 転写因子Sp1 : がん細胞を含むほとんど全ての細胞において、その細胞が生きていくために必要な増殖因子の受容体の遺伝子発現をつかさどる転写因子。転写因子とは、DNAに特異的に結合するタンパク質で、遺伝子の転写開始や調節に関与する。
[用語8] 架橋結合 : 化学反応において、複数の分子が橋を架けたように結合すること。この結合により、生体構造の安定化やタンパク質の機能変換が行われる。
[用語9] 電子スピン共鳴(ESR) : 電子スピン共鳴(ESR)法は電子スピン(不対電子)を検出する分光法の一種。電子スピンに起因する磁気モーメントのエネルギーは、スピンの量子化に伴って磁場中で分裂する(ゼーマン効果)。ESRはこのゼーマン分裂によるエネルギー準位間の遷移であり、研究対象に存在する不対電子のミクロな電子状態を調べることができる。また、ESRスピントラップ法を用いることによって、ヒドロキシルラジカルなどの短寿命ラジカルの同定や定量的な評価が可能となる。
[用語10] NOX遺伝子 : NADPH oxidase(Nox)ファミリー遺伝子の総称。NADPHを基質として、活性酸素を産生する膜酵素。
論文情報
| 掲載誌 : | Scientific Reports |
|---|---|
| 論文タイトル : | Fungus-derived hydroxyl radicals kill hepatic cells by enhancing nuclear transglutaminase |
| 著者 : | R Shrestha, R Shrestha, X-Y Qin, T-F Kuo, Y Oshima, S Iwatani, R Teraoka, K Fujii, M Hara, M Li, A Takahashi-Nakaguchi, H Chibana, J Lu, M Cai, S Kajiwara, and S Kojima |
| DOI : | 10.1038/s41598-017-04630-8 |
お問い合わせ先(研究内容について)
東京工業大学 生命理工学院
教授 梶原将
E-mail : skajiwar@bio.titech.ac.jp
Tel : 045-924-5715 / Fax : 045-924-5773
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸敦
E-mail : ayamagishi@riken.jp
Tel : 078-304-7138 / Fax : 078-304-7112
理化学研究所 広報室 報道担当
E-mail : ex-press@riken.jp
Tel : 048-467-9272 / Fax : 048-462-4715