生命理工学系 News
【創発的研究支援事業紹介】No. 3 正木慶昭 助教
生命理工学院の教員が研究代表を務める研究課題が創発的研究支援事業に採択されました。創発的研究支援事業は、特定の課題や短期目標を設定せず、多様性と融合によって破壊的イノベーションにつながるシーズの創出を目指す「創発的研究」を推進するため、既存の枠組みにとらわれない自由で挑戦的・融合的な多様な研究を、研究者が研究に専念できる環境を確保しつつ長期的に支援する文部科学省の事業です。
採択された教員をクローズアップしてご紹介するシリーズ記事(全7回)を連載いたします。全7回のうち、第3回目は“微量副反応解析による長鎖核酸の化学合成法の開発”の研究課題の研究代表を務める正木慶昭 助教です。

正木 慶昭 助教
| 居室 | J2-809室 |
|---|---|
| ymasaki@bio.titech.ac.jp | |
| Tel/Fax | 045-924-5750 |
-まず、正木先生の研究テーマを聞かせて下さい。
創発的研究支援事業で行う研究テーマは、核酸化学合成の限界への挑戦です。核酸化学合成は1955年のジヌクレオチド合成からはじまり、1981年に現在よく用いられているホスホロアミダイト法が報告されました。その後も数多のケミストが最適化してきた合成法によって、今の核酸化学合成は成り立っています。DNAなら99%の効率で一塩基伸ばすことができ、PCR検査に使用されるプライマーぐらいの核酸分子だったら容易に合成が可能です。しかし、今の化学合成法では合成できないもの、たくさんあります。たとえば遺伝子。1塩基伸ばすごとに99%をかけることになるので、長い核酸は指数関数的に化学合成が困難になっていきます。酵素を用いた方法と組み合わせることで、天然物そのものは合成できますが、治療につかえるような物性を改変した核酸を合成することは非常に困難です。今できないことをできるようにする、そう言ったことを目指して研究を進めていきたいと考えています。
-この研究を始めたきっかけを聞かせて下さい。
私は助教として東京工業大学に着任してから、研究テーマの一つの軸として核酸医薬品に関する研究をおこなっています。従来の低分子や抗体医薬品では治療の難しい、必要なタンパク質が不足している疾患に対して、核酸医薬品はスプライシング過程に介入してタンパク質をうまく作れるように修正することができます。この方法をもちいて、脊髄性筋萎縮症(SMA)や筋ジストロフィー症(DMD)などの疾患の治療薬が開発されました。これらの核酸医薬品ができた理由の一つとして、核酸分子の化学修飾の発展があります。化学修飾がない核酸分子は迅速に分解され、治療に使うことは困難です。しかし、化学合成や化学修飾の発展により、少ない投与で長期にわたって作用することができるようになりました。
じゃあ、今の核酸医薬品、どんな場合も対応できるか、というとそんなことはないです。治療法をつくることが難しい標的は、まだまだたくさんあります。より長い核酸分子を化学修飾で改変すれば治療薬をつくれる可能性がありますが、現在の化学合成法では合成できず、研究自体も困難な場合が多いです。そこで長期的な視点で化学合成法自体を改善し、研究を進めることが必要だと考え、この研究を始めました。
-今回の創発的研究支援事業で取り組まれる具体的な研究内容を
聞かせて下さい。
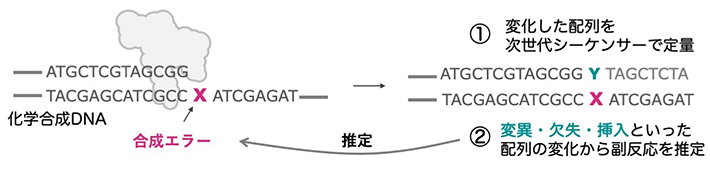
今回の研究計画では、まず微量な副生成物を正確に定量するところからはじめています。今の化学合成法は99%の効率で1塩基伸ばすことができるので、1%未満のさまざまな合成エラーを解決していく必要があるのですが、そういった微量な副生成物を正確に定量して議論するのは再現性の観点からもチャレンジングな課題です。また合成条件ひとつとっても、ある側面では有用であっても、異なる副反応が促進されることもあり、網羅的な解析法がなければ、より良いものを作り上げることは困難です 私は2019年からこの課題に取り組んでおり、次世代シーケンサーを組み合わせた方法の研究をしてきています。今回の研究では、その手法を発展させて、より一歩深い情報を得られる方法を開発しようとしています。その情報をもとに、化学合成のどの段階で、どのような副反応が起こっているのかメカニズムを推定し、解決するための反応条件を検証することを目指しています。
-今後の目標を聞かせて下さい。
この創発的支援事業で目指していることは、1桁合成効率を向上させることです。1桁合成効率を上げることができれば、できるようになることが大きく増えます。まずはDNAから取り組んで、RNAへと発展させていきたいと考えています。自分で言うのもなんですが、核酸化学合成そのものは今できることなので、マニアックな、人目を引きにくい研究です。でも、そういったたくさんのマニアックな先人の知見が今の研究を支えており、私も縁の下の力持ちになるような知見を生み出していくことが目標です。