生命理工学系 News
アルツハイマー病のタンパク質凝集体の構造の違いに迫る
微量試料計測で凝集タンパク質の分子構造の違いを同定可能に
要点
- アルツハイマー病の主原因の1つとされる、42残基のアミロイドβタンパク質(Aβ42)凝集体の分子構造の違いを高感度で検出する固体NMR計測法を開発
- 固体NMRスペクトルを分子指紋として使い、極微量の脳由来Aβ42凝集体と、試験管で作成したAβ42凝集体から両者の分子構造が異なることを確認
- アルツハイマー患者由来のAβ42凝集体に対する構造のスクリーニングや、抗体医薬への応用を期待
概要
東京工業大学 生命理工学院 生命理工学系の石井佳誉教授(生命理工学コース主担当)(理化学研究所生命機能科学研究センター(理研BDR)兼任)と理研BDRの山崎俊夫ユニットリーダー、小林直宏上級研究員らの国際共同研究グループは、アルツハイマー病の主原因の1つとされる42残基のアミロイドβタンパク質(Aβ42)[用語1]凝集体について、高磁場固体NMR法を用いて分子構造の違いを高感度で検出する方法を開発した。
これまでの研究で、試験管内で作成した繊維状Aβ42凝集体の構造は知られているものの、アルツハイマー病患者の脳内に蓄積する繊維状Aβ42凝集体の実際の構造はよく分かっていなかった。今回、国際共同研究グループは、アルツハイマー病患者の脳より得られた微量の凝集体試料を増幅することで、高磁場固体NMR法のスペクトル解析を短時間かつ高感度で行うことに成功した。このNMRスペクトルを分子指紋[用語2]として使った比較により、脳由来の試料は、人工の繊維状Aβ42凝集体とは構造が大きく異なることを明らかにした。これは、脳由来のAβ42凝集体の分子構造が、試験管内で作成したAβ42凝集体の標準的な分子構造とは全く異なることを示す有力な証拠だといえる。
この成果から、アルツハイマー患者に由来するAβ42凝集体の分子構造のスクリーニングにNMR法を用いることが可能であり、それが脳内のAβ42凝集体の構造と機能の理解につながると期待できる。また将来的には、脳内のAβ42凝集体の3次構造[用語3]決定や、抗体医薬[用語4]の結合部位の同定などへの応用も考えられる。この高感度固体NMR法は現在JST未来社会創造事業で開発中の1.3 GHz超高磁場NMR装置の先端利用技術として開発された計測法であり、本装置と組み合わせることで、解析感度を更に大幅に上げることも可能となる。
本研究は、米国化学会誌「Journal of the American Chemical Society」のオンライン版(7月26日付)に掲載された。
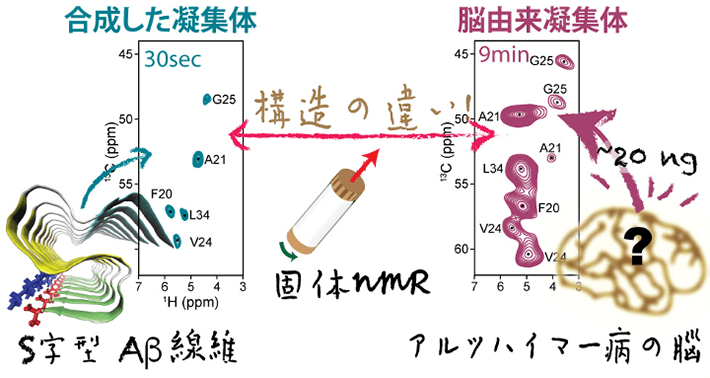
- 図1固体NMRを用いたAβ42凝集体の解析イメージ。NMRスペクトルを分子指紋として利用することで、脳由来の繊維状Aβ42凝集体と試験管内で人工的に作った繊維状Aβ42凝集体を区別することが可能になる。スペクトルが大きく異なることから構造の違いが確認できる。
背景
酵素などのタンパク質の機能はその分子構造によって決まるが、アルツハイマー病の主原因と考えられる繊維状のAβ42凝集体の構造は長らく明らかになっていなかった。近年、石井教授らのグループが、試験管内で作成した繊維状Aβ42凝集体ではβシートと呼ばれる平たい構造を形成してS字型に折りたたまれており、多数のAβ42が平行に連なって長い繊維を作ることを、固体核磁気共鳴(NMR)法を用いて明らかにしている。しかし、アルツハイマー病患者の脳内に老人斑として蓄積する繊維状Aβ42凝集体が実際にどのような構造になっているかは、脳内から試料が微量しか取れないこともあり、よく分かっていなかった。
研究成果
今回の研究で国際共同研究グループは、アルツハイマー病の主原因の1つと考えられる42残基のアミロイドβタンパク質(Aβ42)の繊維状凝集体について、高磁場固体NMR法を用いて分子構造の違いを高感度で検出する方法を提案した。
具体的には、アルツハイマー病患者の脳より得られた微量の繊維状Aβ42凝集体を核として、合成したAβ42のモノマーを混ぜることで、脳由来試料の構造を反映したAβ42凝集体を増幅した。この増幅したAβ42凝集体と、高感度の1H核検出を用いた高磁場固体NMR法を組み合わせることで、わずか20 ngという微量の脳由来Aβ42凝集体から作成した試料のスペクトル解析を短時間(9分程度)で行うことに成功した。得られたNMRスペクトルを分子指紋として用いて比較すると、脳由来の試料は人工の繊維状Aβ42凝集体と大きく異なる構造を持つことが分かった。これは、脳由来のAβ42凝集体の構造が、試験管で作成した試料の標準的な分子構造とは全く異なることを示す有力な証拠だといえる。
今後の展開
今回の成果は、アルツハイマー患者由来のAβ42凝集体の分子構造のスクリーニングにNMR法が有効であることを明らかにするものであり、脳内のAβ42凝集体の構造と機能の理解につながると期待される。
また同研究グループは本研究で、S字型とは異なる新しい構造を持つAβ42凝集体を試験管内で作成することにも成功している。この試料について、多次元固体NMR法により信号の同定と2次構造[用語3]の決定ができることを示せたことから、将来的に、固体NMR法を脳内のAβ42凝集体の構造決定や抗体医薬との結合部位の同定などに応用することも可能であると考えられる。また、現在開発中の超高磁場NMR装置を利用することで、さらに感度を大幅に上げることも可能である。
- 付記
本研究は、科学技術振興機構(JST)未来社会創造事業大規模プロジェクト型「高温超電導線材接合技術の超高磁場NMRと鉄道き電線への社会実装(研究代表者:前田秀明)」、科学研究費助成事業(学術研究助成基金助成金)国際共同研究加速基金(帰国発展研究)「次世代の高磁場生体固体NMR法の開発とアミロイドとリガンド相互作用の構造生物学(研究代表者:石井佳誉)」、米国National Institutes of Health(NIH、国立衛生研究所), NIGMS U01 Grant「Structures and Propagation of Pathologically Relevant Amyloids in Alzheimer's(研究代表者:石井佳誉)」、NIH, NIA R01 Grantと Alzheimer's Association Zenith Fellows Award(研究代表者:S. C. Meredith)およびNIH, NIGMS T32 Training Grant(研究代表者:M. R. Clark)による支援を受けて行われた。
- 用語説明
[用語1] 42残基のアミロイドβタンパク質 : 脳内には42残基と40残基の2種類のアミロイドβタンパク質(Aβ)があるが、42残基のAβであるAβ42は凝集しやすく、アルツハイマー病の発症とより関係が深いと考えられている。
[用語2] 分子指紋 : 固体NMRのスペクトルは分子の構造を敏感に反映して変化するので分子指紋として利用される。同じタンパク質でも構造が異なると分子指紋は異なる。
[用語3] 2次構造、3次構造 : タンパク質は主鎖部分が水素結合を形成して折りたたまれαヘリックスやβシートなどの特徴的な2次構造という局所構造を形成する。2次構造が更に折りたたまれて、タンパク質が機能するのに必要な3次構造を形成する。
[用語4] 抗体医薬 : 抗体は、抗原を特異的に認識し結合するタンパク質である。抗体医薬はがんやリウマチなどの治療に幅広く使われているが、アルツハイマー病でも抗体医薬が米国で初めて認可され注目を浴びている。
| 掲載誌 : | Journal of the American Chemical Society |
|---|---|
| 論文タイトル : | Sensitivity-Enhanced Solid-state NMR Detection of Structural Differences and Unique Polymorphs in Pico- to Nanomolar Amounts of Brain-derived and Synthetic 42-residue Amyloid-β Fibrils |
| 著者 : | Ayesha Wickramasinghe, Yiling Xiao, Naohiro Kobayashi, Songlin Wang, Kathryn P. Scherpelz, Toshio Yamazaki, Stephen C. Meredith and Yoshitaka Ishii* |
| DOI : |
- タンパク質を増やす秘訣に迫る|生命理工学系News
- 石井研究室
- 研究者詳細情報(STAR Search) - 石井佳誉 Yoshitaka Ishii
- 生命理工学院 生命理工学系
- 理化学研究所
- 研究成果一覧