生命理工学系 News
細胞の運動を「10秒見るだけ」で細胞質ATP濃度がわかる
繊毛運動を利用した細胞質ATP濃度推定法の開発
要点
- モデル藻類を用いて繊毛運動頻度とATP濃度の関係式を確立
- 呼吸や光合成による細胞質ATP濃度の変化を数値化することに成功
- 細胞内代謝状態の非侵襲的かつ迅速なモニタリングが可能
概要
東京工業大学 生命理工学院 生命理工学系の髙野和歌子大学院生と同科学技術創成研究院 化学生命科学研究所の若林憲一准教授(ライフエンジニアリングコース主担当)らは、細胞内のATP(アデノシン3リン酸、生体内のさまざまな反応のエネルギー源となる化学物質)の濃度を非侵襲的[用語1]かつ短時間で簡便に推定する手法を、繊毛運動を利用して開発した。
ATP濃度は細胞の代謝状態を反映するため、細胞内のATP濃度測定は基礎生物学的にも医学的にも重要課題であり、これまでにさまざまな測定手法が確立されてきた。今回、研究グループは非侵襲的な細胞内ATP濃度測定を目指し、ある種の真核生物の細胞から生えた毛のような「動く細胞小器官」である繊毛の運動に着目した。繊毛の内部構造「軸糸」[用語2]は細胞骨格である微小管[用語3]から成る。微小管上に並んだモータータンパク質ダイニン[用語4]が隣接する微小管に対してATPの加水分解エネルギーを使って構造変化することで滑り運動が起こり、繊毛は波打ち運動を行う。繊毛は精子や微生物では細胞の運動装置として、また多細胞生物の表面では細胞外液の起流装置として機能し、重要なはたらきをする。また、繊毛の運動頻度(毎秒)はATP濃度依存的であり、繊毛を界面活性剤で除膜してATPを添加すると、露出した軸糸が運動し、その運動頻度はほぼミカエリス・メンテン式[用語5]に従ってATPの濃度に依存して上昇する。
本研究は繊毛研究モデル生物の緑藻クラミドモナス[用語6]を材料に、軸糸を運動させる方法を最適化することで、軸糸の運動頻度とATP濃度の関係式を導出した。次に生きている細胞の繊毛運動頻度を計測し、この式に代入して迅速・簡便・非侵襲的に細胞質内ATP濃度を推定することに成功した。この方法は繊毛を持っているさまざまな生物や器官の細胞内ATP濃度の非侵襲的な推定に貢献するものと期待される。
研究成果は12月3日付け「Journal of Biological Chemistry(ジャーナル・オブ・バイオロジカル・ケミストリー)」電子版に掲載された。
背景
ATP(アデノシン3リン酸、図1)は生体におけるエネルギー通貨と呼ばれ、生体内のさまざまな反応のエネルギー源となる化合物である。ATPは、真核細胞では主としてミトコンドリアにおける好気呼吸(酸素呼吸)や植物葉緑体における光合成の際にATP合成酵素によって生成され、また解糖系[用語7]などによっても生成される。そして、細胞内のさまざまな反応を駆動するために消費される。したがって、細胞内のATP量やATP濃度は生体の代謝状態を示す重要な指標である。
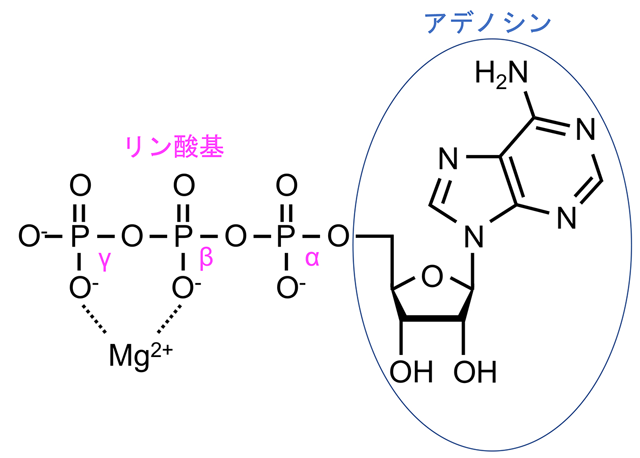
図1. ATPの構造式
アデノシンに3つのリン酸基が結合している。リン酸基はアデノシンに近い位置からα位、β位、γ位と呼ばれ、γ位のリン酸の結合が加水分解によって切られるときに放出されるエネルギーが生体内のさまざまな反応に使われる。生体内では多くの場合β、γ位にMg2+が配位しており、このMgATP(アデノシン3リン酸マグネシウム)が加水分解酵素の基質になる。
細胞内ATP量の測定のためにさまざまな手法が確立されている。よく用いられるのは、細胞を破砕し、その破砕液に含まれるATPをルシフェラーゼ[用語8]が触媒する生物発光を用いて検出するという方法で、キット化されて市販されている。細胞が破砕できる限りどのような生物にも適用できるという汎用性の高い方法であるが、細胞を壊すという手間があるため即時性がなく、かつ生きている状態では測定できないという欠点がある。
この欠点を克服するために、生きている細胞内のATPを可視化するツールも、すでに様々なものが開発されている。中でも、蛍光タンパク質や発光タンパク質とATP結合タンパク質ドメインをつなげて作成したセンサータンパク質[用語9]の遺伝子を目的の細胞に導入し、発現させるものがよく用いられている。これは顕微鏡で蛍光や発光の様子を観察したり、光を検出するプレートリーダーなどで、その光強度を測定したりすることで生体内の様子をリアルタイムで観察することができる優秀な手法である。
一方で、蛍光タンパク質の場合は励起光を照射しなければ観察できず、強すぎる励起光照射は光毒性と呼ばれるダメージを細胞に与えてしまう。特に光合成生物の場合には励起光によって光合成活性に変化が生じ、生体の状態を変えてしまう。また、発光タンパク質の場合は細胞への発光基質[用語10]の導入という手間が必要である。どちらのタイプでも、センサータンパク質遺伝子を導入するという手間と、生物へのなんらかの侵襲が必要である。
ATPを利用する細胞小器官のひとつに、繊毛・鞭毛がある(図2)。繊毛・鞭毛は細胞から生えた毛のような器官である。精子や藻類細胞のように一つの細胞から1~2本生えている場合には鞭毛、ゾウリムシなどの微生物や哺乳類の気管上皮細胞のように一つの細胞から多数生えている場合は繊毛と呼び分ける生物学上の習慣があったが、本質的に内部の構造や運動のメカニズムは同じである。近年は「繊毛」で用語を統一されつつあるので、ここでは繊毛と呼ぶことにする。
繊毛膜の内部構造「軸糸」の横断面は9+2と呼ばれる特徴的な構造になっている(図2)。9組の二連微小管(用語4参照)が2本の中心微小管を囲む構造である。各二連微小管の上にはモータータンパク質「ダイニン」が周期的に配列し、ダイニンがATPの加水分解エネルギーを使って構造変化することで隣接する二連微小管との間に滑りを起こす。これが繊毛運動の原動力となる。

図2. クラミドモナスと繊毛の9+2構造
(左)クラミドモナス細胞の明視野顕微鏡像。1つの細胞に2本の繊毛が生えている。これを平泳ぎのように動かして、繊毛側を前にして泳ぐ。(右)繊毛を界面活性剤で除膜し、露出した内部構造「軸糸」の横断面を透過型電子顕微鏡で観察したもの。特徴的な9+2構造をもつ。9組の二連微小管上に結合したダイニンが、隣接した二連微小管に対してATPの加水分解エネルギーを使って滑ることで二連微小管間にたわみが生じる。
繊毛運動の研究には伝統的に「除膜細胞モデル」が使われる(東工大ニュース「ゾンビ・ボルボックス」![]() 参照)。まず、界面活性剤処理によって繊毛をもつ細胞の細胞膜を溶解する(この状態の除膜された細胞を細胞モデルと呼ぶ)。当然、細胞は死んでしまうが、図2(右)のように9+2構造は維持される。ここにATPを加えると、繊毛は再び運動を開始する。細胞自体は死んでいるのに、繊毛運動の再活性化によって泳ぐので、いわば「ゾンビ・クラミドモナス」である。
参照)。まず、界面活性剤処理によって繊毛をもつ細胞の細胞膜を溶解する(この状態の除膜された細胞を細胞モデルと呼ぶ)。当然、細胞は死んでしまうが、図2(右)のように9+2構造は維持される。ここにATPを加えると、繊毛は再び運動を開始する。細胞自体は死んでいるのに、繊毛運動の再活性化によって泳ぐので、いわば「ゾンビ・クラミドモナス」である。
動画1. 細胞モデルのATP添加による運動(0.5 mM ATP)
動画2. 細胞モデルのATP添加による運動(2.0 mM ATP)
このとき、横軸にATP濃度、縦軸に繊毛打頻度(1秒間に繊毛打が生じる回数)をプロットする。細胞集団の平均繊毛打頻度は既報の方法(Kamiya, R. 2000 Methods 22(4) 383-387)によって、10秒程度で計測できる。顕微鏡下でクラミドモナスが遊泳する際、1回繊毛を打つ度に細胞が前後に動く(図3)。このときの光のちらつきを光センサーで検出し、パソコンで高速フーリエ変換をしたピーク値が平均繊毛打頻度を示す。
この方法で、さまざまなATP濃度下における細胞モデルの平均繊毛打頻度を計測してグラフにすると、ほぼミカエリス・メンテン式に従うことが以前から知られていた(図4)。ところが、繊毛研究のモデル生物である単細胞緑藻クラミドモナス(図2左)を用いてこの細胞モデル実験を行うと、高いATP濃度の領域では、繊毛打頻度がミカエリス・メンテン式で予想される値よりも小さくなってしまう(図4)。生きているクラミドモナス細胞はもっと高い頻度(~60 Hz)で繊毛を打つので、この実験系に何らかの問題があることが指摘されていた。
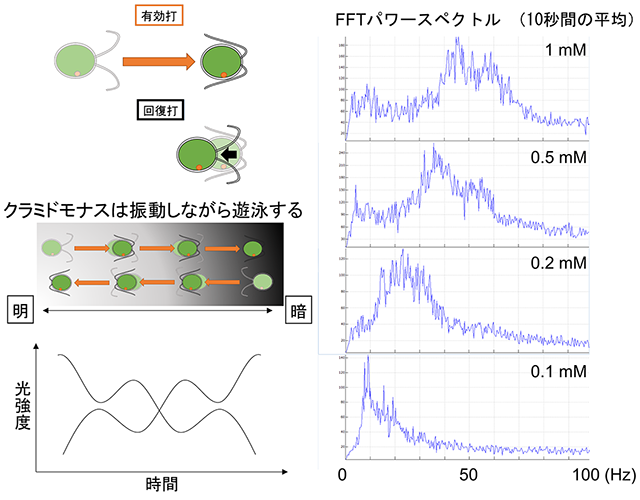
図3. Kamiya(2000)の方法によるクラミドモナス繊毛打頻度の測定
(左上)クラミドモナスは2本の繊毛を平泳ぎのように動かして泳ぐ。このとき、繊毛を前から後ろに動かす「有効打」によって大きく前進し、その繊毛を前に戻す「回復打」によって少しだけ後退する。顕微鏡の視野には微視的に明暗のムラがあるため、ある細胞は明るいほうから暗いほうへ、別の細胞は暗い方から明るいほうへ動くことになる。(左下)その様子を光センサーで検出すると、光強度は繊毛打頻度を周波数として振動しながら変動する。この様子をパソコンで高速フーリエ変換する。(右)細胞モデルをさまざまなATP濃度下で動かし、その様子を光センサーを通して観察し、高速フーリエ変換したもの。スペクトルのピークが、10秒間に光センサーの視野を通り過ぎた数十個の細胞の平均繊毛打頻度を示す。
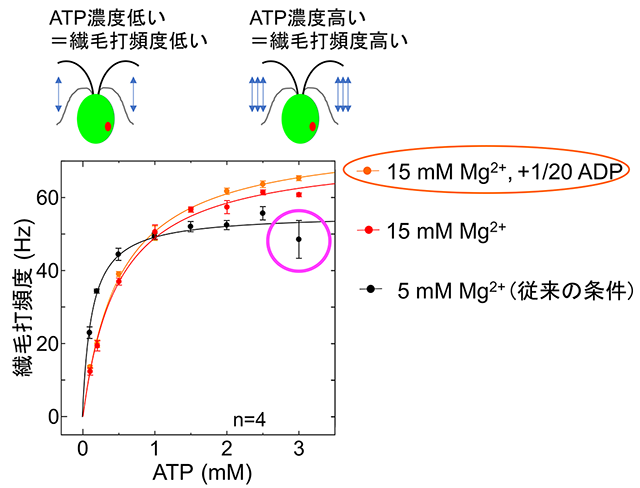
図4. 細胞モデルの繊毛打頻度-ATP濃度関係
ATP濃度の上昇につれて、繊毛打頻度はミカエリス・メンテン型に上昇する。従来の実験条件(5 mM Mg2+を含んだ溶液)ではATP濃度3 mMで繊毛打頻度が低下してしまう(マゼンタの○印)。溶液中のMg2+濃度を15 mMに高め、かつ生体内のATP:ADP(アデノシン3リン酸:アデノシン2リン酸)比を模した量のADPを添加することで、この低下が抑えられ、繊毛打頻度がミカエリス・メンテン式によくフィットした。つまり、繊毛打頻度をATPの関数として表現できた。
研究成果
高いATP濃度において細胞モデルの繊毛打頻度が低下しない実験条件を探し出し、繊毛打頻度−ATP濃度の関係式を作れば、生きている細胞の繊毛打頻度を計測することによって非侵襲的に細胞内ATP濃度が算出できるはずである。そこで研究グループは、まず除膜細胞モデル実験の溶液条件を再検討した。高ATP濃度側での繊毛打頻度の低下はATPに配位するMg2+(図1)の枯渇が原因であると考えて、従来よりもMg2+を増やしたところ、高ATP濃度での運動の低下は抑えられた(図4)。
さらにダイニンの活性制御にADP(アデノシン2リン酸)が必要であるとの知見を参考に、生体内のATP:ADP比を模してATPの1/20量のADPを添加したところ、さらに運動性の向上がみられた。この2つの改善を施して得られた繊毛打頻度とATP濃度の関係はミカエリス・メンテン式に非常によくフィットしたため、得られた式を生体内ATP濃度の算出に用いることにした。生きた細胞の繊毛打頻度をこの式に代入すると、明所で育てた細胞のATP濃度は約2.0 mM(ミリ・モーラー)、暗所で育てた細胞は約1.5 mMと推定することができた。
このように繊毛打頻度から算出した細胞内ATP濃度を、ルシフェラーゼを用いた従来法で測定した濃度(細胞破砕液中のATP量を測定し、細胞数と細胞の大きさから細胞内濃度に換算した)と比べると、どのような条件でも常にルシフェラーゼ法のほうが高い値になった(図5)。光合成不能株と野生株の比較などから、従来法では葉緑体やミトコンドリアなど、膜で囲まれた細胞小器官の中に含まれるATPも全て検出しているのに対して、繊毛打頻度から算出したATP濃度は、細胞質のみの濃度を反映していることが示唆された。
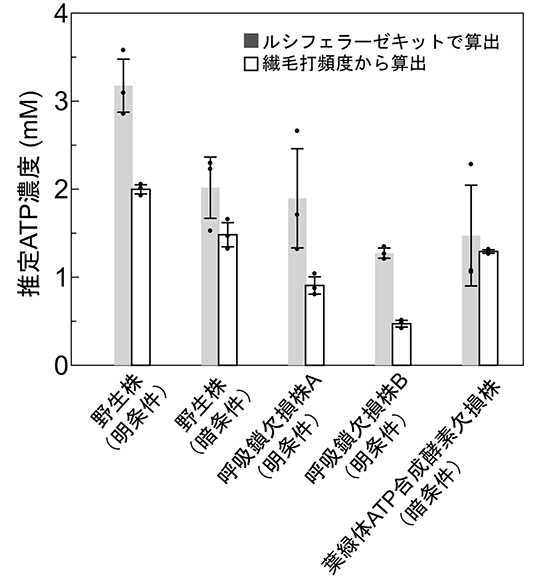
図5. 2つの方法で推定した細胞内ATP濃度
ルシフェラーゼキットと繊毛打頻度それぞれによって、さまざまな株および条件で細胞内ATP濃度を推定したもの。2つの値の高低の傾向は似ているが、どの条件でもルシフェラーゼキットのほうが高い値を示し、野生株の暗条件および葉緑体ATP合成酵素欠損株という「光合成で作られるATPがほとんどない条件」においてその差は縮まった。これらのことから、ルシフェラーゼキットでは、細胞破砕物中に含まれる、葉緑体由来ATPなどを全て検出しているのに対して、繊毛打頻度法では細胞質に存在するATPのみを検出しているためにこのような差が生まれることがわかった。
この方法の利点の1つはその迅速さである。例えば、ミトコンドリアの呼吸活性が細胞質のATP濃度に与える影響を調べたところ、呼吸阻害剤で細胞を処理すると、1分以内にATP濃度が約20%程度低下した。また、光合成阻害剤で処理すると、同様に1分以内に約50%低下した。興味深いことに、この光合成阻害剤によるATP濃度の低下は5~10分でほぼもとのレベルまで解消された。この解消は呼吸活性阻害剤を加えておくと抑制されることから、細胞内で光合成活性が低下すると呼吸活性を向上させて細胞質ATP濃度を保とうとする調節経路、言い換えれば葉緑体とミトコンドリアの間の情報クロストークが、短時間で活性化すると考えられる。
今後の展開
クラミドモナスは光合成や呼吸などのATP合成経路の研究に使われているため、今回開発した方法は、さまざまな阻害剤の効果や、あるいはこれらの経路に異常をもつ変異株の原因遺伝子の細胞質ATP量への寄与の定量に用いることができる。さらに、繊毛を生(は)やす他の生物でも、クラミドモナスの場合の条件検討方法を参考に事前に除膜細胞モデル実験条件を調べることで、ATP濃度推定が行えるであろう。広い生物学の領域で利用できる汎用性の高い手法として使われることが期待される。
謝辞
本研究は、科学研究費補助金基盤B(JP19H03242)、挑戦的研究(萌芽)(JP16K14752)、新学術領域研究「新光合成:光エネルギー変換システムの再最適化」(JP16H06556)、大隅基礎科学創成財団(2-G0008)、人・環境と物質をつなぐイノベーション創出ダイナミック・アライアンスの支援を受けて行われた。
- 用語説明
[用語1] 非侵襲的 : 生体を傷つけたり負担をかけたりせずに検査すること。
[用語2] 軸糸 : 繊毛の内部構造。原生生物からヒトまで多くの生物で共通して、9組の二連微小管が2本の中心微小管を取り囲む「9+2構造」をもつ。
[用語3] 微小管 : チューブリンというタンパク質の二量体(チューブリンダイマー)が重合してできた、直径約25 nmの中空の繊維。多くの場合、縦方向にチューブリンダイマーが1列に並んだもの(素繊維)が13本筒状に組み合わさっている。二連微小管は、13本から成るA小管に加えて、10本の素繊維から成るB小管が組み合わさり、2本の筒が結合したもの。
[用語4] モータータンパク質ダイニン : ATPの加水分解エネルギーを使って構造変化し、微小管の上を動くモータータンパク質の一種。繊毛を動かすダイニンは、運動活性の異なるものが主として8種類存在し、それぞれ二連微小管のA小管上の決まった位置に、長さ方向に96 nmの周期を作って結合している。そして、隣接する二連微小管のB小管に対して滑ることで、二連微小管間にたわみを生じさせ、これが繊毛運動の原動力となる。
[用語5] ミカエリス・メンテン式 : 酵素の反応速度を示す関係式。反応速度v、反応産物の濃度[P]、基質の濃度[S]、基質濃度無限大のときの最大反応速度Vmax、最大反応速度の半分の速度を与える基質濃度(ミカエリス・メンテン定数)をKmとしたとき、v=d[P]/dt=Vmax[S]/(Km+[S])で表される。本研究の場合、反応速度は繊毛打頻度(1秒あたりの繊毛打の回数)、基質濃度はATP濃度であり、VmaxとKmを実験により求めることができる。
[用語6] クラミドモナス : 緑藻綱に属する単細胞生物。2本の繊毛を使って水中を泳ぎ回り、細胞体に存在する赤い点「眼点」で光を感受して走光性を示し、細胞体の体積の半分を占める葉緑体で光合成を行うという、動物と植物の特徴を併せ持つ。遺伝子導入が可能であること、ゲノム情報が公開されていること、培養が容易であることなど、実験生物としての多様な利点をもつ。繊毛運動、光合成、光反応行動など、多様な研究分野においてモデル生物と見なされている。
[用語7] 解糖系 : 細胞質ゾルでグルコースを他の代謝反応に使われる物質に分解する複数の酵素で構成される反応系。ほとんどの生物がもつ原始的な代謝系である。
[用語8] ルシフェラーゼ : ホタルや海産生物などで見られる発光現象において、発光物質ルシフェリンが光を放つ化学反応を触媒する酵素。ホタルのルシフェラーゼはこの化学反応にATPを必要とする。このため、高感度にATPを測定するATP検出キットにはホタル由来のルシフェラーゼが用いられる。
[用語9] センサータンパク質 : 目的物質の濃度、環境の変化に応じて光の強さや色が変化するように設計された蛍光・発光タンパク質。
[用語10] 発光基質 : ルシフェラーゼの基質となり、酵素反応によって光を放つ小分子化学物質。
- 論文情報
| 掲載誌 : | Journal of Biological Chemistry |
|---|---|
| 論文タイトル : | Rapid estimation of cytosolic ATP concentration from the ciliary beating frequency in the green alga Chlamydomonas reinhardtii |
| 著者 : | Wakako Takano, Toru Hisabori, and Ken-ichi Wakabayashi |
| DOI : | 10.1074/jbc.RA120.015263 |
- ボルボックスの鞭毛が機能分化していることを発見|生命理工学系 News
- 藻類の「眼」が正しく光を察知する機能を解明|生命理工学系 News
- 鞭毛モーターの規則的配列機構を解明 -鞭毛を動かす"エンジン"が正しい間隔で並ぶ仕組み発見-|東工大ニュース
- 久堀・若林研究室
- 研究者詳細情報(STAR Search) - 若林憲一 Ken-ichi Wakabayashi
- 研究者詳細情報(STAR Search) - 久堀徹 Toru Hisabori
- 科学技術創成研究院 化学生命科学研究所
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 化学生命科学研究所
准教授 若林憲一
E-mail : wakaba@res.titech.ac.jp
Tel : 045-924-5235 / Fax : 045-924-5268