生命理工学系 News
サリドマイドが手足や耳に奇形を引き起こすメカニズムを解明
安全なサリドマイド系新薬の開発へ
要点
- サリドマイドは胎児に催奇形性を示す薬剤ですが、サリドマイドはp63というタンパク質の分解を誘導することで手足や耳の発生を阻害していることがゼブラフィッシュのモデル実験系により明らかとなりました。
- サリドマイドは本研究グループが以前に同定したサリドマイド標的タンパク質、セレブロンに結合し、セレブロンの働きを乗っ取ることで、p63の分解を誘導します。
- 本成果により、サリドマイド催奇形性の詳細なメカニズムが判明しました。本研究の知見を活かして、サリドマイドの副作用を軽減した新薬が開発されることが期待されます。
東京医科大学 ナノ粒子先端医学応用講座(現・ケミカルバイオロジー講座)の半田宏特任教授(東京工業大学 名誉教授)および伊藤拓水准教授、東京工業大学 生命理工学院の山口雄輝教授(生命理工学コース主担当)、イタリア ミラノ大学のルイーサ・ゲリーニ(Luisa Guerrini)博士らの国際共同研究グループは、サリドマイドの深刻な奇形がp63というタンパク質の分解によって引き起こされることを明らかにしました。
研究グループは2010年、セレブロンというタンパク質がサリドマイドの主要な細胞内標的因子であることを明らかにし、その後の研究から、セレブロンがサリドマイドの多様な薬効の発現に不可欠であることが証明されました。セレブロンはタンパク質の分解を司るユビキチンリガーゼ[用語1]の構成因子であり、サリドマイド系の化合物がセレブロンに結合するとセレブロンの基質特異性が変化して、通常は分解されないタンパク質が分解されるようになります。このように、薬剤依存的に分解されるタンパク質をセレブロンの「ネオ基質」と呼びますが、サリドマイドの催奇形性に関わるネオ基質は未解明でした。
研究グループは本研究で、サリドマイドの催奇形性に関わるネオ基質がp63というタンパク質であることを見出しました。p63タンパク質には大小の2つのタイプがありますが、胎児の発生過程で小さい方が手足の形成に、大きい方が耳の形成に重要な役割を果たしています。脊椎動物のモデル生物であるゼブラフィッシュを用いた解析により、サリドマイドがセレブロンに結合するとp63の大小両方の分解が誘導され、その結果、手足や耳の奇形が引き起こされることが明らかとなりました。
近年、サリドマイド骨格をもつ医薬品の研究開発が精力的に進められていますが、催奇形性のないサリドマイド系化合物はいまだに見つかっておらず、それらの処方は各国の法規に基づく厳格な統制のもと行われています。本研究によりp63の分解が副作用の原因であることが判明しました。p63の分解を誘導しないサリドマイド系化合物を探索することにより、安全性の高い新薬の開発が可能になると考えられます。
研究の背景
サリドマイドは、1950年代に鎮静剤として開発され、日本を含む40数ヵ国で販売されました。しかし、妊娠初期の女性が本薬剤を服用すると胎児の手足や耳などに奇形が生じたことから、世界的な薬害事件に発展し、サリドマイドは1960年代前半に市場から撤退しました。しかしその後、サリドマイドはハンセン病や血液がんの一種である多発生骨髄腫などの難治性疾患に対して優れた治療効果を示すことが分かり、厳格な統制の下での投与が再び認可されるに至りました。しかし、サリドマイド催奇形性のメカニズムは長い間謎に包まれていました。
研究グループは独自技術を用いた薬剤標的因子の探索・同定に長年携わり、2010年にはサリドマイドの主要な細胞内標的因子がセレブロン(CRBN)というタンパク質であることを突き止めました(Science 2010)。セレブロンはタンパク質分解に関わるユビキチンリガーゼという酵素の構成因子です。その後の研究から、サリドマイド系の化合物がセレブロンに結合するとセレブロンの基質特異性が変化して、通常は分解されないタンパク質が分解されるようになることが明らかとなりました。たとえば最近、研究グループは、CC-885というサリドマイド系化合物がセレブロンに結合するとGSPT1というタンパク質の分解が引き起こされ、このことがCC-885の急性白血病に対する治療効果に関わっていることを見出しました(Nature 2016)。GSPT1のようなタンパク質をセレブロンの「ネオ基質」と呼びます。しかし、サリドマイドの催奇形性に関わるセレブロンのネオ基質は未発見でした。
本研究で得られた結果・知見
イタリア・ミラノ大学のルイーサ・ゲリーニ博士は長年にわたって手足や耳の発達を担うp63タンパク質の研究を行ってきました。東京医科大学と東京工業大学の研究グループとゲリーニ博士はp63とサリドマイド催奇形性の関係を検証するために国際共同研究を開始しました。
まずヒト培養細胞を用いた研究により、サリドマイドによってp63の分解が誘導されることや、この分解にはセレブロンによるp63のユビキチン化が関わっていることなどを明らかにしました。
次に、p63が実際にサリドマイドの催奇形性に関与するかどうかについて、ゼブラフィッシュを用いた解析を行いました。p63には大小2つのタイプ(TAp63とΔNp63)が存在しますが、サリドマイドに耐性を与える点変異をもった変異体タンパク質をゼブラフィッシュに強制発現させたところ、TAp63変異体の発現はサリドマイド処理による耳の奇形を抑制し、ΔNp63変異体の発現はサリドマイド処理による胸びれ(手足に相当)の奇形を抑制するという結果が得られました。
過去の研究結果から、TAp63は聴覚の形成に関わることが知られていましたが、本研究によりサリドマイドはTAp63の下流にある聴覚形成関連因子Atoh1の発現を抑制することが分かりました。一方、ΔNp63は手足・胸びれの形成に必須な増殖因子、Fgf8の発現を制御していますが、本研究によりサリドマイドはΔNp63の下流にあるFgf8の発現も抑制することが分かりました。以上の結果から、手足や耳の奇形は、サリドマイドと結合したセレブロンがTAp63とΔNp63の分解を誘導することにより引き起こされるという結論が得られました。
今後の研究展開および波及効果
本研究はサリドマイドの催奇形性に関わるセレブロンのネオ基質がp63であることを明らかにしたものであり、サリドマイド催奇形性に関する長年の謎の解明を一層推し進めるものです。近年、サリドマイド骨格をもつ医薬品の研究開発が精力的に進められており、例えば米国セルジーン社が開発した抗がん剤レブラミドとポマリストは合わせて年間1兆円の世界売上をあげています。しかしこれまでは副作用に関与するネオ基質が不明だったため、催奇形性のない薬剤の開発は困難でした。本研究の成果により、p63の分解を誘導しない安全なサリドマイド系新薬の開発が今後期待されます。
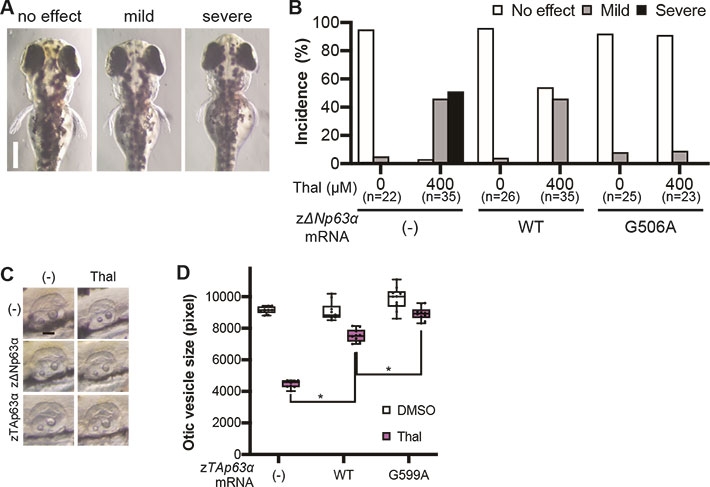
- 図1.A. ゼブラフィッシュにおけるサリドマイド催奇性の指標。 B. ゼブラフィッシュ胚にサリドマイド(Thal)処理をすると40%以上の個体に深刻な胸びれ形成異常が生じるが、サリドマイドによる分解を受けないΔNp63 G506A変異体を発現させると、胸びの異常が抑えられる。なお野生型ΔNp63の過剰発現でも部分的に奇形は抑えられる。C. サリドマイド処理により耳の形成不全が生じるが、 野生型のTAp63の過剰発現で抑えられる。サイズを計測したところ、サリドマイドによる分解を受けないTAp63 G599A変異体を発現するゼブラフィッシュでは耳の形成不全は抑えられていた。
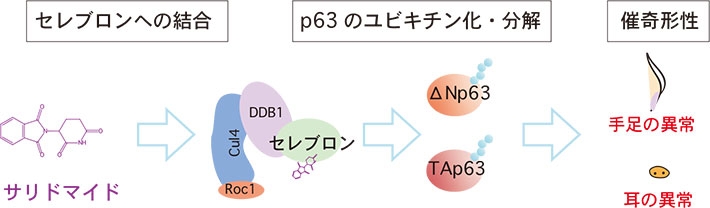
- 図2.サリドマイド催奇形性のモデル図。まずサリドマイドがセレブロン(CRBN)に結合すると新たにp63タンパク質(ΔNp63、TAp63)を認識し、分解を誘導する。ΔNp63が分解されると四肢・胸びれの形成に重要なFgf8などの発現が低下し、手足の奇形が引き起こされる。一方、TAp63が分解されると、聴覚神経の形成に重要なAtoh1などの発現が低下し、耳の形成異常が引き起こされる。
- 論文情報
| 掲載誌 : | Nature Chemical Biology |
|---|---|
| 論文タイトル : | p63 is a cereblon substrate involved in thalidomide teratogenicity |
| 著者 : | Tomoko Asatsuma-Okumura, Hideki Ando, Marco De Simone, Junichi Yamamoto, Tomomi Sato, Nobuyuki Shimizu, Kazuhide Asakawa, Yuki Yamaguchi, Takumi Ito, Luisa Guerrini* & Hiroshi Handa*(*共同責任著者) |
| DOI : | 10.1038/s41589-019-0366-7 |
主な競争的研究資金
文部科学省 科学研究費補助金 基盤研究(S)17H06112(半田宏、山口雄輝)
文部科学省 科学研究費補助金 新学術領域研究(研究領域提案型)18H05502(伊藤拓水)
文部科学省 国立研究開発法人科学技術振興機構 戦略的創造研究推進事業 個人型研究(さきがけ)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」(伊藤拓水)
ケミカルバイオロジー講座(旧・ナノ粒子先端医学応用講座)
東京医科大学に発足した産学連携講座であり、米国セルジーン社がスポンサーを務めています。
- 用語説明
[用語1] ユビキチンリガーゼ : ヒトが誕生し成長し死を迎えるように、タンパク質にも合成から分解に至るまでの一生がある。生命活動を行っていく上で、個々のタンパク質の分解は合成と並んで大変重要である。この分解過程に関わる酵素の一種がユビキチンリガーゼである。この酵素は、分解すべきタンパク質にユビキチンと呼ばれる廃棄処理用の目印をくっつける役割を果たす。
- サリドマイドの標的タンパク質セレブロンが脳の神経幹細胞の増殖を制御することを解明|生命理工学系News
- 転写時のRNAの長さを制御する仕組みが明らかに ―がん化のメカニズム解明につながると期待―|東工大ニュース
- 過剰な炎症反応を抑える仕組みを解明 -関節リウマチなど自己免疫疾患の病態が明らかに-|東工大ニュース
- サリドマイド催奇性における主要な標的因子を発見|山口研究室
- 半田研究室|ケミカルバイオロジー講座|東京医科大学
- 山口研究室
- 研究者詳細情報(STAR Search) - 半田宏 Hiroshi Handa
- 研究者詳細情報(STAR Search) - 山口雄輝 Yuki Yamaguchi
- 生命理工学院 生命理工学系
- 東京医科大学
- 研究成果一覧
お問い合わせ先
東京医科大学 ケミカルバイオロジー講座
特任教授 半田宏
E-mail : hhanda@tokyo-med.ac.jp
Tel : 03-5323-3250
東京工業大学 生命理工学院
教授 山口雄輝
E-mail : yyamaguc@bio.titech.ac.jp
Tel : 045-924-5798