生命理工学系 News
メタゲノム・メタボローム解析により大腸がん発症関連細菌を特定
便から大腸がんを早期に診断する新技術
研究成果のポイント
- 大腸がんの発がんに関連する細菌を発見
- 健常者、多発ポリープ(腺腫)、粘膜内がん[用語1]、早期がん、進行がんを対象(616例)に、便を用いてメタゲノム解析[用語2]とメタボローム解析[用語3]を行うことにより、健常者と比較してがんの進行段階で増減している細菌や代謝物質を同定
- 大腸がんの早期診断や予防、大腸がんになる前に治療を行う(先制医療[用語4])への応用に期待
概要
東京工業大学 生命理工学院 生命理工学系の山田拓司准教授(生命理工学コース主担当)と大阪大学 大学院医学系研究科の谷内田真一教授(がんゲノム情報学、前国立がん研究センター研究所 ユニット長)、東京大学 医科学研究所 ヒトゲノム解析センター ゲノム医科学分野(国立がん研究センター研究所 兼任)の柴田龍弘教授、慶應義塾大学先端生命科学研究所の福田真嗣特任教授らの研究グループは、多発ポリープ(腺腫)や大腸がんの患者さんを対象に、凍結便を収集しメタゲノム解析やメタボローム解析を行いました。その結果、多発ポリープ(腺腫)や非常に早期の大腸がん(粘膜内がん)患者さんの便中に特徴的な細菌や代謝物質を同定しました。
これまで進行大腸がんの患者さんの便を用いたメタゲノム解析により、これらの進行大腸がんに特徴的な細菌は特定されていましたが、前がん病変である腺腫や粘膜内がん、すなわち大腸がんの発症のごく初期に関連する細菌については解明されていませんでした。
今回、谷内田教授らの研究グループは、メタゲノム解析により健常者と比較して、前がん病変や粘膜内がんを有する患者さんの便に特徴的な細菌を特定したことに加えて、メタボローム解析を行うことにより病期(病気の進行具合)に伴う腸内代謝物質の変動も検討し、大腸がん発症に関連する腸内環境を明らかにしました。これにより、大腸がんを発症しやすい腸内環境が明らかとなり、大腸がんの予防につながる食事等の生活習慣や腸内環境を改善することにより大腸がんを予防する先制医療が期待されます。
本研究成果は、米国科学誌「Nature Medicine」に、 6月7日(金)0時(日本時間)に公開されました。
研究の背景
大腸がんは胃がんを抜き、日本では一番多いがんとなりました。食事など生活習慣の欧米化がその原因と考えられていますが、そのメカニズムは明らかではありません。
ヒト一人の細胞数は約37兆個で、ヒト一人あたりの腸内細菌数はおよそ40兆個と言われ、重さにして約1~1.5 kgとされています。これらの腸内細菌叢の乱れが炎症性腸疾患など様々な疾患と関係することが、最近になって分かってきました。2012年に、口腔内で歯周病の原因菌として知られるFusobacterium nucleatum(フソバクテリウム・ヌクレアタム)が、大腸がんの患者さんの便中に特徴的に多数存在することが報告され、これまでに検証されています。
大腸がんは、大腸ポリープ(腺腫)、粘膜内がんを経て進行がんへと進展します(多段階発がん)(図1)。これまで、進行した大腸がんにおいて関連する細菌はいくつか特定されてきましたが、進行がんになる前のステージで、大腸ポリープ(腺腫)や粘膜内がんと関連する細菌や代謝物質は知られていませんでした。
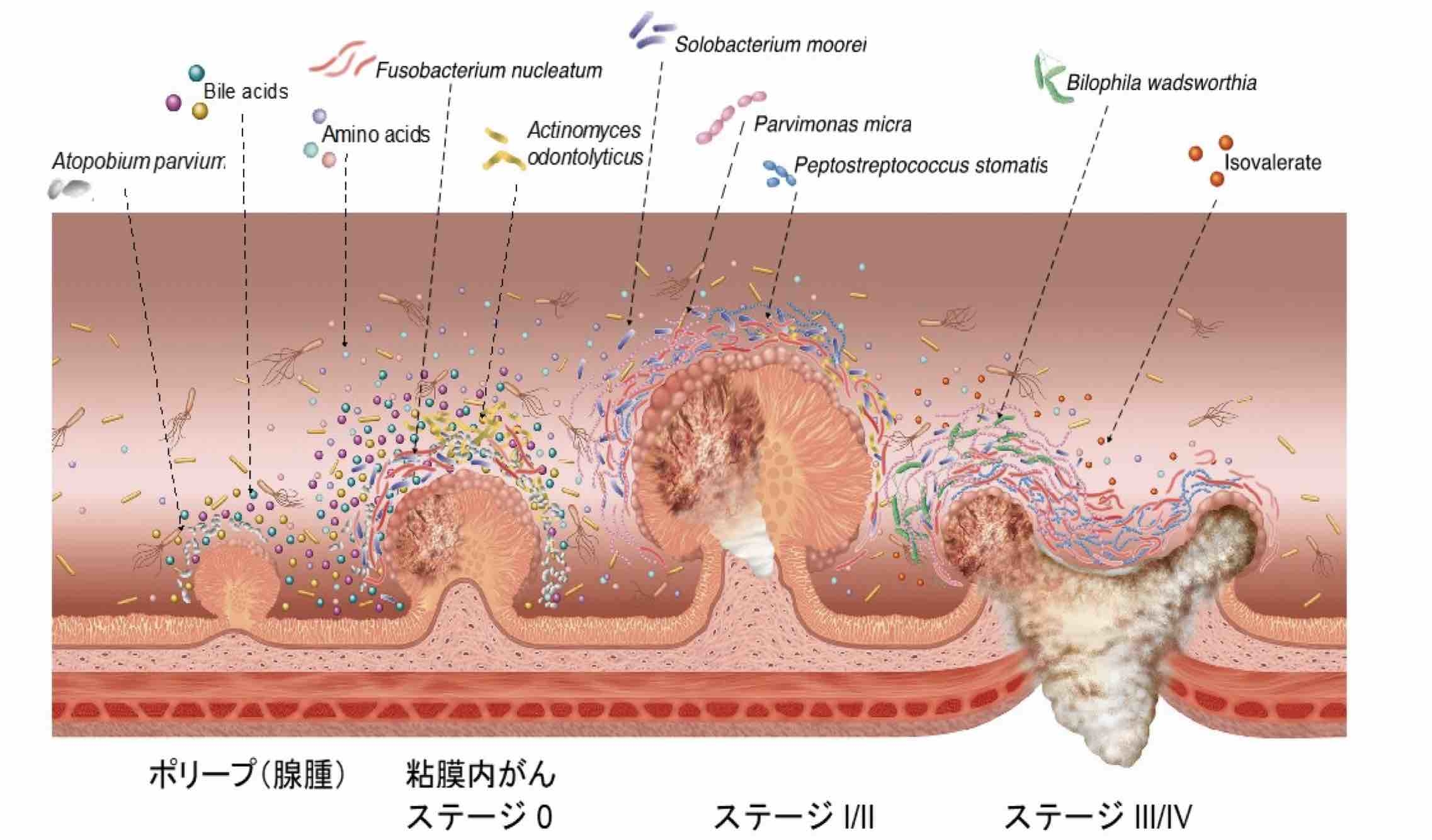
図1. がんの多段階発がんと腸内環境の変動
ポリープ(腺腫)から粘膜内がん、比較的早期のがん(Stage I/II)、進行がん(Stage III/IV)へと進むにつれて、増殖する細菌や代謝産物(Bile acids:胆汁酸、Amino acids:アミノ酸、Isovalerate:イソ吉草酸など)はダイナミックに変動する。本研究では、大腸がんの初期(腺腫・粘膜内がん)に関連する細菌や代謝物質が新たに特定された。
本研究の成果
研究グループでは、国立がん研究センター中央病院 内視鏡科(斎藤豊科長)を受診し、大腸内視鏡検査(大腸カメラ)を受けた616名の受検者を研究対象としました。食事等の「生活習慣などに関するアンケート」調査、凍結便、大腸内視鏡検査所見などの臨床情報を収集しました。東京工業大学(山田拓司准教授ら)や慶應義塾大学先端生命科学研究所(福田真嗣特任教授ら)と共同で、凍結便からメタゲノム解析とメタボローム解析を行い、がんのステージごとに腸内環境の特徴を調べました。
その結果、がんのステージによって便中に増減している腸内細菌が大きく異なることが分かりました(図1)。特に大腸がんの多段階発がん過程において、大腸がんと関連する細菌について大きく二つのパターンに分けることができました。
第一は、粘膜内がんの病期から増加し、病気の進行とともに上昇する細菌です。多くはFusobacterium nucleatumやPeptostreptococcus stomatis(ペプトストレプトコッカス・ストマティス)など、既に進行大腸がんで上昇していることが報告されている細菌です。
第二は、多発ポリープ(腺腫)や粘膜内がんの病期でのみ上昇している細菌として、Atopobium parvulum(アトポビウム・パルブルム)やActinomyces odontolyticus(アクチノマイセス・オドントリティカス)が特定され(図2)、これらの細菌が大腸がんの発症初期に関連することが強く示唆されました。
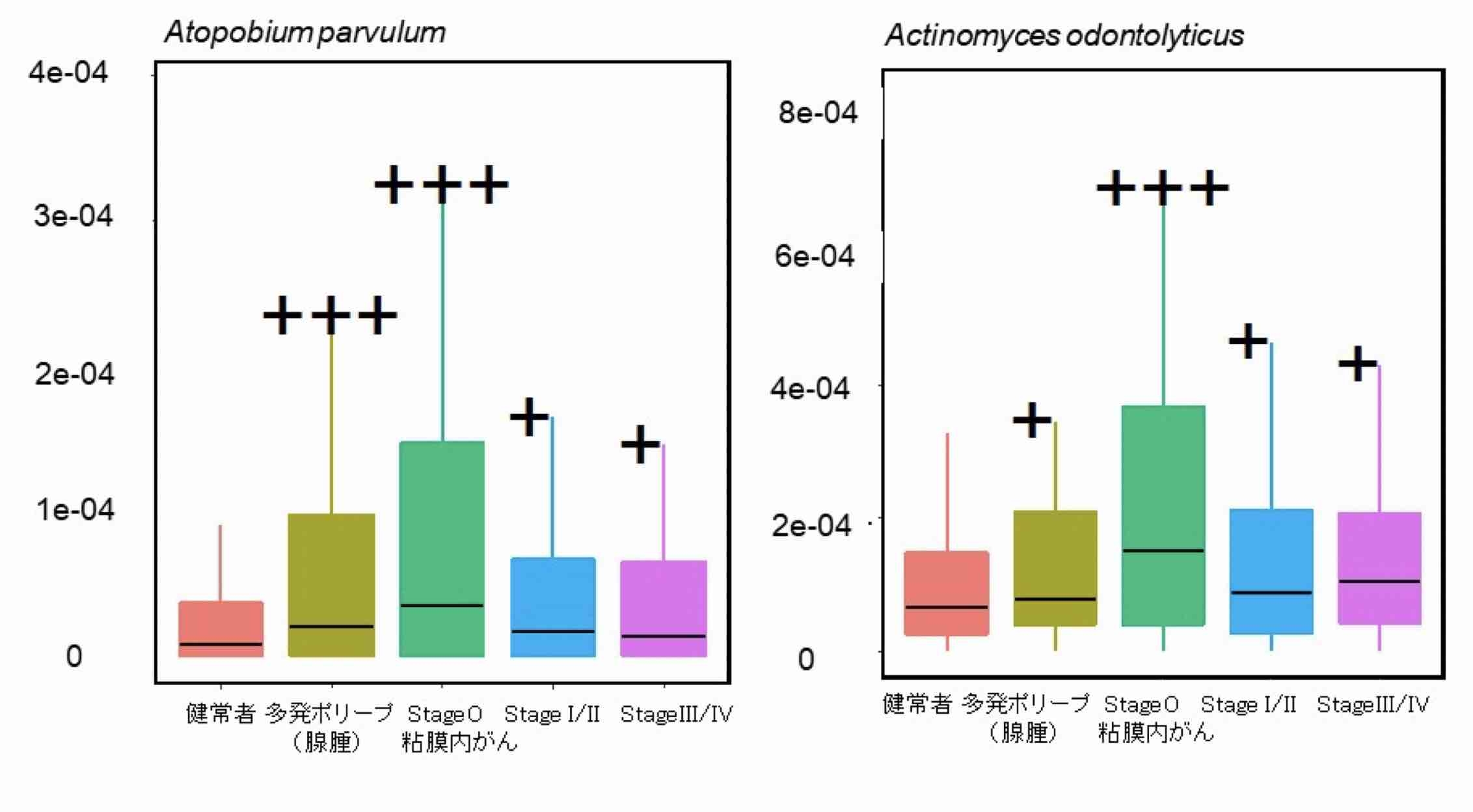
図2. 発がんの早期(腺腫や粘膜内がん)に増加し、がんの進行とともに減少する細菌(代表例)
健常者と比較した場合の有意差検定 +:P<0.05、++:P<0.01、+++:P<0.005(縦軸は便中の細菌相対量を示す)
Bifidobacterium属(ビフィズス菌)の細菌群は、粘膜内がんの病期で減少していました。また酪酸[用語5]産生菌として知られるLachnospira multipara(ラクノスピラ・マルチパラ)やEubacterium eligens(ユウバクテリウム・エリゲンス)は、粘膜内がんの病期から進行大腸がんに至るまで減少していました。
さらにメタボローム解析により、腸内細菌などによる代謝物質を大腸がんのステージごとに解析しました。その結果、多発ポリープ(腺腫)を有する患者さんには、デオキシコール酸という胆汁酸が腸管内に多いことが明らかとなりました。また粘膜内がんを有する患者さんは、健常者と比較して、アミノ酸であるイソロイシン、ロイシン、バリン、フェニルアラニン、チロシン、グリシンが便中に増加していました。一方、分枝鎖脂肪酸であるイソ吉草酸[用語6]は進行大腸がんで増加していました(図3)。
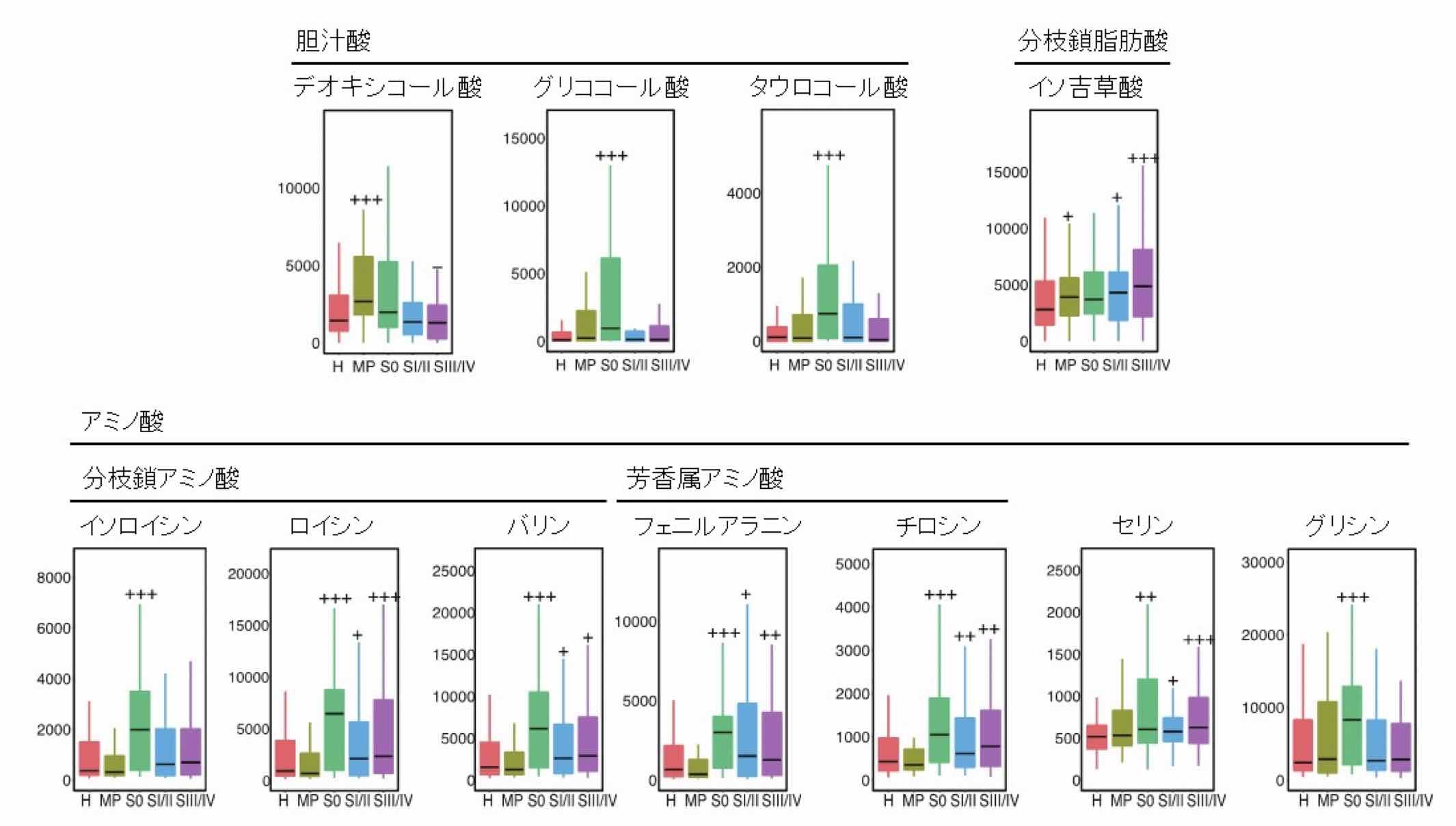
図3. 大腸がんの多段階発がんと代謝物質(代表例)
アミノ酸のうち分枝鎖アミノ酸(イソロイシン、ロイシンとバリンの3種類)と芳香属アミノ酸であるフェニルアラニンとチロシンは、粘膜内がん(S0)の病期で特に増加しているのが特徴的である。胆汁酸のうち二次胆汁酸であるデオキシコール酸は多発ポリープ(MP)、一次胆汁酸であるグリココール酸やタウロコール酸は粘膜内がん(S0)の病期で増加している。一方、分枝鎖脂肪酸であるイソ吉草酸は進行大腸がんで増加している。(縦軸は便中の代謝物質量のnmol/gを示す)
<略字> H:健常者、MP:多発ポリープ(腺腫)、S0:粘膜内がん、SI/II:Stage IとStage II、SIII/IV:Stage IIIとStage IV
これらの大量のメタゲノム解析とメタボローム解析のデータを組み合わせ、腸内細菌、腸内細菌由来遺伝子と腸内代謝物質から、粘膜内がんの患者さんを便で診断するための機械学習モデルを作成しました。このモデルでは、フェニルアラニンの合成に関与する遺伝子やDesulfovibrio longreachensis(デスルホビブリオ・ロングリーチェンシス)、Solobacterium moorei(サロバクテリウム・ムーレイ)などの細菌、ロイシン、バリン、フェニルアラニンなどのアミノ酸が寄与していました(特許出願中)。
また、進行大腸がんの患者さんを便で診断するための機械学習モデルも作成しました。こちらのモデルでは、主に細菌(Parvimonas micra(パルビモナス・ミクラ)、Peptostreptococcus stomatis、Fusobacterium nucleatumやPeptostreptococcus anaerobius(ペプトストレプトコッカス・アナエロビウス))が寄与していることが分かりました。
このように同じ大腸がんにおいても、病気の進行度に伴い、腸内細菌や腸内代謝物質は大きく異なることが明らかになりました。加えて、メタゲノム解析とメタボローム解析を用いて「日本人健常者の腸内環境」も解明されました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、個々人の腸内細菌叢の違いにまで踏み込んでがん予防や治療選択を行う「Microbiome-Based Precision Medicine」時代の幕開けになると考えています。また、食事などの生活習慣との関係を詳細に検討することにより、科学的根拠を踏まえた新たながん予防・治療、それに付随する産業(食品等)など、新たな需要の掘り起こしと成長分野を生み出す潜在性があります。
研究者のコメント
山田拓司准教授
本研究プロジェクトが目指す所は大腸がんの予防、治療、早期発見、作用機序の理解、など実際に実現させるにはまだまだ多くの壁があります。しかしながら、本研究報告は大腸がんと腸内細菌の関わりの一部を明らかにすることができました。ヒト腸内環境は複雑であり、その理解には多くの研究グループが協力して行うチーム型研究を進めることが必須です。本研究は臨床現場の医師、情報解析を行うデータ解析班、そして実際の実験を行う実験チームのそれぞれがうまく協力体制をとることができました。今後も多くの分野と融合していくことで大きな研究へと発展させていきたいと考えています。
谷内田真一教授(大阪大学)
メタゲノム研究は米国にはHMP(Human Microbiome Project)、欧州にはMetaHIT(Metagenomics of Human Intestinal Tract)という国を挙げた巨大プロジェクトがあり、本邦は後塵を拝してきました。がんは「ヒトゲノム(遺伝子)」の病気であるとともに「微生物」の病気であることが解明されつつあります。「がんゲノム医療」が注目されていますが、ヒトゲノムだけでなく、ヒトに住む微生物のゲノムを調べることにより、新たながん予防や治療法の開発が期待されます。
用語説明
[用語1] 粘膜内がん : 大腸がんは大腸の粘膜から発生し、発生して初期の段階では粘膜内にとどまっているが、大きくなるにしたがって次第に粘膜下層、筋層、漿膜下層へと達する。早期大腸がんは、がんの浸潤が粘膜下層までにとどまっているがんで、粘膜内がんと粘膜下層がんに分けられる。粘膜内がんは粘膜にとどまっているごく早期のがんで転移の報告はない。粘膜内がんの場合、大きな手術の必要はなく大腸内視鏡(大腸カメラ)での治療が可能である。
[用語2] メタゲノム解析 : 環境(例えば腸管内の便)中の細菌群集からDNAを丸ごと抽出し、ゲノム配列を次世代シークエンサーで徹底的に解読し(全ゲノム ショットガンシークエンス解析と呼ぶ)、情報解析専門家が系統組成解析(どのような種類の細菌がいるか?)と機能解析(遺伝子配列からどのような機能を有する細菌がいるか?)を行う技術。
[用語3] メタボローム解析 : 糖やアミノ酸など体内にある代謝物質(メタボライト)数百種類以上の含有量を、質量分析計を用いて一度に丸ごと分析する成分分析技術。
[用語4] 先制医療 : 個人のゲノム(遺伝情報)、タンパク質、代謝物質等のバイオマーカーを用いて、将来起こりやすい病気を発症前に診断・予測し、介入するという予防医療。
[用語5] 酪酸 : 腸内細菌による発酵代謝によって腸管内で産生される主要な最終代謝物質である短鎖脂肪酸の一つ。短鎖脂肪酸は大腸の粘膜細胞の主要なエネルギー源であり、粘液の分泌を促進し腸管粘膜のバリア機能に関与。食物繊維が多い食事を摂ると酪酸が増加し、大腸炎を抑制することが近年、報告された。
[用語6] イソ吉草酸 : イソバレリアン酸とも呼ばれる。ごく低濃度では魚、貝、牛乳などの香気成分として香料に用いられるが、臭気を感知できる濃度は非常に低く、悪臭防止法で特定悪臭物質の規制対象となっている。
論文情報
| 掲載誌 : | Nature Medicine |
|---|---|
| 論文タイトル : | Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer |
| 著者 : | Shinichi Yachida1,2, Sayaka Mizutani3, Hirotsugu Shiroma3, Satoshi Shiba1, Takeshi Nakajima4, Taku Sakamoto4, Hikaru Watanabe3, Keigo Masuda3, Yuichiro Nishimoto3, Masaru Kubo3, Fumie Hosoda1, Hirofumi Rokutan1, Minori Matsumoto4, Hiroyuki Takamaru4, Masayoshi Yamada4, Takahisa Matsuda4, Motoki Iwasaki5, Taiki Yamaji5, Tatsuo Yachida6, Tomoyoshi Soga7, Ken Kurokawa8, Atsushi Toyoda9, Yoshitoshi Ogura10, Tetsuya Hayashi10, Masanori Hatakeyama11, Hitoshi Nakagama12, Yutaka Saito4, Shinji Fukuda7,13-15, Tatsuhiro Shibata1,16, Takuji Yamada3,15 |
| 所属 : |
1大阪大学 大学院医学系研究科 がんゲノム情報学 2国立がん研究センター 研究所 がんゲノミクス研究分野 3東京工業大学 生命理工学院 生命理工学系 4国立がん研究センター 中央病院 内視鏡科 5国立がん研究センター 社会と健康研究センター 疫学研究部 6香川大学 医学部 消化器・神経内科学 7慶應義塾大学先端生命科学研究所 8国立遺伝学研究所 ゲノム進化研究室 9国立遺伝学研究所 比較ゲノム解析研究室 10九州大学 大学院医学研究院 細菌学分野 11東京大学 大学院医学系研究科 医学部 病因・病理学専攻 微生物学講座 12国立がん研究センター(理事長) 13神奈川県立産業技術総合研究所 腸内細菌叢プロジェクト 14筑波大学 トランスボーダー医学研究センター 15科学技術振興機構 さきがけ 16東京大学 医科学研究所 ヒトゲノム解析センター ゲノム医科学分野 |
| DOI : | 10.1038/s41591-019-0458-7 |
加えて、本研究グループはイタリアのNicola Segataらの研究グループならびにドイツのGeorg Zellerらの研究グループと共同研究を行い、多国間で共通する進行大腸がんに特徴的な細菌群を同定しました。その成果により、便から大腸がんを予測する診断法を開発し、米国科学誌「Nature Medicine」の2019年4月号に発表しました。
| 掲載誌 : | Nature Medicine |
|---|---|
| 論文タイトル : | Metagenomic analysis of colorectal cancer datasets identifies cross-cohort microbial diagnostic signatures and a link with choline degradation |
| 著者 : | Andrew Maltez Thomas, Paolo Manghi, Francesco Asnicar, Edoardo Pasolli, Federica Armanini, Moreno Zolfo, Francesco Beghini, Serena Manara, Nicolai Karcher, Chiara Pozzi, Sara Gandini, Davide Serrano, Sonia Tarallo, Antonio Francavilla, Gaetano Gallo, Mario Trompetto, Giulio Ferrero, Sayaka Mizutani, Hirotsugu Shiroma, Satoshi Shiba, Tatsuhiro Shibata, Shinichi Yachida, Takuji Yamada, Jakob Wirbel, Petra Schrotz-King, Cornelia M. Ulrich, Hermann Brenner, Manimozhiyan Arumugam, Peer Bork, Georg Zeller, Francesca Cordero, Emmanuel Dias-Neto, João Carlos Setubal, Adrian Tett, Barbara Pardini, Maria Rescigno, Levi Waldron, Alessio Naccarati, Nicola Segata |
| DOI : | 10.1038/s41591-019-0405-7 |
| 掲載誌 : | Nature Medicine |
|---|---|
| 論文タイトル : | Meta-analysis of fecal metagenomes reveals global microbial signatures that are specific for colorectal cancer |
| 著者 : | Jakob Wirbel, Paul Theodor Pyl, Ece Kartal, Konrad Zych, Alireza Kashani, Alessio Milanese, Jonas S Fleck, Anita Y Voigt, Albert Palleja, Ruby P Ponnudurai, Shinichi Sunagawa, Luis Pedro Coelho, Petra Schrotz-King, Emily Vogtmann, Nina Habermann, Emma Niméus, Andrew M Thomas, Paolo Manghi, Sara Gandini, Davide Serrano, Sayaka Mizutani, Hirotsugu Shiroma, Satoshi Shiba, Tatsuhiro Shibata, Shinichi Yachida, Takuji Yamada, Levi Waldron, Alessio Naccarati, Nicola Segata, Rashmi Sinha, Cornelia M. Ulrich, Hermann Brenner, Manimozhiyan Arumugam, Peer Bork, Georg Zeller |
| DOI : | 10.1038/s41591-019-0406-6 |
なお、上記の研究は、日本医療研究開発機構(AMED)「医と食をつなげる新規メカニズムの解明と病態制御法の開発」、「地球規模保健課題開発推進のための研究事業 日米医学協力計画」、国立がん研究センター 研究開発費(25-A-4、28-A-4、29-A-6)、AMED-CREST「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」、JST戦略的創造研究推進事業「さきがけ」、日本学術振興会科研費、文部科学省科学研究費助成事業「新学術領域研究『学術研究支援基盤形成』」先進ゲノム解析研究推進プラットフォーム(先進ゲノム支援:PAGS)、東京大学医科学研究所共同研究拠点事業、大阪大学先導的学際研究機構生命医科学融合フロンティア研究部門、公益財団法人武田科学振興財団特定研究助成、公益財団法人鈴木謙三記念医科学応用研究財団調査研究の一環として行われ、ライフサイエンス統合データベースセンター 五斗進教授の協力を得て行われました。
- 腸内細菌叢(腸内フローラ)のメタゲノム解析による発がん研究の加速に期待 | 生命理工学系News
- ビフィズス菌が優勢になる乳児の腸内フローラ形成機構を解明―母乳に含まれるオリゴ糖の主要成分の利用がカギ― | 生命理工学系News
- 「JCHM第4回シンポジウム―日本人腸内環境の全容解明と産業応用プラットフォーム―」を実施 | 生命理工学系News
- 東工大生オリジナル 腸内細菌ボードゲーム「バクテロイゴ」販売中 | 生命理工学系News
- 腸内に住む菌の研究で大腸がんの早期発見法が見えてきた ― 山田拓司 | 研究ストーリー|研究
- 山田研究室
- 研究者詳細情報(STAR Search) - 山田拓司 Takuji Yamada
- 生命理工学院 生命理工学系
- 大阪大学 大学院医学系研究科 がんゲノム情報学
- 東京大学 医科学研究所 ヒトゲノム解析センター
- 慶應義塾大学先端生命科学研究所
- 研究成果一覧
お問い合わせ先
研究に関すること
東京工業大学 生命理工学院 生命理工学系
准教授 山田拓司
E-mail : takuji@bio.titech.ac.jp
Tel : 03-5734-3591 / Fax : 03-5734-3591