生命理工学系 News
転写抑制を介してアポトーシスが誘導されるメカニズムを解明
抗がん剤の薬効を左右する細胞内メカニズム解明につながる成果
要点
- TATAボックス結合因子ファミリーの一員であるTLPの転写抑制能がDNA損傷後のアポトーシス誘導に重要であることを発見
- TLPは転写抑制を介して損傷DNAの修復活性を低下させることでアポトーシス誘導を促すことが明らかに
- 発がんの仕組みや、がん細胞が治療に耐性を獲得する仕組みを解明するための手がかりに
概要
生命理工学院生命理工学系の山口雄輝教授、鈴木秀文研究員(日本学術振興会特別研究員PD)、田村隆明元千葉大学教授らの研究グループは、転写調節因子TLPによるゲノムワイドな転写抑制がDNA二本鎖切断によるアポトーシス誘導過程を制御していることを発見しました。
研究グループは、これまでTATAボックス結合因子(TBP)ファミリーの一員であるTLPというタンパク質の機能を研究してきました。TBPはmRNA合成に普遍的な役割を果たすタンパク質であり、TLPはTBPの働きを競合阻害することで転写を抑制する機能をもっています。これまでの研究から、TLPがDNAの二本鎖切断応答に重要な役割を担っていることが示唆されていましたが、そのメカニズムの詳細は不明でした。本研究では、TLPが転写抑制を介して損傷DNAの修復活性を低下させることで、DNA損傷を受けた細胞のアポトーシス誘導を促進していることを発見しました。この研究成果は、発がんメカニズムの解明や、エトポシドやドキソルビシンといったDNA二本鎖切断誘導型の抗がん剤に対してがん細胞が耐性を獲得するメカニズムの解明につながると期待されます。
本研究成果は2019年3月19日、英国のオンライン科学誌「Scientific Reports」に掲載されました。
研究の背景と研究成果
核内のDNAは様々な要因によって損傷を受けていますが、薬剤や放射線などへの曝露によって生じるDNA二本鎖切断は細胞にとって特に重篤なストレスとなります。DNA二本鎖切断は、Non-Homologous End Joining(NHEJ)とHomologous Recombination(HR)という2つの修復機構によって速やかに修復されます。しかしDNA修復が不十分な場合にはアポトーシスが誘導され、DNA損傷をもつ細胞が排除されることによって、細胞集団はゲノムの恒常性を維持しています。
TLPは、遺伝子発現の“開始”を調節するTBPファミリーに属するタンパク質の1つで、TBPの働きを競合阻害することで転写を抑制する機能をもっています。これまでの研究結果から、TLPがDNA損傷応答に関与していることがわかっていましたが、そのメカニズムの詳細はわかっていませんでした。近年、転写とDNA二本鎖切断修復が共役した核内イベントであることが明らかとなりつつあります。我々はTLPの転写抑制能がDNA二本鎖修復の調節とその後のアポトーシス誘導に関与しているのではないかと考えて解析を行い、TLPによるグローバルな転写抑制がDNA損傷細胞におけるアポトーシス誘導に重要であることを発見しました。
我々は、TLPノックダウン細胞と通常の細胞に対して抗がん剤エトポシドややドキソルビシンを処理してDNA二本鎖切断を引き起こし、DNA損傷後の転写活性やDNA修復速度、細胞生存率などを解析しました。転写活性の解析には4-チオウリジンによる新規合成RNA標識法を用いることで、DNA二本鎖切断後の転写活性の経時変化を高感度に解析しました。その結果、通常の細胞ではエトポシド処理により転写活性の顕著な低下が見られましたが、TLPノックダウン細胞では転写活性が高く維持されていました(図1)。このことから、二本鎖切断後の転写抑制においてTLPが重要な役割を担っていることが示唆されました。次に、エトポシド処理後の細胞生存率を調べたところ、TLPノックダウン細胞ではエトポシド処理後のアポトーシスが起こりにくく、DNA二本鎖切断後の生存率が高いことがわかりました。さらに、DNA二本鎖切断のマーカーであるγH2AXを指標にしてDNA修復にかかる時間を調べたところ、TLPノックダウン細胞では通常の細胞に比べてDNA二本鎖切断が速やかに修復されていることがわかりました(図2)。これらの結果から、DNA二本鎖切断後の転写活性が維持されているTLPノックダウン細胞では損傷DNAの修復活性が高く、DNA損傷ストレスに耐性を獲得していることがわかりました。
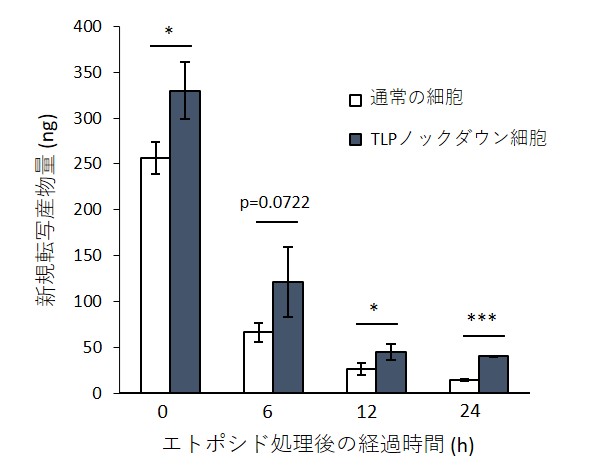
図1. 4sU-RNA標識法を用いた転写活性の解析。
TLPノックダウン細胞では通常の細胞に比べて転写活性が高く維持されている。
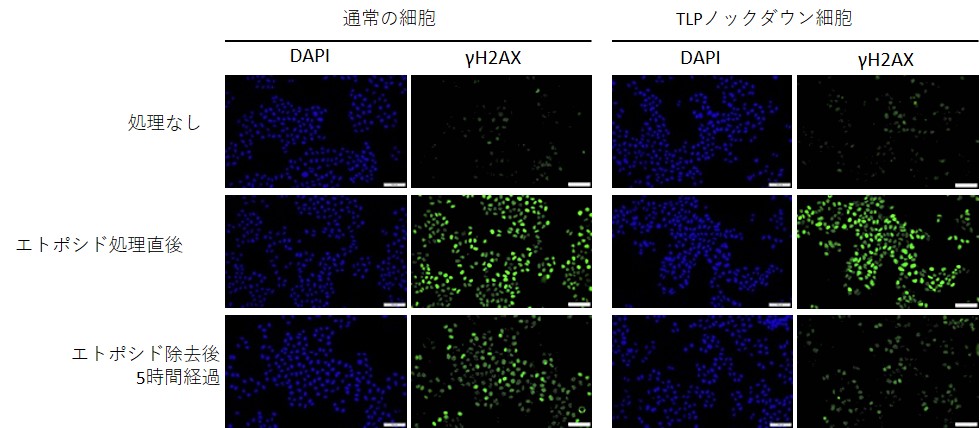
図2. γH2AXを指標にしたDNA二本鎖切断修復速度の解析。
TLPノックダウン細胞では通常の細胞よりも速やかにDNA二本鎖切断が修復される。
さらに、TLPノックダウン細胞が示す高い転写活性とDNA修復活性との関係性を示すため、転写阻害剤α-アマニチンを用いて転写をグローバルに阻害した状態でDNA修復活性を調べたところ、転写を阻害することによってDNA修復活性が低下するとともに、アポトーシス細胞が増加して細胞の生存率が低下しました。このことから、DNA二本鎖切断後の転写活性レベルが、DNA修復とその後のアポトーシス誘導を制御していることがわかりました。
以上の結果から、TLPは転写抑制を介してDNA修復を阻害することで、DNA二本鎖切断によるアポトーシス誘導を促していると考えられます(図3)。これまでTLPによる転写抑制の生理的意義は不明でしたが、転写とDNA二本鎖切断修復のクロストークにTLPの転写抑制能が重要であることを明らかにした点で、本研究成果はユニークであるといえます。
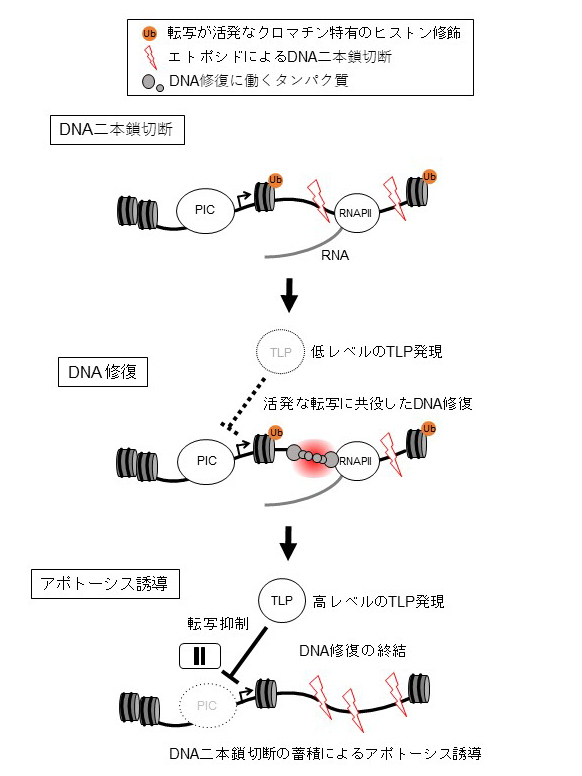
図3. DNA二本鎖切断によるアポトーシス誘導過程におけるTLPの役割を表したモデル図。
本研究成果の意義
TLPの発現異常はがんとの関連性が示唆されており、将来的には発がん予防やがん治療への応用が期待されます。例えば、一部のがんではTLPの発現量が低下していますが、TLP低発現がんでは抗がん剤や放射線による治療効果が弱いことが本研究から推察されます。より詳細な研究によって、TLPの発現状態にもとづいた最適ながん治療法の選択ができるようになる可能性があります。
論文情報
| 掲載誌 : | Scientific Reports |
|---|---|
| 論文タイトル : | TLP-mediated global transcriptional repression after double-strand DNA breaks slows down DNA repair and induces apoptosis |
| 著者 : | Hidefumi Suzuki, Mayumi Okamoto-Katsuyama, Tetsufumi Suwa, Ryo Maeda, Taka-aki Tamura & Yuki Yamaguchi |
| DOI : | 10.1038/s41598-019-41057-9 |