生命理工学系 News
免疫細胞活性化に重要な中心体移動の謎解明
中心体の移動が握る免疫制御
要点
- 免疫T細胞の活性化に必須の中心体[用語1]の移動機構を明らかにした
- 様々な生命現象に関わるモーター分子を制御する仕組みに新たな知見
- 免疫細胞の活性制御に関わる基礎的な仕組みの解明につながる
概要
東京工業大学 生命理工学院 生命理工学系のリム・ウェイ・ミン大学院生(当時)、伊藤由馬助教(生命理工学コース主担当)、十川久美子准教授(当時)、徳永万喜洋教授(生命理工学コース主担当)の研究チームは、免疫T細胞の活性化に必須な、中心体が細胞表面近くに引き寄せられる仕組みを明らかにした。
免疫システムの司令塔として働くリンパ球T細胞が、抗原を認識して活性化する際には、微小管[用語2]の集まる中心体が細胞表面側に移動することが知られていた。これにより、免疫を司る種々のサイトカインと呼ばれるタンパク質を細胞外に分泌したり、感染細胞やガン細胞を殺したり、T細胞の活性化自体を制御するという免疫応答がもたらされる。しかしながら中心体移動の機構は、よくわかっていなかった。
今回、複数種類のタンパク質分子を生きた細胞で同時に観察できる光学顕微鏡を使って、多種類の分子の働き方を明らかにした。微小管は、中心体を起点として細胞膜近くまで伸びているが、その上で働くタンパク質分子・CLIP-170[用語3]により、 モーター分子を中心体方向と細胞膜方向の両方向に移動させる新たな機構を発見した。これは、これまで一方向だけに動くとされていたモーター分子では新たな発見で、基盤的な働きをする分子モーターの関わる多くの生命機能の解明に、新たな展開をもたらすと期待される。
今年のノーベル生理学・医学賞で注目を集めるガン免疫療法の対象として受賞対象となった分子の一つは、この中心体移動により細胞表面に配置されることが知られており、免疫療法の進歩など将来的な応用に繋がることが期待される。
本研究成果は、英国のオンライン科学雑誌『Scientific Reports』にて、2018年11月28日に掲載された。
研究の背景と経緯
免疫細胞は、体を外敵から防御する免疫系として中心的な役割を担っている。病原菌・ウィルスや花粉などの異物が体内に侵入したことを察知すると、樹状細胞などの抗原提示細胞がそれらを取込み、抗原として細胞表面に提示する。リンパ球の1種であるT細胞は、提示された抗原を認識すると活性化し、免疫系の細胞間シグナル分子であるサイトカインを分泌したり、感染細胞やガン細胞を殺したり、抗体産生を促すなど免疫系を活性化する司令塔として働く。
抗原提示を受けたT細胞表面では、T細胞受容体が数十~数百分子集合した「マイクロクラスター[用語4]」と呼ばれる集合体が形成される。これは、抗原提示細胞との細胞接着面の中央領域に集まり「免疫シナプス[用語5]」と呼ばれる特徴的な構造を形成し、免疫応答の場として機能する。
細胞内部の核近くには、中心体(微小管形成中心)と呼ばれる小器官があり、細胞骨格である微小管が集まっている。微小管は中心体を起点として放射状に細胞周辺まで伸びる(図1)。T細胞が活性化されると、この中心体が免疫シナプスの中心近傍に移動する。
この中心体の移動は、T細胞が活性化されて種々の免疫応答を営むようになるために必要な現象だ。今年のノーベル生理学・医学賞は、免疫を制御するタンパク質の発見と、それを対象とした抗体医薬によるガンの免疫療法の開発に対して授与された。抗体医薬の対象タンパク質で受賞対象となった分子の1つにCTLA-4があるが、CTLA-4を細胞表面へ配置するには中心体移動が必要である。
中心体移動の仕組みは、これまで謎として残されていた。それは中心体移動には多くの種類の生体分子が関わり、それぞれ分子の動き・細胞内配置・分子間相互作用が時間的・空間的にダイナミックに変化していて、解明が容易ではなかったからだ。
研究の内容と成果
研究チームではこれまで、蛍光[用語6]を使って分子1個1個を光学顕微鏡で直接観察できる1分子イメージング顕微鏡を用いて、対物レンズ型全反射照明(TIRF)法[用語7]や薄層斜光照明(HILO照明)法[用語8]を開発してきた。
今回、複数種類のタンパク質分子を同時に生きた細胞で観察できる多色蛍光顕微鏡を使って、多種類の分子が織りなす中心体移動の仕組み解明を目指した。
まず、微小管に結合する分子に注目した。微小管は中心体を起点として細胞周辺へと伸長する。伸長先端であるプラス端に結合するタンパク質・CLIP-170はリン酸化[用語9]されることで、微小管の伸長を促進するタンパク質だ。CLIP-170のリン酸化を阻害したT細胞を刺激したところ、中心体は細胞膜の近くに来たが、免疫シナプスが形成される細胞接着面の中心近傍には移動しなかった(図2)。しかも、T細胞からはサイトカインIL2の放出はなかった。このことから、リン酸化されたCLIP-170は、中心体の免疫シナプス近傍への移動に必要不可欠であるとともに、T細胞の活性化に必須であることがわかった。
CLIP-170と他のタンパク質および中心体移動との関係を、多色蛍光顕微鏡を用いて調べた。CLIP-170と他のタンパク質とをそれぞれ蛍光で標識し同時観察し、2色の蛍光動画像を重ね合わせる(図2)。同様の場所に局在している割合や動く速さと向きについて、T細胞の刺激の有無による変化や中心体の移動とともに定量した。
その結果、中心体が細胞接着面の中心近傍に移動するには、T細胞への刺激と、CLIP-170のリン酸化との両方が必要であることがわかった。T細胞を刺激することでダイニン[用語10]は活性化され、微小管上を単独でマイナス端方向へ運動する。さらにCLIP-170がリン酸化されていると、ダイニンの一部がCLIP-170/ダイナクチン[用語11]複合体と結合し、微小管プラス端領域に結合し、プラス端方向へ移動する。マイナス端方向とプラス端方向の両方向への移動が共存することにより、ダイニンが細胞接着面の中央領域に集まり、その結果、中心体が中心近傍に移動し、T細胞が活性化されることを見い出した(図2)。
活性化したダイニンの速さは以前に報告されている中心体の移動速度と良く一致していたことから、細胞膜に固定されている活性化ダイニンが微小管を引き寄せ中心体を移動させていることが明らかとなった。
今後の展開
今回の成果は、生きた細胞で多種分子を同時に顕微鏡観察し、分子動態と相互作用を定量解析することが、従来解けなかった問題を解決する強力な手法であることを示している。
多様な働きをするダイニンは、最近解かれた構造と、多種分子との相互作用、多様な動態、機能との関係が解明されつつある。今回の新たな知見は、分子モーターが関わる多くの生命機能の解明につながると期待される。
今回明らかになった免疫活性化の仕組みは、ガン免疫療法における抗体医薬の対象タンパク質・CTLA-4の細胞表面への配置を制御するものだ。抗CTLA-4抗体は、既に承認されて治療が始まっている。従来の化学療法に比べて副作用は少ないとされているが、安全性への十分な配慮が必要となる。本成果は、より安全な治療法への進歩や、免疫制御の新しい操作方法への発展など、将来的な応用が期待される。
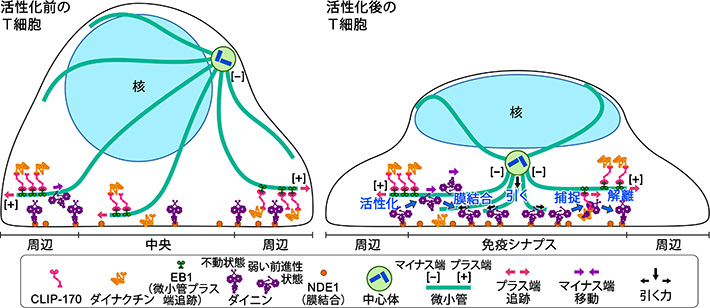
図1. 抗原刺激されたT細胞において中心体が細胞接着面の中心近傍に移動する仕組み
(左)抗原刺激を受けていない休止状態のT細胞では、中心体は細胞核の近傍にあり、微小管が放射状に細胞周辺へと伸長している。モーター分子・ダイニンのほとんどは細胞膜に結合して動かない状態にある。微小管プラス端集積因子であるCLIP-170は、休止状態のT細胞でもリン酸化されていて、プラス端領域に結合して微小管の伸長を追跡しプラス端方向へ動いている。CLIP-170とダイニンとはほとんど結合していない。
(右)抗原刺激を受けたT細胞では、ダイニンの一部が“活性化”され、ダイニン単独で微小管上をマイナス端方向に遅く動く「弱い前進性状態」[補足1]になる。前進運動の持続性は低く、1~2 μm(マイクロメートル)未満のマイナス端方向へ運動した後、アンカータンパク質(NDE1と推測される)との結合で“膜結合”して止まる。
これと並行して、ダイニンの少数の一部がCLIP-170/ダイナクチン複合体に“捕捉”され、微小管プラス端領域に結合しプラス端方向へ移動する [補足2]、[補足3]。この移動状態も安定ではなく、1~2 μmの追跡後、ダイニンは複合体から“解離”し、アンカータンパク質により膜結合して止まる。
マイナス端方向とプラス端方向の両方向への移動が共存することが重要で、ダイニンが細胞接着面の中央領域すなわち免疫シナプスに集まり、中心体が細胞接着面の中心近傍に移動し、T細胞が活性化される。
また、活性化された「弱い前進性状態」のダイニンの速さは以前に報告されている中心体の移動速度と良く一致した。このことと、微小管とダイニンの配置状態とは、細胞膜に固定されている活性化ダイニンが微小管を引き寄せ、その結果、中心体を移動させているという分子機構を示している。
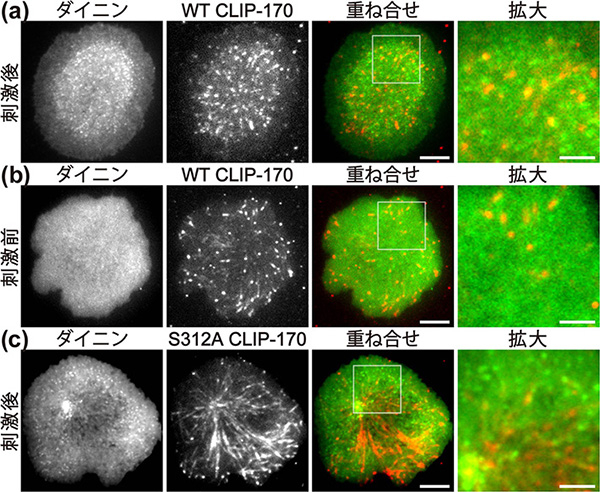
図2. 2色同時蛍光分子イメージングにより、中心体移動にはT細胞刺激とCLIP-170リン酸化の両方が必須であることが示された
緑色蛍光タンパク質GFPで標識したダイニン(左端)と、赤色蛍光タンパク質RFPで標識したCLIP-170(左から2番目)とを、Jurkat T細胞(ヒト白血病T細胞由来の細胞株)に発現させ、2色同時蛍光顕微鏡で、細胞接着面を観察した。白黒画像を蛍光色で着色したうえで重ね合せ(右から2番目)、正方形で示した領域を拡大表示した(右端)。輝点は分子が集合したクラスター。重ね合せで黄色に見える部分は、ダイニンとCLIP-170が共局在していることを示している。WTはwild typeの略で、変異体でない本来のままの分子のこと。S312Aは、リン酸化される312番目のセリンをアラニンに置換した変異体で、リン酸化されていない状態にある。図中のスケールバーは、重ね合せ画像が5 μm(右から2番目)、拡大図が2 μm(右端)。
一連の研究から次のことが分かった。
- 1.中心体が細胞接着面中心近傍に移動するには、T細胞への刺激とCLIP-170のリン酸化との両方が必要である。
- 2.両条件が揃うと、ダイニンは免疫シナプス領域である細胞接着面中央領域に集まる。
- 3.T細胞刺激のみで、ダイニンは活性化される。活性化ダイニンは、ダイニン単独で微小管上をマイナス端方向に動く「弱い前進性状態」にある。
- 4.T細胞刺激と共にCLIP-170がリン酸化されていると、ダイニンの一部がCLIP-170/ダイナクチン複合体と結合し、微小管上をプラス端方向へと伸長追跡により移動する。
- 5.その結果、ダイニンには、マイナス端方向へ移動と、プラス端方向へ移動との両方の動態が共存する。どちらかの移動を欠いても、ダイニンは細胞接着面中央領域に集まらず、中心体も中心近傍に移動しない。またサイトカインが産生されずT細胞が活性化されない。
関連動画
用語説明
[用語1] 中心体(centrosome) : 微小管の形成中心として働く細胞内小器官。微小管形成中心(microtubule-organizing centre)とも呼ばれる。通常、細胞1個に1個だけあり、核の近くに存在する。細胞分裂時に複製され、紡錘体の中心として働く。
[用語2] 微小管(microtubule) : 主要な細胞骨格の1つ。チューブリンと呼ばれるタンパク質が重合して形成される外径約25 nm(ナノメートル)の管状の構造。形態形成、細胞分裂、細胞内物質輸送、細胞運動など多様な役割を担っている。微小管は静的構造ではなく、伸長と短縮を繰り返しており、細胞内では中心体を起点として細胞周辺へと伸長してゆく。
[用語3] CLIP-170(cytoplasmic linker protein 170) : 微小管プラス端集積因子の1つであるタンパク質。リン酸化されていないCLIP-170は、プラス端領域に比較的安定に結合し、微小管の伸長速度を抑えるが、リン酸化CLIP-170はプラス端領域で速く結合解離し微小管の伸長を促進する。他の微小管プラス端集積因子のタンパク質であるEB1(end-binding protein 1)を介して微小管と結合。細長い形をしており、一方の端でEB1と結合し、他端でダイナクチンと結合する。
[用語4] マイクロクラスター : T細胞が活性化する際に、T細胞膜に形成されるT細胞受容体複合体(TCR/CD3)の数十~数百分子の集合体。シグナル伝達分子も結合する。T細胞受容体分子複合体が、抗原提示細胞により提示された抗原と結合すると、マイクロクラスターが形成される。これが起点となり、T細胞受容体シグナルが伝達され、T細胞が活性化される。マイクロクラスターは中心領域へ集積し、免疫シナプスを形成する。
[用語5] 免疫シナプス : 抗原提示細胞がT細胞を活性化する際には、両細胞は強固に接着し、接着面の間にリング状の構造が形成されるが、この構造を免疫シナプスと呼ぶ。各種受容体や情報伝達分子および関連分子が集積し、情報伝達や免疫応答の場として機能する。
[用語6] 蛍光 : 照明した光とは色(波長)の異なる光を出す現象のこと、もしくは出された光。蛍光を発する色素(蛍光色素)を用いて、観察対象を標識して見る蛍光顕微鏡法は、色の違いを利用して、標識した観察対象から出た蛍光のみを選び観察することができるので、背景光をカットして微弱にし、見たいもののみを鮮明に見ることができる。※名前が誤解をしばしば招くが、生物の蛍が光るのは生物発光によるもので蛍光現象とは異なる。
[用語7] 全反射照明(TIRF)法 : 試料と基板ガラスの境界面で、照明光を境界面に平行に近い角度で入射すると、全反射が起こる。全反射の際には、試料側にごく薄く表面から深さ50~200 nm程度の近傍のみに光(エバネッセント光)が沁み出る。このエバネッセント光を蛍光の照明として用いる手法。
[用語8] 薄層斜光照明(HILO照明)法 : 対物レンズに照明光を入射するのに、全反射照明よりも少しだけ対物レンズ中心軸寄りにレーザー光を入射すると、試料の内部を薄く照明することができる手法。細胞内を鮮明に分子イメージングすることができる。
[用語9] リン酸化 : リン酸基を付加する反応。タンパク質では通常、セリン、トレオニン、チロシンのOH基がリン酸化される。酵素や受容体では、リン酸化は活性化制御に用いられており、シグナル伝達においては、リン酸化はシグナルとして用いられている。
[用語10] ダイニン(dynein) : 分子モーターの一種で、微小管上をマイナス端(中心体)方向にATPの加水分解エネルギーを使って運動する。細胞運動・細胞内物質輸送・染色体分配などを行う細胞質ダイニンが今回の研究対象。最近、原子レベルの構造が解かれ、多様な動態・多種の他分子との相互作用・多様な機能と、構造との関係が解き明かされつつある。
[用語11] ダイナクチン(dynactin) : 細胞質ダイニンと結合するタンパク質。計23個のサブユニットで構成され、フィラメント部分と、ショルダー(shoulder)部分とからなる。ショルダー部分は、フィラメントから出た“肩”と“腕”のような構造をしており、その先端にCLIP-170結合部位がある。
補足説明
[補足1] ダイニンの状態 : 活性化される前のダイニンは「auto-inhibited(自己抑制)状態」にあって動かず、活性化されたダイニン単独では「weakly precessive(弱い前進性)状態」になって秒速0.05~0.08 μmの遅い速度でマイナス端方向に運動し、ダイニン・ダイナクチン・カーゴ(荷物)アダプター複合体を形成すると「highly precessive(高い前進性)状態」になって最高で秒速0. 51 ± 0.06 μmという荷物で遅くなる速度と、最高で4.3 ± 0.2 pN(ピコニュートン)という速度等で変化する力を出すことが報告されている。本研究成果では、活性化されたダイニンは他の分子と結合せず、ダイニン単独でマイナス端方向に秒速0.05 ± 0.03 μmの速さで動いており、「弱い前進性状態」にあることを示している。
[補足2] ダイニンとダイナクチンおよびNDE1との排他的結合 : ダイニンのダイナクチンとの結合は、膜結合タンパク質NDE1との結合と排他的に競合することが知られている。このことは、今回の研究結果において、CLIP-170/ダイナクチン複合体がダイニンをプラス端方向へ移動させるのに、膜からダイニンを“捕捉”し、“解離”してダイニンが膜結合すると考えられることを、ダイナクチンとNDE1との競合的結合によると理解すればよく説明できる。
[補足3] 抑制性ダイナクチン : ダイナクチンは、ダイニンを活性化させる(dynein activation)タンパク質として見つかり、その名の由来となっている。ところが最近、ダイナクチンのショルダー部分にある最大サブユニットDCTN1(p150Gluedとも呼ばれる)には2つのisoform (機能は同じだが構造が一部異なるタンパク質)であるDCTN1AとDCTN1Bとがあり、DCTN1Aを含むダイナクチンはダイニンと結合してhighly precessive(高い前進性)運動を示すが、DCTN1Bを含むダイナクチンはダイニンと結合してダイニンの運動性を抑制することが見出されている(Kobayashi T, et al., PLOS ONE, 12:e0183672, 2017)。今回の研究では、CLIP-170/ダイナクチン複合体に結合したダイニンは、CLIP-170によるプラス端追跡によってプラス端方向へ輸送された。このことは、T細胞活性化においては、抑制性isoformのダイナクチンが働いていることを示している。本研究成果は、抑制性ダイナクチンが重要な生命機能を担っていることについて、最初の発見と考えられる。
論文情報
| 掲載誌 : | Scientific Reports |
|---|---|
| 論文タイトル : | CLIP-170 is essential for MTOC repositioning during T cell activation by regulating dynein localisation on the cell surface |
| 著者 : | Wei Ming Lim, Yuma Ito, Kumiko Sakata-Sogawa, Makio Tokunaga |
| DOI : | 10.1038/s41598-018-35593-z |
- 免疫細胞を活性化する情報伝達分子の働きを解明│東工大ニュース
- 炎症反応を制御する新たな分子MKRN2を発見 ―過剰な炎症反応を防ぐ仕組みの一端を解明―│東工大ニュース
- 徳永・十川研究室 ―研究室紹介 #15―
- 徳永研究室
- 研究者詳細情報(STAR Search) - 德永万喜洋 Makio Tokunaga
- 研究者詳細情報(STAR Search) - 伊藤 由馬 Yuma Ito
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系 教授
徳永万喜洋(とくなが まきお)
E-mail : mtoku@bio.titech.ac.jp
Tel : 045-924-5711 / Fax : 045-924-5831