材料系 News
わずか2種類のアミノ酸で構成されたペプチドで 高活性人工酵素を構築
自己組織化を利用し、天然酵素と同等の活性を低コストで実現
ポイント
- わずか2種類のアミノ酸からなるペプチドをグラファイト電極表面で自己組織化させ、その微細構造を原子間力顕微鏡により観察。
- ペプチド分子膜に活性中心となる金属錯体分子を固定化することで、簡便かつ高活性な人工酵素の構築に成功。
- 多様な人工酵素を形成するペプチド分子設計による、安定かつ低コストなバイオセンサーや電気化学的触媒の開発への応用が期待。
概要
東京科学大学(Science Tokyo)※ 物質理工学院 材料系の杉山茉莉絵修士課程学生、早水裕平准教授(材料コース 主担当)および、金沢大学ナノ生命科学研究所(WPI-NanoLSI)のAyhan Yurtsever(アイハン・ユルトセベル)特任助教、福間剛士教授らのチームは、自己組織化[用語1]ペプチド[用語2]を用いた人工酵素電極の簡便な形成技術を開発し、その界面分子構造と触媒反応の関係を分子スケールで解明しました。
従来は天然のタンパク質酵素を電極表面に固定化して電気化学的酵素反応を実現していましたが、その動作安定性や試料作製に特別な処理が必要であったため、より簡便で安定な人工酵素の開発が望まれていました。
本研究グループは、わずか2種類のアミノ酸だけで構成された8個のアミノ酸からなる短いペプチドをグラファイト電極表面で自己組織化させ、その表面に活性中心となる金属錯体分子を固定化することで、簡便に高い活性を持つ人工酵素を構築することに成功しました。ヒスチジンとチロシン、バリンあるいはロイシンからなるペプチドの単分子膜に補酵素としてヘミン[用語3]を固定した人工酵素を調製したところ、グラファイト上に秩序構造をつくることが明らかとなりました。また、過酸化水素(H2O2)を還元する酵素反応をおこなったところ、チロシンを含む人工酵素が最も高い酵素活性を示すことがわかりました。
本成果は、低コストで安定に動作する全く新しい機構の人工酵素電極やバイオセンサーの開発へと繋がることが期待されます。本研究成果は、2月16日付(現地時間)のアメリカの学術誌ACS Nanoのオンライン版に掲載されました。
※2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
COVID-19の流行を契機に、感染症や疾病の早期検出、さらにはヘルスケア目的で使用されるバイオセンサーの需要が急速に拡大しています。これに伴い、多様な化学反応を担う人工酵素の開発が、これまで以上に重要視されています。特に、バイオセンサー用の人工酵素には、電極上で効率的に電子授受することや、安定かつ容易に固定化できる特性が求められています。
近年の研究により、ペプチドの2次元材料上での自己組織化を利用することで、電極上に触媒活性を有する人工酵素を構築できることが示されました。この手法では、触媒となる補因子[用語4]とペプチド溶液を電極上に滴下するだけで、自己組織化による人工酵素の作製が可能です。この新しい設計手法は、さまざまな触媒反応を低コストで実現できるだけでなく、補因子の種類を変更することで触媒反応の多様性を広げる可能性があります。
しかしながら、上記のペプチドのアミノ酸配列は複雑で、よりよい配列を探索するためには更なる研究が必要です。特に、電極上におけるペプチドの分子設計、複合分子構造、および触媒活性の関係についての分子スケールでの理解が依然として不足しており、人工酵素を設計するための指針は確立されていません。
研究成果
本研究では、これまでにない単純なアミノ酸配列のペプチドを用いて人工酵素を作製し、特性評価を行うことで、人工酵素活性におけるアミノ酸配列の役割を明らかにしました。具体的には、ヒスチジン(H)ともう1種類のアミノ酸(X)からなるジペプチド繰り返し配列(XH)4ペプチド(以下、XHペプチド)を用いました。XHペプチドは、その水溶液を滴下しただけでグラファイト電極表面に自発的に稠密な分子膜を形成することが知られています[参考文献1]。XHペプチドの配列において、Hは金属イオンと相互作用することが知られており、触媒として機能する多様な金属錯体補因子と相互作用できる特性を持ちます。Xとして、チロシン(Y)、バリン(V)、ロイシン(L)と異なる疎水性のアミノ酸を設計することで、ペプチド間およびペプチド-補因子、ペプチド-グラファイト基板の相互作用を調整しました。Hと種々のXからなるそれぞれのペプチドを(YH)4、(VH)4、(LH)4と呼びます。
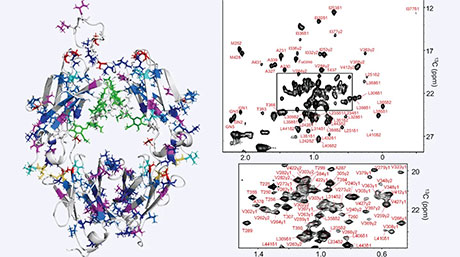
図1に示すように、まず今回設計した3種類のXHペプチドの単分子膜をグラファイト電極上に形成し、その表面に補因子のヘミンを固定化することで効率的な触媒界面の構築を目指しました。今回の研究で特筆すべきは、液中周波数変調原子間力顕微鏡[用語5](以下 FM-AFM)を用いて、分子スケールでペプチドの分子膜を観察することに成功した点です。図2のFM-AFM画像から、(YH)4、(VH)4、(LH)4の3種類すべてのペプチドが、まるで結晶のように規則的な分子秩序構造を形成することが明らかになりました。個々のペプチドの長さが同じであるにもかかわらず、表面構造に違いが見られ、ペプチド同士の間隔は1 nmから0.5 nmと最大2倍の幅の違いを示しました。このことから、ペプチド間の分子間相互作用がXの種類によって大きく異なることが示唆されました。
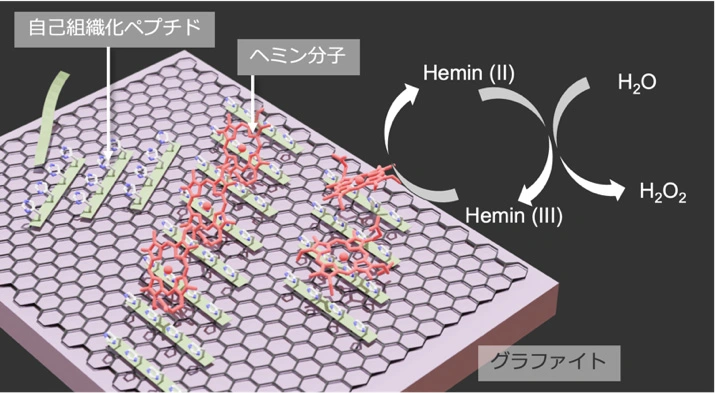
図1. グラファイト電極表面の自己組織化ペプチドに固定化されたヘミン分子と反応の模式図

図2. 液中周波数変調原子間力顕微鏡によって観測されたグラファイト表面上のペプチドの構造
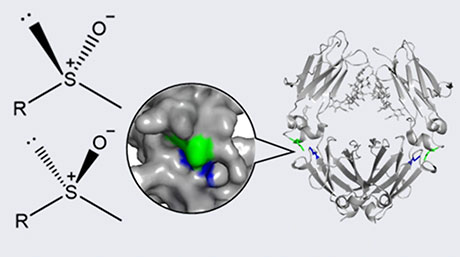
また、XHペプチドを自己組織化させた電極表面にヘミン水溶液を滴下し静置したところ、ヘミン分子がペプチドの秩序構造上に直接固定されている様子が観察されました(図3)。固定されたヘミンはペプチドのパターンに沿ってワイヤー状の構造を形成しました。このことから、ペプチドが分子足場としてへミン分子の固定を助けるだけでなく、表面構造に応じてへミン分子の向きを揃えて固定させる役割を持つことが明らかとなりました。
次にXHペプチド・ヘミンの複合分子構造が形成されたグラファイト電極を用いた電気化学測定によって、過酸化水素(H2O2)を還元する酵素反応における酵素性能を評価しました。図4に人工酵素によって得られる反応電流密度を計測した結果を示します。H2O2濃度の上昇に伴い反応電流密度が増加することが示され、その傾向はペプチドごとに異なりました。また、3種類のペプチドの中で、(YH)4ペプチドが最も高い反応電流密度を示しました。(YH)4ペプチドが示した電流密度は天然の酵素で作製した酵素電極と同等の触媒活性を示しています。ペプチド配列ごとに反応電流密度の最大値を比較すると、(YH)4と(VH)4ペプチドの間で約10倍の差が見られました。この差は、Y(チロシン) による強いペプチド間およびペプチド-ヘミン間の相互作用が、触媒活性向上に寄与していることを示唆しています。

図3. グラファイト表面上のペプチドに沿って形成されたヘミン分子の秩序構造。(赤色点線は、下地のペプチド分子足場のパターンを示す。)
以上の結果から、ペプチドの配列の違いが人工酵素の触媒活性に影響を与えることが分かり、効率的な触媒界面を開発するためにはペプチド設計が重要であることが示されました。特に、今回使用した単純なペプチド配列によって、ペプチドを介したへミン分子とグラファイト電極間の相互作用において重要な役割を担うアミノ酸が明らかになりました。今回の手法は、網羅的にペプチド配列と人工酵素活性の関係を理解するための有力な基盤技術となります。
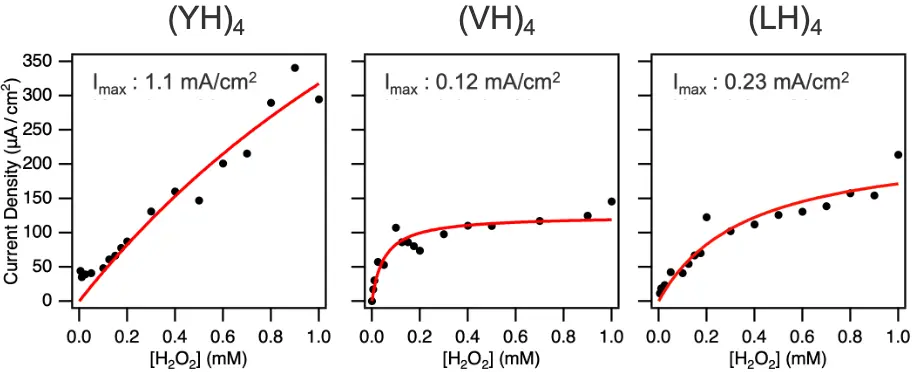
図4. ペプチドに固定化されたヘミン分子のH2O2還元反応電流密度のH2O2濃度依存性。Imaxは反応電流密度の最大値。フィッティング(赤い曲線)には、ミカエリス・メンテンのモデルを用いた。
社会的インパクト
本研究は、ナノ材料上の人工酵素設計の基盤を提供するものです。ペプチドのアミノ酸配列により、固定された分子の状態が大きく異なることが明らかとなりました。本研究においてヘミンとペプチドの複合体が得られたことから、表面自己組織化ペプチドの構造に沿って補酵素を直接固定できることが示され、電極表面の構造設計をペプチドの種類を変えることによって制御できる可能性が示唆されました。
本研究成果により、安定かつ低コストに動作する人工酵素電極の実現と、より幅広い分野への応用が進むことが期待されます。また、電極材料をグラファイトからグラフェンへと変更することで、超高感度なバイオセンサーの開発や、医療や環境計測などの分野での活用が見込まれます。
今後の展開
本研究では、2次元材料上で天然酵素と同等の触媒活性を持つ人工酵素を設計するための基盤技術を確立しました。これにより、ペプチドのアミノ酸配列を最適化することで触媒反応中心となる分子の状態を精密に制御でき、より効率的な人工酵素の設計が期待されます。今後は、ヘミンなどの補因子とペプチドの組み合わせをさらに拡張し、さまざまな2次元材料表面上での人工酵素の創製を検討します。また、その触媒特性の分子メカニズムを詳細に解明することにより、用途に応じて酵素機能を最適化したバイオセンサーや診断技術への応用を進め、COVID-19をはじめとする感染症や疾病の早期検出への応用を推進します。
- 付記
本成果は、以下の事業・研究領域・研究課題によって得られました
-
1.戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ナノ物質を用いた半導体デバイス構造の活用基盤技術」
(研究総括:齋藤理一郎 東北大学 名誉教授)
研究課題名:「ペプチド界面基盤技術によるグラフェン・バイオセンサの開拓」(JPMJCR24A4)
研究代表者:(早水裕平 東京科学大学 准教授)
研究期間:2024年10月~2029年3月
上記研究課題では、グラフェンや遷移金属ダイカルコゲナイド物質に代表される2次元物質やナノチューブ、ナノワイヤーに代表される1次元物質を用いた半導体デバイスを近未来に活用するための基盤技術を構築することを目的としています。 -
2.文部科学省世界トップレベル研究拠点プログラム(WPI)
2017年度採択:金沢大学 ナノ生命科学研究所
- 用語説明
| [用語1] | 自己組織化:分子や原子などの物質が、秩序を持つ大きな構造を自発的に作り出す現象。 |
|---|---|
| [用語2] | ペプチド:アミノ酸がペプチド結合によって短い鎖状に連なった分子。一般にアミノ酸の数が50未満のものをペプチド、50以上のものをタンパク質と呼ぶ。 |
| [用語3] | ヘミン:鉄を含むポルフィリン分子の一種であり、酵素の補因子としての機能を持つ。 |
| [用語4] | 補因子:酵素が触媒活性をもつために必要なタンパク質以外の化学物質で、一般には分子もしくはイオン。 |
| [用語5] | 周波数変調原子間力顕微鏡:FM-AFM (Frequency-modulation atomic force microscopy)と略称される。カンチレバー(片持ち梁)の先端に備えらえた鋭い探針を用いて、試料表面をなぞることで、その凹凸形状をナノメートル以下の精度で計測できる顕微鏡。AFMの動作モードのうち、FM-AFMは高い空間分解能を持つ。 |
- 参考文献
-
[1]W. Luo, H. Noguchi, C. Chen, Y. Nakamura, C. Homma, O. Zozulia, I. V. Korendovych, Y. Hayamizu, De novo designed peptides form a highly catalytic ordered nanoarchitecture on a graphite surface. Nanoscale 14, 8326–8331 (2022).
グラファイト表面へのペプチドの自己組織化によって触媒能を持つ新規バイオ電極の開発に成功|旧・東京工業大学
- 論文情報
| 掲載誌: | ACS Nano |
|---|---|
| タイトル: | Hierarchical Assembly of Hemin-Peptide Catalytic Systems on Graphite Surfaces |
| 著者: | Marie Sugiyama, Ayhan Yurtsever, Nina Uenodan, Yuta Nabae, Takeshi Fukuma, and Yuhei Hayamizu |
| DOI: |
10.1021/acsnano.4c15373 |
研究者プロフィール
杉山 茉莉絵 Marie SUGIYAMA
東京科学大学 物質理工学院 大学院修士課程学生
研究分野:バイオ・ナノ界面の制御、ナノ触媒
早水 裕平 Yuhei HAYAMIZU
東京科学大学 物質理工学院 准教授
研究分野:バイオ・ナノ界面の制御、グラフェン、バイオセンサー
関連リンク
- 半導体ナノシートの「二硫化モリブデン」を自己組織化ペプチドで修飾した高感度なナノシート・バイオセンサーを開発|旧・東京工業大学
- ペプチド修飾グラフェン電界効果トランジスタを用いた 匂い分子の高感度センシング|旧・東京工業大学
- グラファイト表面へのペプチドの自己組織化によって触媒能を持つ新規バイオ電極の開発に成功|旧・東京工業大学
- 筋萎縮性側索硬化症(ALS)原因蛋白の毒性メカニズムを解明|旧・東京工業大学
- バイオとナノの界面を制す|旧・東京工業大学
- 2次元ナノシート表面に"整列"するペプチドを開発 —タンパク質がグラフェンのエレクトロニクスを制御する—|旧・東京工業大学
- 早水 裕平 Yuhei Hayamizu|研究者検索システム Science Tokyo STAR Search
- 早水研究室
- 材料コース(大学院課程)|教育|物質理工学院 材料系
- ライフエンジニアリングコース(大学院課程)|教育|物質理工学院 材料系
- 材料系(学士課程)|教育|物質理工学院 材料系
- 物質理工学院|大学組織一覧|Science Tokyoについて
- 金沢大学ナノ生命科学研究所
お問い合わせ先
東京科学大学 物質理工学院 材料系
准教授 早水 裕平
E-mail : hayamizu@mct.isct.ac.jp
Tel : 03-5734-3651
金沢大学 ナノ生命科学研究所
教授 福間 剛士
E-mail : fukuma@staff.kanazawa-u.ac.jp
Tel : 076-234-4847