生命理工学系 News
分子内クリック反応による多環性トリアゾールの簡便構築 ― 蛍光性誘導体の創製にも成功
ポイント
- 加熱のみで進行する分子内ヒュスゲン環化反応によるハロゲン置換1,2,3-トリアゾール縮環ベンゾ三環性骨格の高効率合成
- 得られたトリアゾール骨格を基盤とした溝呂木–ヘック反応、鈴木–宮浦クロスカップリング反応、分子内フリーデル・クラフツ反応による多環化合物群の構築
- TSUBAMEを用いた分子軌道計算と置換基修飾による多彩な発光を示す五環性蛍光化合物の創製
- がん細胞への取り込みを確認した蛍光性化合物の創出
- 医薬創薬化学・機能性材料化学への展開と蛍光性分子デザインの新指針の提示
概要
東京科学大学(Science Tokyo)生命理工学院 生命理工学系の秦猛志准教授、湯浅英哉教授、越川直彦教授、金原数教授、昭和薬科大学の唐澤悟教授らの研究グループは、「1-(ω-アジドアルキル)-2-(2,2-ジハロビニル)アレーンを加熱するだけで進行する分子内ヒュスゲン環化反応[用語1]」に成功し、ハロゲン置換1,2,3-トリアゾール縮環ベンゾ三環化合物を簡便かつ高効率に合成する新手法を確立しました。
得られた化合物は、溝呂木–ヘック反応[用語2]、鈴木–宮浦クロスカップリング反応[用語3]、分子内フリーデル・クラフツ反応[用語4]などを経て、多様な構造を持つ多環化合物へと発展可能です。さらに、TSUBAMEによる分子軌道計算を活用した分子設計により、青色から黄色まで発光波長を制御可能な五環性蛍光化合物群を創製しました。その中にはがん細胞内への取り込みが確認された化合物も含まれており、本成果は、医薬・農薬や機能性材料に広く利用されるトリアゾール縮環化合物の新規合成法であると同時に、バイオイメージングへの応用が期待されます。
本成果は、7月8日付の「European Journal of Organic Chemistry」誌に掲載されました。
背景
1,2,3-トリアゾールは、医薬品や農薬のコア骨格としてだけでなく、蛍光色素・高分子材料・センサー分子など機能性材料化学の分野でも広く利用されています。特に、銅触媒を用いたアジド–アルキン環化付加(CuAAC)に代表される「クリックケミストリー[用語5]」により、容易に導入できることから、生体分子修飾やバイオコンジュゲーションにも頻用されています。
一方で、芳香環や多環骨格に縮環した1,2,3-トリアゾール構造は、剛直性やπ共役の拡張により、生物活性の向上や新規光学特性の発現が期待される重要な分子モチーフです。しかし、こうした縮環型構造を効率的に合成する方法は限られており、特に複数のハロゲン置換を有する縮環トリアゾール骨格の合成は、出発原料の安定性や中間体の反応性の制約から困難でした。
ハロゲン基はクロスカップリング反応や官能基変換の出発点として有用であり、多様な機能性分子の基盤となります。したがって、温和で簡便な条件下でハロゲン置換多環性1,2,3-トリアゾールを合成できる新手法の開発は、創薬化学や材料化学における重要な課題でした。
研究成果
本研究では、2,2-ジハロビニル基とアジド基を同一芳香族分子内に導入した1-(ω-アジドアルキル)-2-(2,2-ジハロビニル)アレーンを設計・合成し、その加熱反応を検討しました。その結果、遷移金属触媒や塩基を必要とせず、加熱のみで分子内ヒュスゲン環化(1,3-双極子付加環化)反応が進行し、5位にハロゲン基が置換した1,2,3-トリアゾール縮環ベンゾ三環骨格を高収率で得られることを見出しました。
得られたハロゲン置換トリアゾール化合物は、溝呂木–ヘック反応や鈴木–宮浦クロスカップリング反応による炭素鎖の延長が容易であり、さらに分子内フリーデル・クラフツ反応を経て、多様な縮環多環化合物へと展開可能であることが明らかとなりました(図1)。また、ニトロアレーン導入後にPPh₃を用いたカドガン環化反応[用語6]により、五環性トリアゾール誘導体を合成しました。この誘導体は各種有機溶媒中で強い蛍光を示し(図2)、新規な蛍光性骨格であることを確認しました。蛍光性有機分子はケミカルバイオロジーや材料科学に広く利用されており、本成果は新たな蛍光分子設計の基盤を提供するものです。
さらに、長波長蛍光を実現するためには、HOMOとLUMOのエネルギー差(HOMO–LUMOギャップ)の縮小が重要です。本研究では分子軌道計算をおこない、HOMOがベンゼン環上に、LUMOが分子下部に局在することを確認しました。これに基づき、HOMO側に電子供与基、LUMO側に電子吸引基を導入する「プッシュ–プル型分子設計」を適用し、発光波長の長波長化を検討しました(図3)。
その結果、電子状態を精密に制御した多様な誘導体を合成し、青色から黄色に至る発光波長を示す五環性蛍光化合物群の創製に成功しました(図4)。これらの化合物はいずれも有機溶媒中で明瞭な蛍光を発し、その一部はヒト肝細胞がん由来JHH4細胞への取り込みが蛍光顕微鏡観察により確認されました。加えて、細胞毒性試験においても低毒性が示され、生細胞イメージング用蛍光プローブとしての有用性が強く示唆されました(図5)。
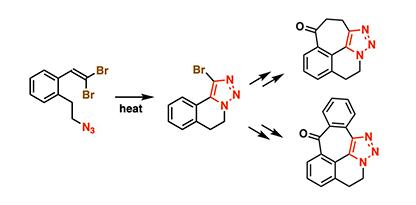
図1. ハロゲン置換1,2,3-トリアゾール縮環ベンゾ三環化合物の簡便合成および多環性誘導体への展開
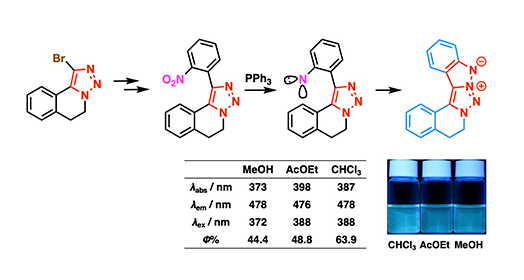
図2. カドガン環化反応による五環性トリアゾール誘導体への誘導および蛍光性の発現
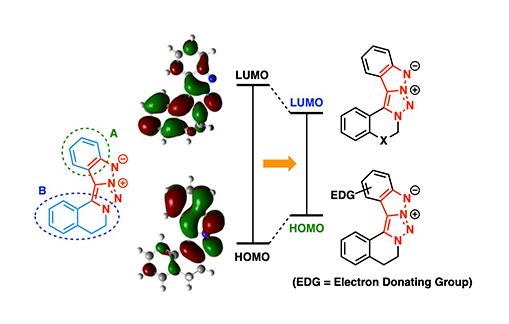
図3. 五環性トリアゾール誘導体の分子軌道計算
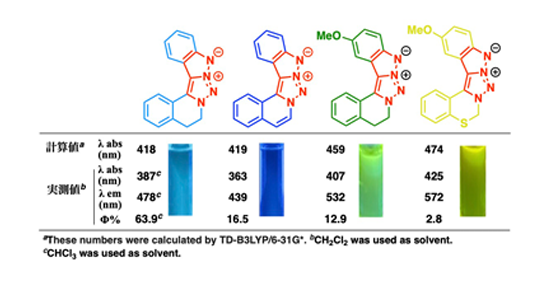
図4. 様々な蛍光波長の五環性トリアゾール誘導体
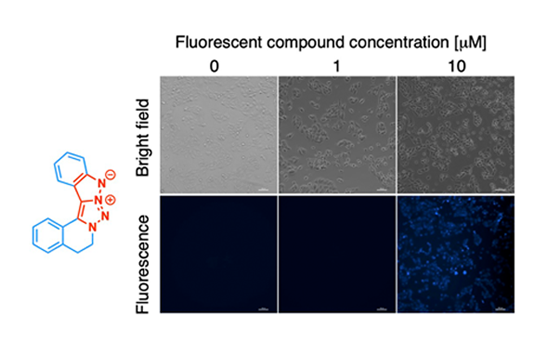
図5. がん細胞(JHH4肝がん細胞)への取り込み試験
社会的インパクト
- 医薬品リード化合物探索や分子プローブ開発に直結する合成基盤技術の提供
- 多彩な発光特性をもつ有機蛍光材料の創製によるバイオイメージング・診断用試薬の高性能化への寄与
- 環境負荷の少ない温和条件下での多環骨格合成法としてのグリーンケミストリー推進への貢献
今後の展開
- ヘテロ芳香環リンカーや立体的に柔軟な骨格への拡張による反応適用範囲の拡大
- 生細胞・組織レベルでの蛍光プローブ評価および分子イメージング実験の展開
- 新規蛍光材料としての光デバイス・センシング材料分野への応用
- 遷移金属触媒反応や光触媒反応との組み合わせによる新規分子変換法の開発
- 付記
本研究は、以下の事業・研究領域・研究課題などの支援を受けておこなわれました。
・科学研究費助成事業(課題番号:23K04733, 20K05507)
・JST さきがけ(課題番号:JPMJPR14KC)
・JST CREST(課題番号:JPMJCR23J2)
・未来社会DESIGN機構(DLab)研究奨励金(東京科学大学(Science Tokyo))
本研究の計算においては、東京科学大学TSUBAME4.0を利用しました。
- 用語説明
[用語1] 分子内ヒュスゲン環化反応:ヘテロ原子を含む双極子とアルキン/アルケンとの間で進行する[3+2]双極子付加環化反応 を指す。
[用語2] 溝呂木–ヘック反応:パラジウム触媒存在下で、ハロゲン化アリール/アルケニルと末端オレフィンをクロスカップリングさせ、置換オレフィンを合成する反応。官能基選択性と収率に優れ、2010年ノーベル化学賞受賞対象。
[用語3] 鈴木–宮浦クロスカップリング反応:パラジウム触媒を用いて、有機ホウ素化合物と有機ハロゲン化合物をクロスカップリングさせる反応。温和な条件・高い官能基選択性を特徴とし、2010年ノーベル化学賞受賞対象。
[用語4] 分子内フリーデル・クラフツ反応:分子内の酸ハロゲン化物がルイス酸の作用で生成するアシリウムイオンを介して芳香環に求電子的に導入され、環状ケトンを合成する反応。副生成物が少なく、多置換体の合成に有効。
[用語5] クリックケミストリー:「カチッと結合する(Click)」に由来し、高選択性・高収率・高速進行を特徴とする反応群。代表例はアジドとアルキンを用いたヒュスゲン[3+2]環化反応。水中や生体適合条件下でも進行する生体直交型反応として知られ、2022年ノーベル化学賞受賞対象。
[用語6] カドガン環化反応:オルト位に不飽和置換基を有する芳香族ニトロ化合物 を有機リン化合物とともに加熱すると、ニトロ基の還元 を伴う環化が進行し、含窒素複素環化合物が得られる。
- 論文情報
| 掲載誌: | European Journal of Organic Chemistry |
|---|---|
| タイトル: | Facile Synthesis of 5-Halo-1,2,3-Triazole-Fused Benzotricyclic Frameworks from 1-(ω-Azidoalkyl)-2-(2,2-Dihalovinyl)Arenes and their Application in Fluorescent Triazole Derivatives |
| 著者: | Seiya Kikukawa, Miki Ebihara, Kazuki Kobayashi, Nozomi Kasakura, Takashi Kanamori, Tadaomi Furuta, Ai Kohata, Nobuaki Funahashi, Shota Matsumoto, Satoru Karasawa, Kazushi Kinbara, Naohiko Koshikawa, Hideya Yuasa, and Takeshi Hata* |
| DOI: | 10.1002/ejoc.202500355 |