材料系 News
貴金属を使わずに高効率でアンモニアを分解
100℃低温化できる高性能なNi触媒を開発
要点
- カルシウムイミド(CaNH)とニッケル(Ni)を組み合わせ、既存のNi触媒よりもアンモニア分解の反応温度を100℃下げることに成功
- CaNH表面のNH空孔でNH3分子を活性化
- アニオン空孔を活用した触媒の設計法を示す成果
概要
東京工業大学 物質理工学院 材料系の小笠原気八(博士後期課程2年)、元素戦略研究センターの北野政明准教授(材料コース 主担当)、細野秀雄栄誉教授らは、カルシウムイミド(CaNH)[用語1]とニッケル(Ni)を組み合わせることで、既存のNi触媒[用語2]よりも100℃以上低温でアンモニア分解活性[用語3]を示す高性能な触媒の開発に成功した。
アンモニア分解反応では貴金属であるルテニウム[用語4]が触媒として最も優れた性能を示すことが知られている。アンモニア分子との相互作用が弱いニッケル表面では、多くの場合アンモニア分子を活性化するのに600℃以上の高い反応温度が必要だった。
本研究ではニッケルとカルシウムイミドの界面に形成されるNH空孔[用語5]がアンモニア分子を効率よく活性化し、500℃で90%以上のアンモニア分解率を達成した。今回の研究はNH空孔を反応場として利用する新たな反応メカニズムにより、アンモニア分解反応の低温化が実現できる指針を示す成果である。
近年、水素エネルギー社会の実現へ向けたアンモニアの分解による水素製造技術の開発が盛んだが、希少で高価なルテニウムに依存しない新触媒技術の開発が望まれている。本研究はこの課題に大きく貢献するものである。
研究成果は8月19日に、米国科学誌「ACS Catalysis」にオンライン掲載された。
研究の背景と経緯
近年、地球温暖化の進行に伴い二酸化炭素を排出しない水素エネルギー社会の実現が強く望まれている。水素は優れたエネルギーキャリアであるが、貯蔵や輸送の際に極低温にする必要がありコストや技術的な課題が存在する。このため、水素を高密度に含む化学物質から水素を取り出す技術の開発が進められてきた。アンモニア(NH3)はハーバー・ボッシュ法[用語6]によって世界で最も多く合成される化合物の一つであるが、室温・10気圧で容易に液化することから優れた水素貯蔵物質であると考えられている。
アンモニアを分解し水素を取り出すためには、化学反応を効率的に促進する触媒が必要である。これまでの研究によって、ルテニウムがアンモニア分解反応を最も効率よく促進することが知られているが、希少で高価な材料であることから安価な金属種を用いた代替触媒の開発が求められている。その代替候補の一つとしてニッケルが挙げられるが、アンモニア分子との相互作用がルテニウムに比べて極めて弱く、活性が著しく低いため性能の改善が進められている。
研究の内容
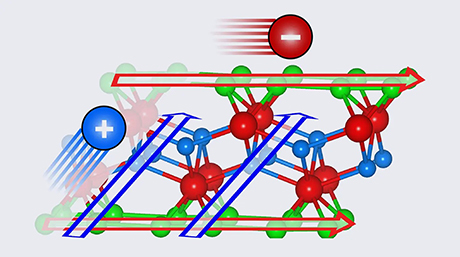
本研究では図1に示すようにCaNH上にNiナノ粒子を固定化したNi/CaNH触媒[用語7]を考案した。この触媒上ではNiとCaNHの界面に存在するNH2-種[用語8]がNiを介してH2とN2に分解され、NH空孔(VNH)が反応中に形成される。このとき、空孔サイトに2個の電子が補足される。空孔サイトに存在する電子は非常に反応性が高く、室温付近においてもアンモニア分子を活性化し、H2の生成とNH2-種の再生成が起こる(図2)。これによってNi/CaNHは安定したアンモニア分解活性を示す。このユニークな反応メカニズムは、NH3-パルス測定[用語9]、同位体ガス[用語10]を使った実験と計算科学によって明らかとなった。
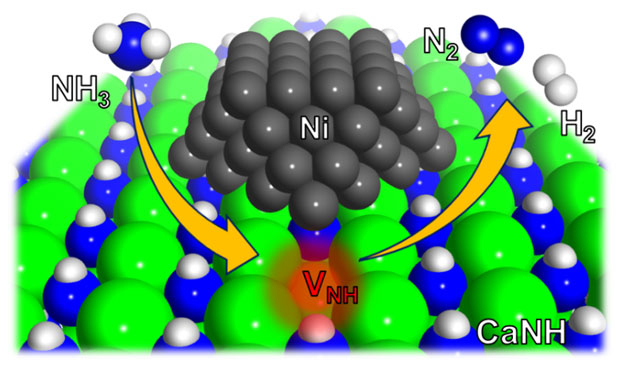
- 図1. Ni/CaNH上におけるアンモニア分解反応のメカニズム。NH空孔(VNH)はCaNHとNiの界面に形成され反応性の高い電子が存在している。電子とアンモニア分子は速やかに反応する。
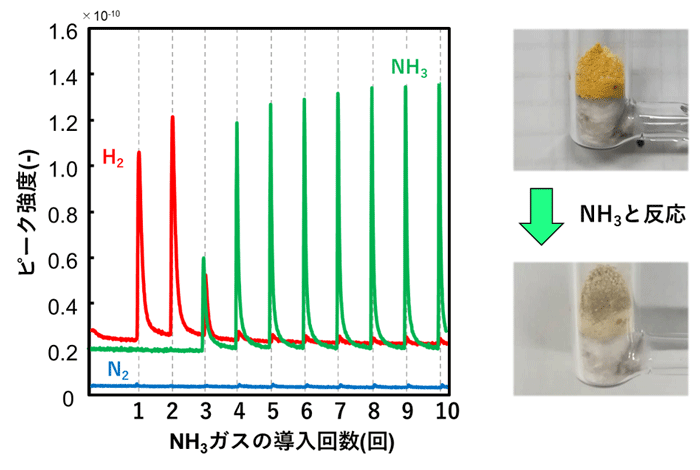
- 図2. CaNH表面の欠陥とNH3分子の反応を50℃で行った結果(左図)と色の変化(右図)。欠陥とNH3分子が反応し、NH3分子の吸着とH2の発生が起こる。 表面の欠陥が全て反応に使われるとNH3分子は吸着しなくなる。また、反応前は欠陥に存在する電子によってオレンジ色をしているが、反応後は電子が存在しないため無色になる。
従来の金属触媒上ではアンモニア分子が金属表面に吸着し、N-H結合[用語11]が開裂した後にH2およびN2の脱離がおこる。ニッケル表面におけるアンモニア分解反応では、窒素の脱離およびN-H結合の開裂反応に大きな活性化エネルギー[用語12]が存在するため、律速段階[用語13]であると考えられている。
Ni/CaNHでは上述した反応メカニズムにより、アンモニア分子がNi-CaNH界面のNH空孔で速やかに活性化され、水素が生成される。この反応は50℃程度でも進行する。一方で格子のNHがNiを介してN2が放出される温度は350℃以上であり、本触媒における律速段階はNH空孔の形成段階であることと考えられる。
図3に、種々のNi担持触媒の活性試験の結果を示す。Ni/CaNHは360℃付近からアンモニア分解活性を示し、540℃においてほぼ100%のアンモニア転化率に到達することがわかる。比較触媒[用語14]であるNi/Al2O3[用語15]やNi/CaO[用語16]は500℃以下において、十分な触媒性能を示さず640℃付近において100%転化率に到達した。この結果からCaNHをNi触媒の担体材料とすることで触媒動作温度を約100℃低温化することに成功したといえる。
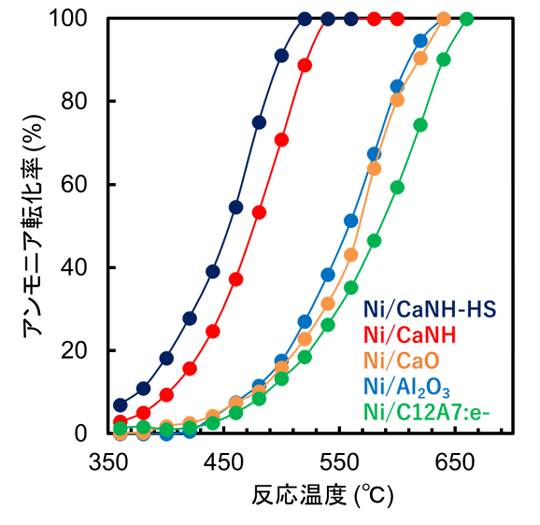
図3. Niを種々の担体材料に固定化した触媒のアンモニア転化率と反応温度の関係。
(Ni担持量:10 wt%, NH3流量:25 mLmin-1)
さらに、当研究グループで開発した優れた電子供与性をもつC12A7エレクトライド[用語17]にニッケルナノ粒子を担持した触媒(Ni/C12A7:e-)でさえも、低温域では触媒として十分に機能しないことがわかった。さらに、高表面積化したCaNHにNiを担持した触媒(Ni/CaNH-HS)を用いると触媒活性が1.5倍程度に向上した。同触媒のNi重量当たりの水素生成速度を算出し、既存のNi触媒の性能と比較したところ、世界最高レベルの触媒活性であることが明らかとなった。
今後の展開
今回の研究は、NH空孔という新たな反応場を利用することで、安定なアンモニア分子をより低温で効率よく活性化できることを明らかにした。これによって、温和な条件下で作動する貴金属フリーなアンモニア分解触媒の開発の方向性が示された。今後、この考え方をさらに発展させ、より優れた触媒の開発や他の触媒反応への展開を目指している。
- 付記
今回の研究成果は、JST 戦略的創造研究推進事業 さきがけ(No. JPMJPR18T6)、科学研究費補助金(No. JP21H00019、JP19H02512、17H06153)、徳山財団の支援によって実施された。
- 用語説明
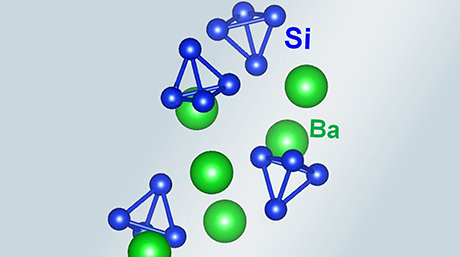
[用語1] カルシウムイミド(CaNH) : 2価の陽イオンと陰イオンであるカルシウムイオン(Ca2+)とイミドイオン(NH2-)が静電的な力で結びついた無機化合物である。食塩(NaCl)と全く同じ結晶構造を持ち、陽イオンと陰イオンが交互に配列している。純粋なものは食塩と同様、ほとんど無色である。
[用語2] Ni触媒 : 鉄族に分類されるNiを活性種とした触媒。Niは地球上に豊富に存在する元素であり安価な金属材料である。水素との親和性が高いため、水素分子の活性化による他の分子との反応促進(水素化)や、分子から水素を取り除く(脱水素化)反応に広く利用される。窒素を活性化する作用は非常に弱いことが知られている。
[用語3] アンモニア分解活性 : アンモニアを水素と窒素へ分解する反応に対する触媒性能の指標の一つ。より多くのアンモニア分子を、少ない触媒の量で速く分解できることが望ましい。
[用語4] ルテニウム : 白金族に分類される元素であり、埋蔵量が少なく産地が偏在しているため高価な金属材料である。水素だけでなく窒素とも優れた親和性を持つため、アンモニア合成・分解反応に対して最も優れた触媒活性を示すことが知られている。
[用語5] NH空孔 : カルシウムイミド(CaNH) に含まれるNH2-の一部が、水素と窒素へ分解されることによってNH2-が部分的に抜けた空きサイトをNH空孔と呼ぶ。空孔ができるとNH2-イオンがもっていた2個の電子が空孔サイトに取り残され、電荷が補償される。このとき、CaNHの色が無色からオレンジ色に変化する。高濃度のアニオン欠損に電子が存在するので、表面エレクトライドとも見做される。
[用語6]
ハーバー・ボッシュ法 : ハーバーとボッシュによって確立された鉄を触媒として窒素と水素から工業的にアンモニアを合成する方法。天然ガスの改質による水素製造プロセスと一体となっており、高温・高圧条件で大量にアンモニアを合成する方法である。アンモニア合成を通して人類を支えた研究者たち|東工大TOPICS|東工大について![]()
[用語7] Ni/CaNH触媒 : CaNHの表面にNiのナノ粒子を固定化した粉末のこと。アンモニア分解反応に対して高い活性を示すことが明らかとなった。
[用語8] NH2-種 : アンモニア分子(NH3)と2個の電子が反応した際に生じる2価の陰イオンである。水酸化物イオン(OH-)と同様に直線型の構造をもっている。高温では水素と窒素に分解される。
[用語9] NH3-パルス測定 : 一定量のNH3ガスを断続的に導入し、試料とNH3ガスを徐々に反応させることによって、反応挙動の変化を段階的に観察する手法。
[用語10] 同位体ガス : 原子番号が同じで、重さ(質量数)だけが異なる原子のこと。化学的性質は同等である。
[用語11] NH結合 : 窒素原子と水素原子が互いの電子を共有することによって生まれる化学結合(共有結合)。アンモニア分子にも含まれる比較的安定な結合であり、適切な触媒を用いないと、高温(700℃程度)においても素早く切断することができない。
[用語12] 活性化エネルギー : 反応の出発物質の基底状態から遷移状態に励起するのに必要なエネルギーのことであり、このエネルギーが小さいほど、その反応は容易になる。反応中に触媒が存在することで、活性化エネルギーを下げることが可能である。
[用語13] 律速段階 : 化学反応において最も遅い反応段階であり、この反応速度が全体の化学反応の速度を支配している。
[用語14] 比較触媒 : 新しく合成した触媒の性能を比べるための、基準となる活性を持つ触媒のこと。
[用語15] Ni/Al2O3 : Niのナノ粒子を安定な酸化物であるAl2O3(酸化アルミニウム)に固定化した触媒。
[用語16] Ni/CaO : Niのナノ粒子を安定な酸化物であるCaO(酸化カルシウム)に固定化した触媒。
[用語17] C12A7エレクトライド : 酸化カルシウムと酸化アルミニウムを主成分とした物質であり、結晶の中にCa-O-Alから成るプラスの電荷を帯びた籠状の構造を含む。プラスの電荷を中和するために様々な陰イオン(O2-, OH-, H-, Cl-)を籠の中に取り込むことが可能であり、究極の陰イオンである電子(e-)を含むものを特にC12A7エレクトライドと呼ぶ。C12A7エレクトライドは電子を放出する能力が非常に高く、表面に金属ナノ粒子を固定化すると、触媒としての性能が飛躍的に向上することが知られている。
- 論文情報
| 掲載誌 : | ACS Catalysis |
|---|---|
| 論文タイトル : | Ammonia Decomposition over CaNH-Supported Ni Catalysts via an NH2--Vacancy-Mediated Mars–van Krevelen Mechanism (Mars–van Krevelen機構によるNH2-欠陥を介したNi/CaNH触媒上におけるアンモニア分解反応) |
| 著者 : | Kiya Ogasawara, Takuya Nakao, Kazuhisa Kishida, Tian-Nan Ye, Yangfan Lu, Hitoshi Abe, Yasuhiro Niwa, Masato Sasase, Masaaki Kitano, Hideo Hosono |
| DOI : | 10.1021/acscatal.1c01934 |
- 低温で高効率なアンモニア合成を実現|東工大ニュース
- 排熱を電気に変える高性能熱電素子実現へ|東工大ニュース
- 触媒活性・安定性・貴金属利用効率を向上|東工大ニュース
- 発光効率と大気安定性が高い、有害元素フリーの新規青色発光体を実現|東工大ニュース
- ニッケル触媒のアンモニア合成活性、窒素空孔の形成されやすさが鍵|東工大ニュース
- 本気で新材料を創り出す研究者魂|研究ストーリー|研究
- 電子を巧みに操り、物質の潜在能力を引き出す ― 細野秀雄(上)|研究ストーリー|研究
- 電子を巧みに操り、物質の潜在能力を引き出す ― 細野秀雄(下)|研究ストーリー|研究
- 2020年版引用論文著者リストに細野秀雄栄誉教授、前田和彦准教授が選出|東工大ニュース
- 細野秀雄教授が米国材料学会(MRS)のフォン ヒッペル賞を受賞|東工大ニュース
- 東工大関係者9名が平成29年度科学技術分野の文部科学大臣表彰で「若手科学者賞」を受賞 |東工大ニュース
- 北野研究室
- 研究者詳細情報(STAR Search) - 北野政明 Masaaki Kitano
- 研究者詳細情報(STAR Search) - 細野秀雄 Hideo Hosono
- 東京工業大学 元素戦略研究センター
- 材料コース(大学院課程)|教育|物質理工学院 - 材料系
- 研究成果一覧
お問い合わせ先
東京工業大学 元素戦略研究センター
栄誉教授 細野秀雄
E-mail : hosono@mces.titech.ac.jp
Tel : 045-924-5009 / Fax : 045-924-5339
東京工業大学 元素戦略研究センター
准教授 北野政明
E-mail : kitano.m.aa@m.titech.ac.jp
Tel / Fax : 045-924-5191