融合理工学系 News
遺伝性疾患の原因遺伝子がDNA複製を制御する新たなメカニズムの発見
抗がん剤開発のための生体内標的として期待
ポイント
- 遺伝性疾患の原因遺伝子PNKPがDNA複製制御に関与するメカニズムを解明。
- ゲノム編集により哺乳類細胞のPNKPの機能を操作し、その新規機能を発見。
- PNKPの機能異常に起因する遺伝病の病態解明とPNKPを標的にした抗がん剤の開発に貢献することが期待される。
概要
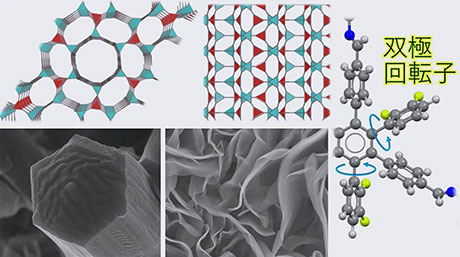
東京科学大学総合研究院ゼロカーボンエネルギー研究所の島田幹男助教、塚田海馬博士研究員(現、コペンハーゲン大学博士研究員)、今村力也博士研究員(現、京都大学特定助教)、Fu Lingyan大学院生、松本義久教授と国立がんセンター研究所RI研究施設の石合正道施設長らの研究チームは、哺乳類細胞においてDNA修復酵素であるPNKP(Poly-nucleotide kinase phosphatase[用語1])がDNA複製に関与することを明らかにしました。PNKPはDNA末端をリン酸化あるいは脱リン酸化するDNA修復酵素で、DNAの一本鎖切断や二本鎖切断の修復に関与しています。このようにPNKPがDNA修復[用語2]に関与することは知られていましたが、DNA複製への関与は知られていませんでした。今回の研究でPNKPは、DNA複製を制御するリン酸化酵素であるサイクリン依存性リン酸化酵素(CDKs)によってリン酸化されると、DNA複製中間体である岡崎フラグメント[用語3]に集積して、岡崎フラグメント間のギャップを埋める働きを発揮することを見出しました(図1)。
PNKPは重篤な遺伝性の神経疾患の原因遺伝子であり、本研究成果は神経疾患の病態の解明に寄与することが期待されます。また、DNAの修復あるいは複製を阻害することにより、がん細胞の増殖を抑制できるため、DNA修復および複製タンパク質は抗がん剤の標的になり得ると期待されます。今回の研究成果によりPNKP阻害は効果的に細胞の増殖を阻害する可能性が示唆されたため、今後の抗がん剤開発に貢献すると考えられます。
本成果は、3月27日付(現地時間)の「eLife」誌に掲載されました。
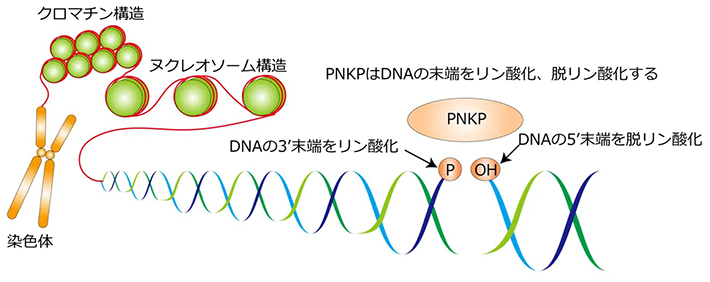
図1. PNKPはDNA修復に重要な酵素であり、DNA末端を直接、
リン酸化あるいは脱リン酸化することによりDNA修復を円滑に進行させる機能を持つ。
背景
生物は常時、紫外線、放射線、乾燥や活性酸素など内外の環境ストレスに晒されており、細胞内のDNAには損傷が生じています。これらDNA損傷[用語4]は突然変異、発がん、老化の原因となるため直ちに修復される必要があります。そのため生物はDNA損傷を修復するための分子機構を発達させており、この機構は単細胞生物である大腸菌から多細胞生物であるヒトまで広く保存されています。DNA修復機構は細胞の生存に重要なため、DNA修復に関与する遺伝子の機能に異常があるとヒトではさまざまな疾患が発症することが知られています。
DNA損傷はその形状から塩基損傷、DNA一本鎖切断、DNA二本鎖切断など様々な種類に分類され、その修復に関与する酵素も多岐にわたります。DNA修復酵素であるPNKPはDNAの末端をリン酸化あるいは脱リン酸化する活性を持つ酵素で、研究チームはこれまでにPNKPが塩基損傷、DNA一本鎖切断の修復、非相同末端結合[用語5]を介したDNA二本鎖切断の修復に関与することを解明していました[参考文献1、2]。一方で遺伝子改変マウスを用いた研究において、Pnkp欠損マウス細胞の増殖速度が非常に遅いことを発見していましたが、この現象をDNA修復の欠損だけで説明することは困難でした[参考文献3]。
研究成果
本研究では、まず、ゲノム編集を用いてPNKP遺伝子を欠損したヒトの培養細胞を作成し、PNKP欠損ヒト細胞でもPNKP欠損マウス細胞と同様に増殖速度が遅いことを確認しました。
細胞増殖の遅延は、DNA複製の進み具合に異常があると生じる場合があるので、PNKP欠損ヒト細胞のDNA複製スピードを、DNAファイバーアッセイ法[用語6]を用いて計測しました。その結果、野生型細胞と比較して複製スピードは速くなっていました。こういった現象は他のDNA複製異常を示す細胞でも確認されており、DNA複製タンパク質の機能の異常により、DNA複製のスピードが制御できなくなり、結果的に細胞増殖が遅延します。
さらに解析を進めた結果、DNA合成期にサイクリン依存性リン酸化酵素であるCDKsによってPNKPの118番アミノ酸のスレオニンがリン酸化されると、PNKPはDNA複製の中間体である岡崎フラグメントに集積しフラグメント間のギャップ構造を修飾する役割を持つことが明らかになりました(図2)。
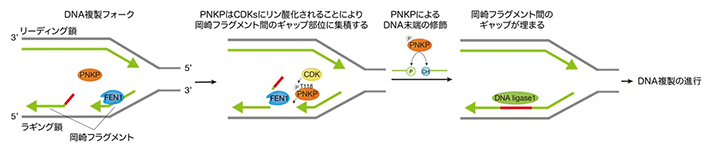
図2. 今回の研究で、PNKPがDNA複製における
ラギング鎖の岡崎フラグメント間のギャップ構造の修飾に重要であることを見出した。
社会的インパクト
本研究は2つの点において重要です。まず、PNKPはMCSZ[用語7]、AOA4[用語8]、CMT2B2[用語9]といった3種類の遺伝性神経疾患の原因遺伝子として同定されていますが、この遺伝子から作られる酵素であるPNKPの機能がどのように神経疾患に関与するかは不明でした。本研究の成果により、PNKPと神経疾患の関係に新たな知見がもたらされました。
また、PNKPをはじめとしたDNA修復酵素やDNA複製酵素は、細胞の増殖や恒常性に必要不可欠な役割を担っています。これらの因子を阻害することによって、細胞増殖が盛んながん細胞の増殖を阻害できると考えられるため、抗がん剤の標的になるのではないかと期待されています。
今後の展開
今後はPNKPと疾患の関係をさらに詳細に解析するためにiPS細胞や試験管中でミニチュア臓器を作製する組織オルガノイド技術を駆使して、PNKPが関与する細胞増殖、細胞分化の関係の研究を進めていきたいと考えています。
- 付記
本研究は日本学術振興会科学研究費補助金(科研費)、中部電力原子力安全技術研究所により助成を受けました。
- 参考文献
- [1] The FHA domain of PNKP is essential for its recruitment to DNA damage sites and maintenance of genome stability.Tsukada K, Shimada M, Imamura R, Saikawa K, Ishiai M, Matsumoto Y. Mutat Res. 2021 Jan-Jun;822:111727. doi: 10.1016/j.mrfmmm.2020.111727. Epub 2020 Nov 2.
- [2]Linker region is required for efficient nuclear localization of polynucleotide kinase phosphatase.T sukada K, Matsumoto Y, Shimada M. PLoS One. 2020 Sep 24;15(9):e0239404. doi: 10.1371/journal.pone.0239404. eCollection 2020.
- [3]olynucleotide kinase-phosphatase enables neurogenesis via multiple DNA repair pathways to maintain genome stability. Shimada M, Dumitrache LC, Russell HR, McKinnon PJ. EMBO J. 2015 Oct 1;34(19):2465-80. doi: 10.15252/embj.201591363. Epub 2015 Aug 19.
- 用語説明
| [用語1] | PNKP(Poly-nucleotide kinase phosphatase):DNA修復酵素、DNA一本鎖切断修復と非相同末端結合を介したDNA二本鎖切断修復に関与する。また、MCSZ、AOA4、CMT2B2の3つの遺伝性疾患の原因遺伝子である。 |
|---|---|
| [用語2] | DNA修復:DNA損傷を修復するための分子機構。哺乳類には損傷の種類に応じて様々な修復経路が存在する。 |
| [用語3] | 岡崎フラグメント:DNAは二本鎖構造で、DNA複製の際は方向性があり、それぞれリーディング鎖とラギング鎖と呼ばれる。ラギング鎖のDNA複製の際に形成される短いDNA断片を岡崎フラグメントという。 |
| [用語4] | DNA損傷:紫外線や放射線によりDNAに生じる損傷の総称。 |
| [用語5] | 非相同末端結合:DNA二本鎖切断修復の一つ。切断された末端を直接結合する修復方法。 |
| [用語6] | DNAファイバーアッセイ法:培養細胞等から取り出したDNAをスライド上で引き伸ばして、DNAの複製反応を蛍光物質で追跡する手法。 |
| [用語7] | MCSZ:小頭症とてんかん発作を呈する遺伝性の神経発生疾患。 |
| [用語8] | AOA4:眼球運動失行性失調症、遺伝性の神経変性疾患。 |
| [用語9] | CMT2B2:シャルコーマリートゥース病タイプ2B2、遺伝性の神経変性疾患。 |
- 論文情報
| 掲載誌: | eLife |
|---|---|
| タイトル: | CDK-mediated phosphorylation of PNKP is required for end processing of single-strand DNA gaps on Okazaki Fragments and genome stability |
| 著者: | Kaima Tsukada, Rikiya Imamura, Tomoko Miyake, Kotaro Saikawa, Mizuki Saito, Naoya Kase, Lingyan Fu, Masamichi Ishiai, Yoshihisa Matsumoto, Mikio Shimada |
| DOI: |
10.7554/eLife.99217 |
研究者プロフィール
島田 幹男 Mikio SHIMADA
東京科学大学 総合研究院
ゼロカーボンエネルギー研究所 助教
研究分野:放射線分子生物学、神経発生学、
発生生物学
関連リンク
- ヒトiPS細胞における重粒子線に対する防護剤の開発|Science Tokyoニュース
- α-グルコシルルチンがヒトiPS細胞の代謝を活性化する作用機序を解明|旧・東京工業大学
- iPS細胞における放射線応答の遺伝子発現変化を解明|旧・東京工業大学
- 放射線による皮膚への影響を解明|旧・東京工業大学
- 島田 幹男 Mikio Shimada|研究者検索システム Science Tokyo STAR Search
- 松本 義久 Yoshihisa Matsumoto|研究者検索システム Science Tokyo STAR Search
- 松本研究室
- ゼロカーボンエネルギー研究所
- 原子核工学コース
- 原子核工学コース(大学院課程) | 教育 | Science Tokyo 環境・社会理工学院 融合理工学系
- 総合研究院
お問い合わせ
東京科学大学 総合研究院
ゼロカーボンエネルギー研究所
助教 島田 幹男
E-mail : mshimada@zc.iir.titech.ac.jp
Tel / Fax : 03-5734-3703