融合理工学系 News
ヒトiPS細胞における重粒子線に対する防護剤の開発
宇宙放射線に対する防護効果を期待
ポイント
- 重粒子線がヒトiPS細胞で中心体過剰複製を増加させることを確認。
- ジメチルスルホキシドがヒトiPS細胞において重粒子線とガンマ線に対する防護効果を持つことを発見。
- 放射線がん治療の副作用の低減や、宇宙空間での宇宙放射線防護につながると期待。
概要
東京科学大学総合研究院ゼロカーボンエネルギー研究所の島田幹男助教と松本義久教授(ともに原子核工学コース 主担当)、量子科学技術研究開発機構QST病院の平山亮一研究統括らの研究チームは、iPS細胞[用語1]において、重粒子線[用語2]などの放射線が中心体[用語3]の過剰複製を高い頻度で誘導し、ジメチルスルホキシド(DMSO)[用語4]がそれらの作用を軽減する放射線防護効果を持つことを明らかにしました。
重粒子線などの放射線による治療は、治療効果が高いがん療法として注目されています。しかし、正常組織への照射は細胞の機能障害など副作用の原因となるため、適切な防護剤の開発が望まれています。また宇宙空間では炭素線、鉄線といった様々な重粒子線が飛び交っており、人類の宇宙進出においてその防護法の開発は大きな課題となっています。
これらの背景を受けて、研究チームはヒトiPS細胞に対する重粒子線とガンマ線の影響を評価した結果、細胞内小器官である中心体の過剰複製と細胞分裂死を高い頻度で誘導し、特に重粒子線でその頻度が高いことを発見しました。また有機溶媒であるDMSOはその影響を低減することから、中心体異常を指標とした放射線防護効果を持つことを明らかにしました。
本研究成果は、8月30日付の米国放射線学会誌「Radiation Researchオンライン版」に掲載されました。
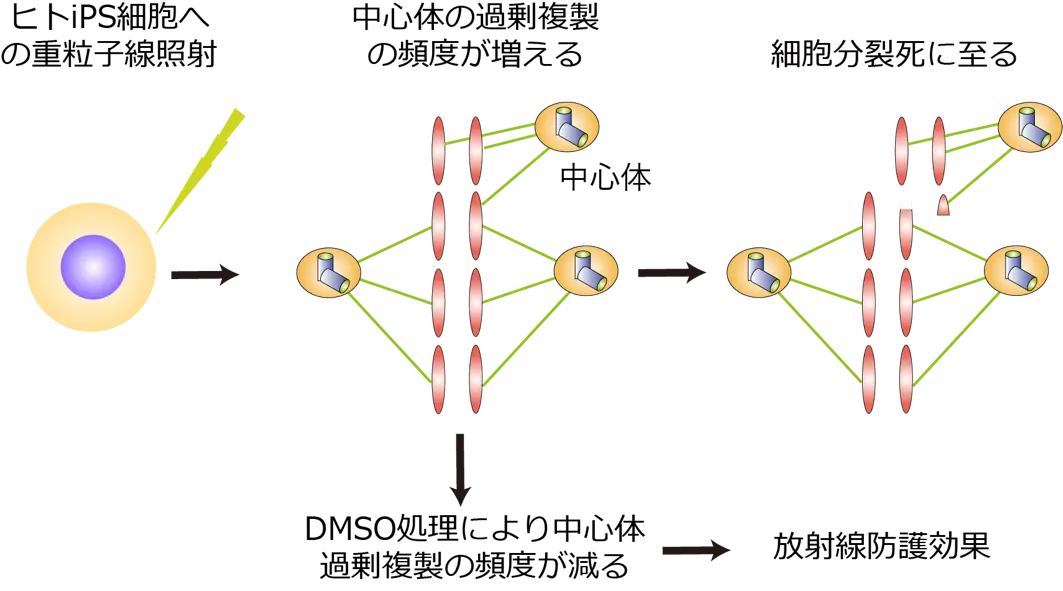
図1. 重粒子線による中心体過剰複製とDMSOによる防護効果
背景
放射線は、医療や産業利用など社会のいろいろな場面で利用されており、私たちに多くの恩恵をもたらしていますが、様々な課題もあります。
重粒子線やガンマ線などの放射線によるがん治療では、目的のがん組織以外の正常組織へ照射は細胞障害を引き起こす可能性があるため、防護剤の開発は重要な課題となっています。
また、宇宙空間は無重力空間であることから、組織の3次元培養に適していると考えられており、現在、国際宇宙ステーションの日本の実験棟「きぼう」において多能性幹細胞(ES細胞、iPS細胞)から組織オルガノイドと呼ばれるミニ臓器を作成し、再生医療に利用しようという試みが計画されています。しかし、宇宙空間は炭素線や鉄線などの重粒子線や、陽子線などが飛び交う複合放射線場であり、組織オルガノイドや組織オルガノイドの元となる多能性幹細胞に対する放射線防護は重要な課題です。
放射線照射は、細胞内小器官である中心体の異常である中心体過剰複製の原因となります。中心体は、細胞分裂の際の極性中心となる構造体での正確な染色体の分配に必須です。細胞分裂の際は、2つの中心体が染色体をそれぞれの娘細胞に分配する機能を持っています。しかし何らかの異常で3つ以上の中心体を持つと、染色体は均等に分配されず、ばらばらになってしまうことがあります。その場合、細胞は死んでしまうか、異常な染色体を持ったまま増殖を重ね、発がんの原因となります。過剰な中心体をもつことを中心体過剰複製といい、放射線はその原因となります。
研究成果
本研究では多能性幹細胞であるヒト人工多能生幹細胞(iPS細胞)を用いて、放射線の一種であるガンマ線と重粒子線による影響とその防護法について探索し、特に放射線の細胞影響の指標として中心体異常に着目しました。
ヒトiPS細胞における中心体過剰複製
これまでに細胞での放射線依存的な中心体過剰複製は、マウス、ヒトのがん細胞株では報告されていましたが、ヒトiPS細胞では報告がありませんでした。そこで研究グループは、ガンマ線と炭素線(重粒子線の一種)をヒトiPS細胞に照射しました。その結果、ヒトiPS細胞ではがん細胞より高い頻度で中心体過剰複製が生じることがわかりました。また、この頻度はガンマ線よりも炭素線の方が増加していました。
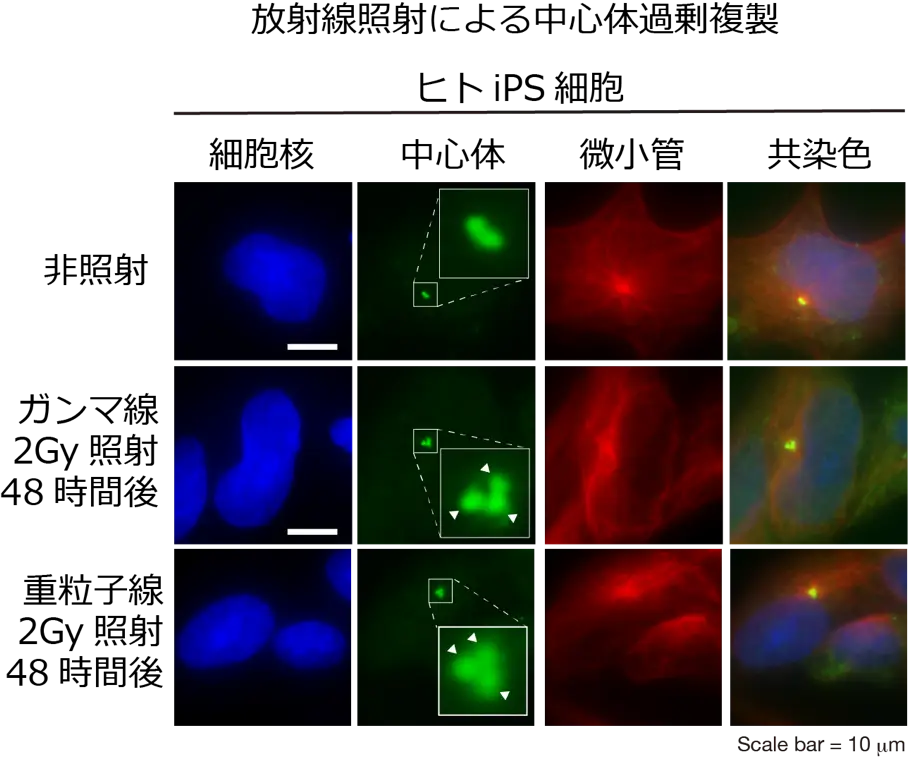
図2. 免疫染色によりヒトiPS細胞の細胞核(DAPI: 青)、中心体(pericentirn: 緑)、微小管(α-tubulin: 赤)を染色した。放射線照射によりヒトiPS細胞において正常な場合は一個ないし二個の中心体の数が増加している。
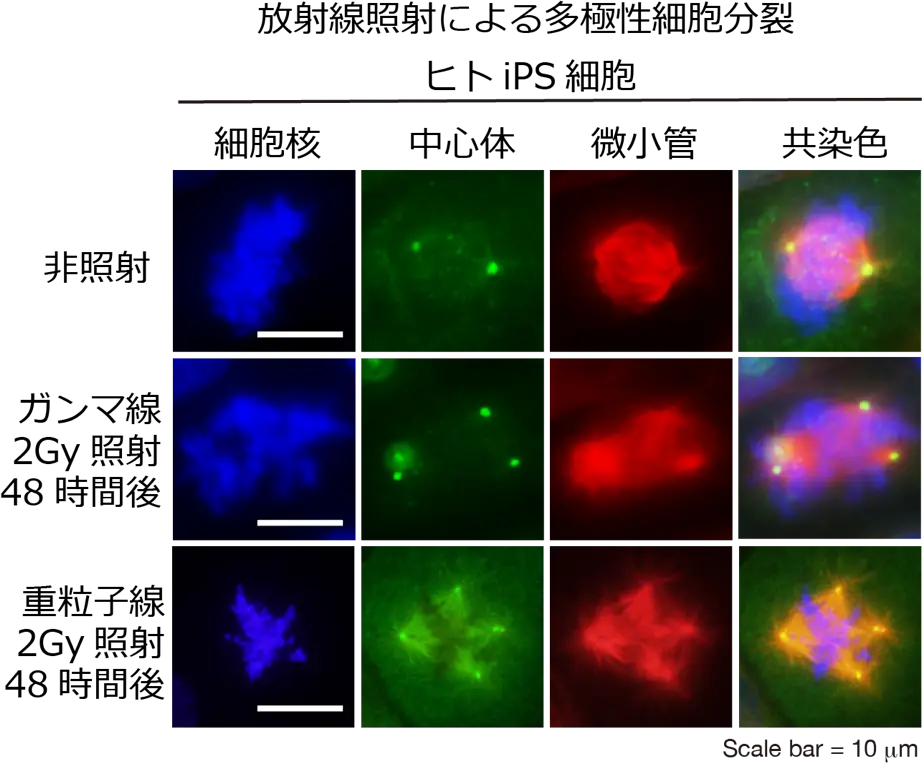
図3. 免疫染色によりヒトiPS細胞の細胞核(DAPI: 青)、中心体(pericentirn: 緑)、微小管(α-tubulin: 赤)を染色した。放射線照射により増加した中心体が原因で多極性細胞分裂が生じている。
ジメチルスルホキシドによる放射線防護効果
ジメチルスルホキシド(DMSO)は化合物の溶媒として使用されている有機溶媒です。反応性が高く、細胞内ではフリーラジカルと反応して不活化するラジカルスカベンジャーとして働きます。そのため、放射線に対する防護効果があることが知られていましたが、ヒトiPS細胞でも同じ効果があるかどうかは不明でした。また、放射線により惹起される中心体異常を抑制する効果があるかどうかもわかっていませんでした。
そこで本研究では、あらかじめDMSO 100 μMを加えたヒトiPS細胞にガンマ線と炭素線を照射した結果、いずれの照射においても中心体の過剰複製の頻度が減少することがわかりました。また、中心体の過剰複製に伴う細胞分裂死の割合も減少していました。これらの結果から、DMSOはヒトiPS細胞において放射線影響の一つである中心体異常を減少させる働きを持ち、放射線の防護効果を持つことがわかりました。
社会的インパクト
放射線は医学、産業と様々な場面で利用されており、現代社会に不可欠なツールとなっている一方で、不必要な被曝は健康被害の原因となります。そのため物理、化学、生物学的に適度にコントロールすることがよりよい放射線利用につながります。DMSOの重粒子線防護効果を明らかにした本研究成果は、放射線の医学利用に加えて、人類の宇宙進出においても課題となっている放射線防護への応用に結びつくことが期待されます。
今後の展開
本研究で使用したヒトiPS細胞は、様々な臓器・組織細胞に分化させることによる再生医療応用が期待されています。また、ヒトiPS細胞から作成される組織オルガノイドは基礎研究にも重要であることから、ヒトiPS細胞での放射線防護効果を明らかにした今回の研究成果は今後、放射線影響のみならず、発がん、疾患など病気の原因の解明につながることが期待されます。
- 付記
本研究を実施するにあたり、東京科学大学千代田テクノルコバルト照射施設の依田功部門長に実験補佐の支援を頂きました。本研究は量研機構重粒子線がん治療装置の共同利用の一環として行われました。本研究は日本学術振興会 科学研究費助成事業 (課題番号22K12369, 22H03032, JP15H02817, JP17K20042 and JP20H04334)、JST ERATO (課題番号JPMJER2102)、中部電力原子力安全技術研究所公募研究の支援のもと実施しました。
- 用語説明
[用語1] iPS細胞:多能性幹細胞の一種。分化した様々な組織細胞から樹立することが可能で、再生医療への応用が期待されている。
[用語2] 重粒子線:放射線の一種で、陽子線よりも重い粒子線を指し、がん治療においては「重粒子線」とは「炭素(12C6+)線」を意味します。
[用語3] 中心体:細胞内小器官の一つ。細胞分裂の際に極性中心として機能し、染色体の正確な分配に必須である。細胞周期に応じて細胞の中の中心体の数は変化するが基本的に1個ないし、2個存在する。これが過剰に複製されて3個以上存在する場合は細胞としては好ましくない状態であり、正常な細胞分裂ができなくなる。放射線は中心体の過剰複製を引き起こす原因となる。
[用語4] ジメチルスルホキシド(DMSO):有機化合物で溶媒として利用される。高濃度では細胞毒性効果があるが、低濃度ではラジカルスカベンジャーとして活性酸素の除去効果がある。
- 論文情報
| 掲載誌: | Radiation Research |
|---|---|
| 論文タイトル: |
Dimethyl Sulfoxide Attenuates Ionizing Radiation-induced Centrosome Overduplication and Multipolar Cell Division in Human Induced Pluripotent Stem Cells Dimethyl Sulfoxide Attenuates Ionizing Radiation-induced Centrosome Overduplication and Multipolar Cell Division in Human Induced Pluripotent Stem Cells |
| 著者: |
Mikio Shimada*, Ryoichi Hirayama, Yoshihisa Matsumoto *corresponding author |
| DOI: |
10.1667/RADE-24-00069.1 |
- α-グルコシルルチンがヒトiPS細胞の代謝を活性化する作用機序を解明|旧・東京工業大学
- iPS細胞における放射線応答の遺伝子発現変化を解明|旧・東京工業大学
- 放射線による皮膚への影響を解明|旧・東京工業大学
- 島田 幹男 Mikio Shimada|研究者検索システム Science Tokyo STAR Search
- 松本 義久 Yoshihisa Matsumoto|研究者検索システム Science Tokyo STAR Search
- 松本研究室
- ゼロカーボンエネルギー研究所
- 総合研究院|大学組織一覧|Science Tokyoについて
- Science Tokyo GXI
- 原子核工学コース(大学院課程)|教育|環境・社会理工学院 融合理工学系
- 融合理工学系(学士課程)|教育|環境・社会理工学院 融合理工学系
- 量子科学技術研究開発機構 QST病院
- 研究
お問い合わせ先
東京科学大学 総合研究院 ゼロカーボンエネルギー研究所
助教 島田幹男
E-mail : shimada.m.da17@m.isct.ac.jp
Tel / Fax : 03-5734-3703