生命理工学系 News
オートファゴソームの“口”を大きくする因子を発見
大きな細胞質成分を分解するためのメカニズム
要点
- 形成途中のオートファゴソームのかたちを制御するメカニズムを発見。
- Atg24複合体によって隔離膜の開口部が大きくなり、大きな細胞質成分でも分解されることを解明。
- ヒトのオートファゴソーム形成機構の理解が進み、オートファゴソーム関連疾患の創薬の基盤情報になると期待。
概要
東京工業大学 科学技術創成研究院 細胞制御工学研究センターの小谷哲也特任助教、中戸川仁教授(ライフエンジニアリングコース主担当)らは、オートファゴソームの形成時に、伸張中の隔離膜の開口端に局在化する因子として、Atg24複合体を同定した。さらにAtg24複合体が、伸張中の隔離膜の開口部を大きく開き、リボソームなどの大きな細胞質成分をオートファゴソームに取り込むことが可能になることを明らかにした。
オートファジーは、オートファゴソームと呼ばれる膜小胞[用語1]で細胞質の一部を取り囲み、液胞またはリソソーム[用語2]に運んで分解する機構である。オートファジーが誘導されると、隔離膜と呼ばれるカップ状の膜が細胞質成分を取り囲みながら伸張して球状になり、最終的に開口部が閉じることでオートファゴソームが形成される。この際には、隔離膜が大きな開口部を開けながら伸張することが分かっていたが、この形態がどのようにして維持されているのかはよく分かっていなかった。
本研究では、オートファゴソーム形成時の形態制御機構にAtg24複合体が関与していることを明らかにした。また隔離膜の開口部の大きさを変えることによってオートファジーで分解する成分を選択するという新たな制御の仕組みを提唱した。
本研究成果は東京工業大学 科学技術創成研究院の小谷哲也特任助教、中戸川仁教授、大隅良典栄誉教授、京都大学 医生物学研究所の境祐二特定准教授、順天堂大学 大学院医学研究科の角田宗一郎准教授らによって行われ、9月19日(現地時間)に英国科学誌「Nature Communications(ネイチャー・コミュニケーションズ)」で公開された。
背景
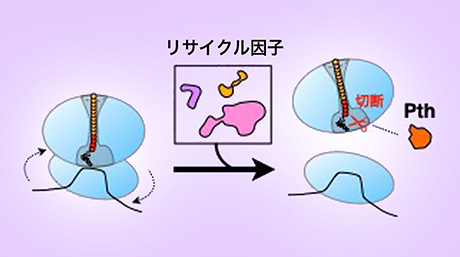
オートファジーは、酵母からヒトに至るまで真核生物に広く保存された細胞内の分解機構である。オートファジーが誘導されると、細胞質に隔離膜と呼ばれる脂質でできたカップ状の膜が現れる。この隔離膜がタンパク質や細胞小器官などを取り囲みながら伸張し、最終的に開口部(口)が閉じることで、2枚の膜を持ったオートファゴソームが形成される(図1上段)。これまでの電子顕微鏡による観察では、伸張中の隔離膜が口を大きく開けた形態になることが明らかになっていた。この隔離膜の口の部分は、膜がU字型に折れ曲がっているため、エネルギー的に不安定である。そのため、隔離膜が口を大きく開けた形態になるためには、この部分を安定化させる因子が必要であることが従来の数理解析から予想されていたが、そのような因子はこれまで見つかっていなかった。
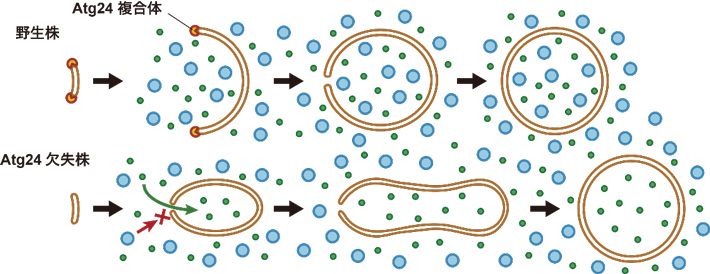
図1. Atg24複合体の作用機序
研究成果
Atg24/Snx4は、ホスファチジルイノシトール3-リン酸 (PI3P) [用語3]に結合するPXドメインと、屈曲した膜領域に結合して安定化するBARドメインを有するソーティングネキシンであり、別のソーティングネキシンであるAtg20/Snx42もしくはSnx41とヘテロ二量体(以降Atg24複合体と呼ぶ)を形成する。Atg24複合体はオートファジーに関わることが知られていたが、詳細な機能は分かっていなかった。本研究において、伸張中の隔離膜上でのAtg24複合体の局在状況を解析した結果、Atg24複合体は伸張中の隔離膜の口の縁に沿ってリング状に局在することが分かった。
Atg24複合体は、ペルオキシソームやミトコンドリア、リボソーム、プロテアソーム、脂肪酸合成酵素のオートファジーによる分解に重要であることが報告されている。一方で細胞質タンパク質Pgk1のオートファジーによる分解は、Atg24複合体には依存しない。Atg24複合体が隔離膜の口に結合することや、不安定な口の縁部分を安定化しうるBARドメインを持っていることから、Atg24複合体は隔離膜が口を大きく開けながら伸張することを可能にしているのではないかと考えられた。また、Atg24複合体には依存せずに分解されるPgk1のサイズは約10 nmであるが、Atg24複合体に依存して分解されるリボソームやプロテアソーム、脂肪酸合成酵素のサイズは約30 nmである。これらのことからATG24欠失細胞では伸張中の隔離膜の口が狭く、大きな細胞内成分がその中に入ることができないという可能性が考えられた(図1下段)。
そこで、細菌Listeria innocua由来のDNA結合タンパク質Dpsおよび細菌Aquifex aeolicus由来のルマジン合成酵素RibHが形成する、それぞれ約20 nmと25 nmの大きさの球状粒子がオートファジーで分解されるときに、Atg24複合体を必要とするかどうかを調べた。その結果、ATG24を欠失した細胞では、Dpsの分解の効率が下がり、RibHの分解はほとんど起こらなかった。これらの結果から、ATG24欠失細胞では約25 nm以上の大きさの細胞質成分をオートファゴソーム中に取り込めないことが示された。
次に隔離膜の口の大きさがAtg24複合体によって制御されているかどうかを調べた。隔離膜の口を、蛍光タンパク質を付けたAtg24でリング状に可視化して蛍光顕微鏡で観察し、その大きさを見積もった。その結果、Atg24複合体の構成因子であるAtg20を欠失させたり、Atg24の発現量を下げたりすると、隔離膜の口が狭くなることが示唆された。
最後にAtg24複合体に依存して大きな細胞質成分をオートファジーで分解することの生理的意義について検討した。ATG24欠失細胞では、窒素源飢餓時の生存率が低下することが明らかとなり、大きな細胞質成分を分解することが窒素源飢餓時の細胞の生存に重要であることが示唆された。
本研究により、Atg24複合体が伸張中の隔離膜の口を大きく開いた形態に維持することで、大きな細胞質成分も含めたあらゆる細胞質成分をオートファゴソームへ取り込めるようにしていることが明らかとなった。
社会的インパクト
オートファジーはヒトを含む真核生物に広く保存された細胞内の分解機構であり、神経変性疾患や癌などさまざまな疾患との関連が報告されている。オートファゴソーム形成に関わる因子の多くも保存されており、本研究で明らかにした隔離膜の形態制御機構も保存されていると考えられる。そのため、本研究成果はヒトにおけるオートファゴソーム形成機構の理解にも繋がると考えられることから、オートファゴソーム関連疾患に対する創薬のための基盤情報になると期待される。
今後の展開
本研究によって、Atg24複合体が結合することで伸張中の隔離膜の口が大きく開いた形態になることが明らかとなった。Atg24複合体によって大きく開いた口は、オートファゴソームを完成させるために閉鎖に向けて収縮していく必要がある。隔離膜の口を収縮させるためにはAtg24複合体が口から解離する必要があるが、その制御メカニズムは分かっていない。さらにATG24を欠失しても完成したオートファゴソームの大きさはそれほど変化しなかった。このことはオートファゴソームの大きさが、伸張中の隔離膜の口の大きさとは独立して制御されていることを示唆するが、その制御機構は良く分かっていない。今後、このような隔離膜の形態の制御機構を解明することで、オートファゴソーム形成機構のさらなる理解につながると期待される。
- 付記
本研究は、文部科学省科学研究費助成事業(中戸川仁:19H05708、17H01430、小谷哲也:19K16071、22K06123、境 祐二:23K05715)、上原記念生命科学財団(小谷哲也)、「東工大の星」支援【STAR】(中戸川仁)による支援を受けて行われた。
- 用語説明
[用語1] 膜小胞 : 脂質二重層でできた小さな膜の袋。細胞内の輸送や物質の貯蔵などに関与する。
[用語2] 液胞、リソソーム : 細胞小器官のひとつ。内部に加水分解酵素を含み、取り込まれたものを消化分解する。植物や酵母細胞の場合は液胞、動物細胞の場合はリソソームと呼ばれている。
[用語3] ホスファチジルイノシトール3-リン酸 : リン脂質の一種であるホスファチジルイノシトール(PI)のイノシトール環の3位の水酸基がリン酸化されたもの。オートファジーでは、Atg14を含むPI3-キナーゼ複合体によって隔離膜に含まれるPIがリン酸化され、PI3Pが生成される。
- 論文情報
| 掲載誌 : | Nature Communications |
|---|---|
| 論文タイトル : | A mechanism that ensures non-selective cytoplasm degradation by autophagy |
| 著者 : | Tetsuya Kotani, Yuji Sakai, Hiromi Kirisako, Chika Kakuta, Soichiro Kakuta, Yoshinori Ohsumi, Hitoshi Nakatogawa |
| DOI : | 10.1038/s41467-023-41525-x |
- オートファゴソームを効率よく作る仕組みを発見|生命理工学系 News
- オートファゴソーム膜を伸ばす仕組みを解明|生命理工学系 News
- オートファジーによる小胞体分解の分子メカニズムを解明|生命理工学系 News
- オートファゴソームに脂質を供給する仕組みを解明|生命理工学系 News
- オートファゴソーム前駆体を小胞体につなぎとめる|生命理工学系 News
- 細胞の核と小胞体を分解する新しい仕組みを発見|東工大ニュース
- 顕微鏡観察がすべての出発点~あらゆる生物に備わる生存戦略「オートファジー」と出会って~ ― 大隅良典|研究ストーリー|研究
- 中戸川仁准教授が第13回日本学術振興会賞を受賞|生命理工学系 News
- 中戸川准教授が、平成27年度「東工大の星」支援【STAR】に採択されました|生命理工学系 News
- 小谷哲也 Tetsuya Kotani|研究者検索システム 東京工業大学STARサーチ
- 中戸川仁 Hitoshi Nakatogawa|研究者検索システム 東京工業大学STARサーチ
- 大隅良典 Ohsumi Yoshinori|研究者検索システム 東京工業大学STARサーチ
- 中戸川研究室
- 中戸川研究室—研究室紹介 #7—|生命理工学系 News
- 生命理工学院 生命理工学系
お問い合わせ先
東京工業大学 科学技術創成研究院
細胞制御工学研究センター
特任助教 小谷哲也
E-mail kotani.t.ab@m.titech.ac.jp
東京工業大学 科学技術創成研究院
細胞制御工学研究センター
教授 中戸川仁
E-mail hnakatogawa@bio.titech.ac.jp
Tel 045-924-5735 / Fax 045-924-5743