生命理工学系 News
【創発的研究支援事業紹介】No. 6 野澤佳世 准教授
生命理工学院の教員が研究代表を務める研究課題が創発的研究支援事業に採択されました。創発的研究支援事業は、特定の課題や短期目標を設定せず、多様性と融合によって破壊的イノベーションにつながるシーズの創出を目指す「創発的研究」を推進するため、既存の枠組みにとらわれない自由で挑戦的・融合的な多様な研究を、研究者が研究に専念できる環境を確保しつつ長期的に支援する文部科学省の事業です。
採択された教員をクローズアップしてご紹介するシリーズ記事(全7回)を連載いたします。全7回のうち、第6回目は“遺伝子発現を制御するゲノム折り畳み構造のクライオ電子顕微鏡解析”の研究課題の研究代表を務める野澤佳世 准教授です。

野澤 佳世 准教授
| 居室 | B1B2棟707号室 |
|---|---|
| nozawa.k.ab@m.titech.ac.jp | |
| Tel/Fax | 045-924-5727 |
-まず、野澤先生の研究テーマを聞かせて下さい。
私たちの研究室では、遺伝子のオン・オフを規定する「DNAループ」を中心に、細胞の運命を決めるDNAの折り畳み構造をX線結晶構造解析やクライオ電子顕微鏡解析などの「原子の世界を覗く技術」で解明したいと考えています。体を構成する細胞が同一のゲノムDNA配列を持ちながら、発生・分化の過程で異なった組織を形成できるのは、DNA折り畳み構造が細胞の運命を決定しているからです。真核生物のゲノムDNAは、円盤状のヌクレオソーム構造を基盤として高度に折りたたまれ、タンパク質の設計図であるmRNAの合成は、ゲノムDNAのダイナミックな構造変化によって制御されています。このクロマチン構造の破綻は、がん、生活習慣病、精神疾患など様々な病気を引き起こしますが、立体構造からその原因を究明することができます。
-この研究を始めたきっかけを聞かせて下さい。
私は大学院時代は、タンパク質翻訳の過程で終止コドンに22番目のアミノ酸を割り当てるPylRS-tRNAPyl複合体や翻訳とカップルしたtRNAの核外輸送を担う因子Cex1pの研究をしていましたが、セントラルドグマの流れをより総合的に理解したいと思うようになり、翻訳の多様性を根本から拡張する遺伝子転写やゲノム構造の研究をスタートさせました。学位取得後にRoger Kornberg博士のノーベル賞受賞研究を行ったPatrick Cramer博士の研究室に5年3ヶ月留学して、DNAループの構成因子である転写メディエーターの研究に打ち込みました。
ヒトは約2万種類のタンパク質遺伝子から構成されていますが、細胞の分化や発生状態に応じたタンパク質発現をコントロールするために、エンハンサーDNAの数は数十万にものぼります。興味深いことにエンハンサーDNAからのタンパク質遺伝子の活性化シグナルは、数キロから 数十Mbpもの長鎖DNAを経て標的遺伝子のプロモーターDNAへと伝わり、この情報伝達は2つのDNA領域が物理的に近接して「DNAループ」構造を作ることによって行われています。転写メディエーターは、真核生物特有の転写コファクターであり、この膨大なエンハンサーDNAとプロモーターDNAを対合させ、転写開始点にRNAポリメラーゼII (RNAPII)をリクルートすることで、ほぼすべてのタンパク質発現をコントロールしています。私は留学中に、転写メディエーターの各サブユニットをポリシストロニックに組み込んだ共発現系を作り、酵母の生存に必要不可欠な16サブユニット全ての発現系を構築し、結晶構造から転写メディエーターとRNAPIIの新たな結合面を発見しました。今後は、このマルチサブユニット複合体の発現系を足掛かりにして、ゲノム高次構造による遺伝子制御機構を解明したいと考えています。
-今回の創発的研究支援事業で取り組まれる具体的な研究内容を
聞かせて下さい。
創発研究では、2017年にノーベル化学賞を受賞したクライオ電子顕微鏡法を主軸として、細胞内環境を反映した形でゲノムの折り畳み構造を観察する技術の開発に取り組みます。クライオ電子顕微鏡解析法を用いれば、氷包埋した分子の複数の溶液構造を一挙に構造解析することが可能であり、得られたスナップショット構造群をつなぎ合わせることで、分子のダイナミクスや酵素反応を一連のムービーのように理解することができます。最近では、クライオ電子線トモグラフィー法の発展も目覚ましく、電子顕微鏡のステージを傾けることで、凍結細胞のスライスを様々な角度から撮影して、細胞内タンパク質を原子分解能で解明することも可能になってきています。
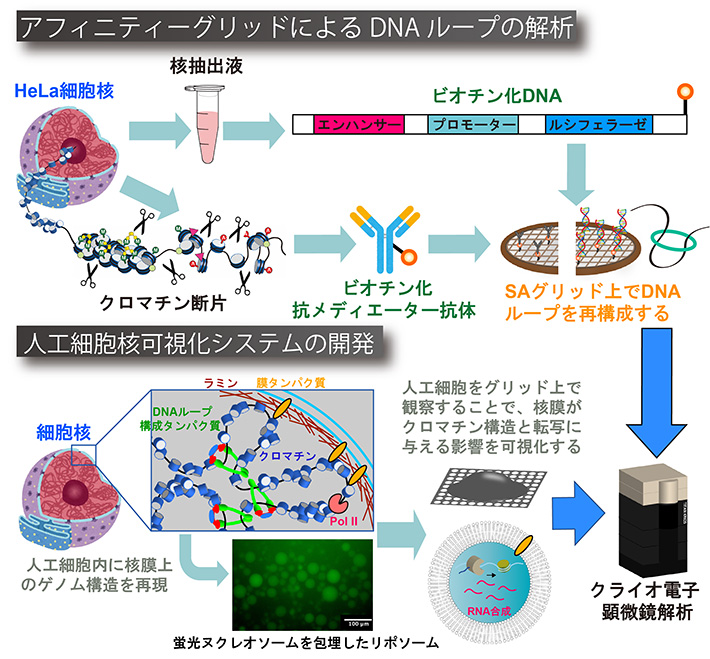
一つ目の課題では、ヒトへの応用研究を見据えて、HeLa細胞から抽出したDNAループ構造をクライオ電子顕微線トモグラフィー法によって可視化したいと考えています。私たちは、本課題を推進するために、組織からのDNAループの単離と構造観察の両方を可能にしたストレプトアビジン (SA)グリットを用いた構造解析スキームを開発したいと考えています。本課題では、SAグリッド上にエンハンサーとプロモーター配列を含むDNA基質や抗メディエーター抗体をベイトとしてディスプレイして、核抽出液やクロマチン・フラグメントを添加することで、試料用グリッド上で夾雑物の中からDNAループ複合体を精製し、細胞内に近い状態で観察したいと考えています (図)。本研究で開発するSAグリッドは、クロマチンに限らず細胞内の標的タンパク質を直接グリッド上に付加する技術であるため、創薬技術に応用すれば、薬剤スクリーニングと同時にその標的タンパク質との複合体の構造解析も行える新しい技術プラットフォームとして利用することも可能だと考えられます。
もう一つの課題では、人工膜内にDNAループ複合体とラミンを包埋することで、膜局在化したゲノム構造を再現したいと考えています (図)。細胞核の内側には、ラミン・タンパク質が網目構造 (ラミナ) を形成すると同時に、ラミナ自体がゲノムDNAと直接相互作用することで、核膜にゲノムを連結しています。近年、ヒトやマウスでは全ゲノムの4割がラミナと相互作用していることが報告され、核膜がクロマチン構造の組織化やゲノム複製、遺伝子転写を時空間的に調節していることが明らかとなってきました。核膜とクロマチンの相互作用の破綻はヒトでは、早老症を招くことが知られており、上述したDNAループも核膜孔複合体を介して核膜付近に存在していることが示唆されていますが、その詳細は全く明らかになっていません。本研究で取り組む人工細胞核可視化システムは、細胞内容物のバックグラウンドが全くない状態で、膜に裏打ちされたゲノム構造を高分解能で観察することができる前例のないアプローチです。
-今後の目標を聞かせて下さい。
私たちは、構造解析によって可視化されたDNAループの機能を、ヒトの高次生命現象の理解に役立てることを目標にしています。創発研究により細胞抽出液からの内因性複合体の構造解析が可能になれば、従来の遺伝学や生化学的な解析では見逃されていたDNAループに関わる新規因子の発見が期待されます。また近年、個別の転写メディエーター・サブユニットの変異が10種類以上の異なる組織のガンに関係していることが報告され、転写メディエーターの疾患マーカーや薬剤の分子標的としての利用にも期待が高まっています。中でも、ガン原遺伝子の上流で多量の転写メディーターがクラスターを作り、遺伝子の異常な活性化を招くスーパーエンハンサー構造の解明が待たれています。DNAループはゲノム折り畳み構造の基盤であるため、この構造を試験管内で組み上げることができれば、腫瘍細胞特異的なスーパーエンハンサーを再現することも可能であり、その領域を標的としたゲノム創薬に大きく貢献できると考えています。また人工細胞核可視化システムは、これまでほとんどフォーカスされて来なかった「核膜やゲノム三次構造による転写制御」を明らかにします。DNAループの作用機序を理解できれば、任意の遺伝子制御機能を持ったDNAループを設計し、ゲノムに導入することで、ゲノム編集より複雑な遺伝子制御機能を細胞に与えることも可能になると考えています。