生命理工学系 News
発生過程の胚での最初の遺伝子発現のきっかけを作る重要なヒストン修飾を発見
要点
- 発生過程の生きたままの胚で、転写活性化とヒストン修飾の変化を追跡することに成功。
- 胚ゲノムからの最初の転写に、ヒストンH3の27番目リシン残基のアセチル化修飾が重要な役割を果たしていることを確認。
概要
東京工業大学 科学技術創成研究院 細胞制御工学研究センターの木村宏教授の研究グループ(佐藤優子助教(共に生命理工学コース主担当)、小田春佳日本学術振興会特別研究員)は、マックスプランク研究所(ドイツ)、ジャネリア・リサーチキャンパス(米国)、ニューヨーク大学(米国)の研究グループとの国際共同研究により、発生過程の生きたゼブラフィッシュ胚において、転写活性化とヒストン修飾の変化を観察することに成功しました。さらに、取得した画像の定量解析により、ヒストンH3の27番目リシン残基のアセチル化修飾が胚ゲノム活性化に重要な役割を果たしていることを明らかにしました。
今回の研究により、生物個体の発生や分化の過程での遺伝子発現の制御には、ヒストンのアセチル化が重要であることが示されました。また、研究チームが開発したタンパク質修飾の生細胞観察手法の有用性が実証され、アセチル化修飾の詳しい仕組みの解明を目指す今後の研究への活用が期待されます。
この成果は9月30日付でDevelopment誌に掲載されました。
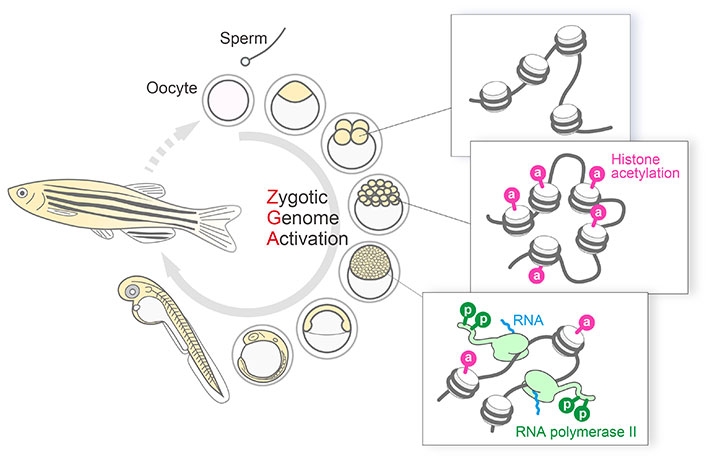
研究の背景
有性生殖[用語1]では、卵子と精子が受精すると、それぞれが持つDNAが混ざり合い、「胚ゲノム」となります。受精後しばらくの間は、この胚ゲノムが眠った状態(転写活性がない状態[用語2])で胚発生が進みます。この間は、卵子に蓄積されていたRNAやタンパク質(母性因子)を使って細胞機能が営まれます。母性因子の貯蓄がなくなるころ、胚ゲノムは目覚め、大規模な転写の活性化がおこり、細胞の分化[用語3]が始まります(図1)。この胚ゲノムの活性化は古くから知られた現象ですが、それがどのように制御されているのかについては、未だ不明な部分が多く残されています。最近の研究から、ヒストン修飾[用語4]による活性化の制御が重要であることが示唆されていました。
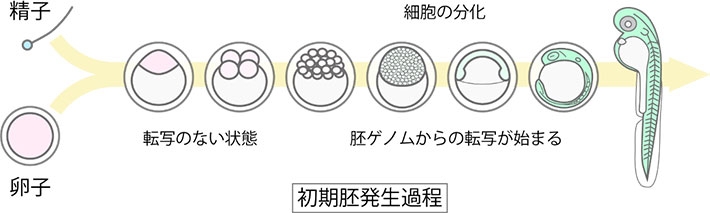
図1. ゼブラフィッシュ発生過程
精子と卵子が受精して受精卵を形成すると、胚発生が始まる。ゼブラフィッシュの場合、受精後およそ3時間で1,000細胞まで分裂する。この間は、胚ゲノムからの遺伝子発現は起こらず、卵子に蓄積されたRNAやタンパク質を利用して細胞機能が営まれている。1,000細胞期になると胚ゲノムからの大規模な転写活性化が起こり、細胞の分化が始まる。
研究成果
木村教授の研究グループはこれまで、RNAポリメラーゼ(転写を行う酵素)やヒストン(DNAと強く結合するタンパク質)などの翻訳後修飾を、部位特異的に認識するモノクローナル抗体を作出してきました。また、これらのモノクローナル抗体から生細胞プローブ[用語5]を開発し、修飾動態の変化を計測するシステムFabLEM(Fab-based Live Endogenous Modification Labeling)を構築しました。今回木村教授の研究グループは、ゼブラフィッシュ胚にFabLEMを適用し、転写活性化とヒストン修飾のダイナミクスを、発生過程の生きた胚の中で追跡することに成功しました(図2)。さらに、国際共同研究により取得した蛍光顕微鏡画像の定量解析を行い、胚ゲノムの活性化において、ヒストンH3の27番目リシン残基のアセチル化修飾が重要な役割を果たしていることを明らかにしました。特に、胚ゲノム活性化の初期に高レベルで発現するmiR-430遺伝子クラスター[用語6]上で、アセチル化修飾と活性型RNAポリメラーゼが順番に濃縮する様子を詳しく観察することができました(図3)。また、RNAポリメラーゼを阻害してもヒストンのアセチル化修飾が集積するのに対して、アセチル化ヒストンに結合するタンパク質を阻害すると転写が起こらなくなることも確認しました。
本研究は、生物個体の発生や分化の過程における遺伝子発現の制御にヒストンのアセチル化が重要であることだけでなく、研究グループが開発したタンパク質修飾の生細胞観察手法が広く応用可能であり、今後の研究に有用であることも示しました。
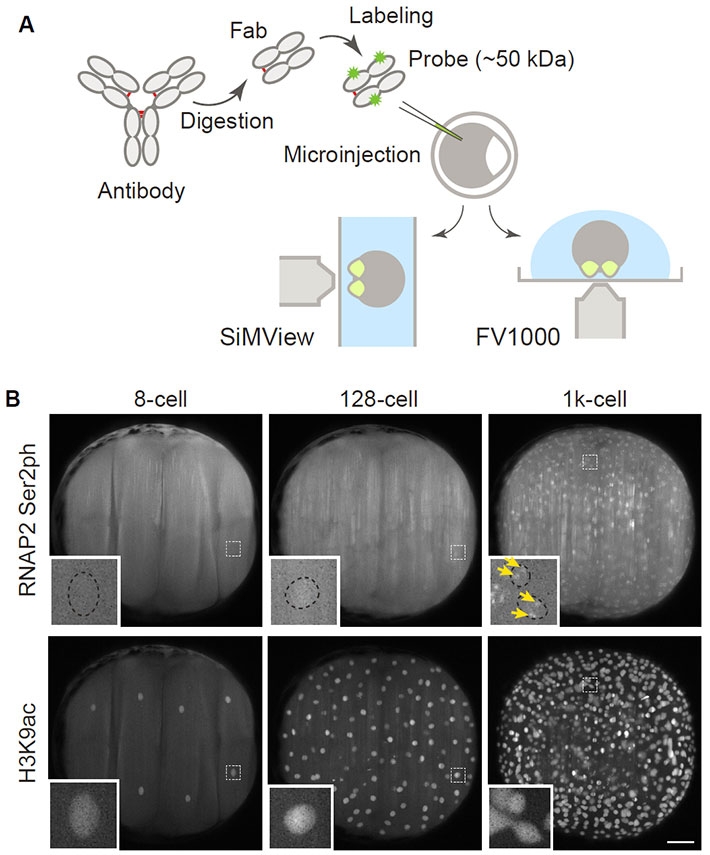
図2. FabLEMによる転写活性化およびヒストン修飾動態観察
(A)FabLEMの概要。リン酸化型RNAポリメラーゼやヒストンの翻訳後修飾に特異的な抗体の抗原結合部位(Fab)を、蛍光色素で標識したうえで、1細胞期のゼブラフィッシュ胚にマイクロインジェクションにより導入する。4細胞期まで発生させた胚をアガロースに埋めこんで、ライトシート蛍光顕微鏡(SiMView)および共焦点蛍光顕微鏡(FV1000)を用いて観察する。(B)胚ゲノム活性化の可視化。Ser2リン酸化型RNAポリメラーゼ(RNAP2 Ser2ph)とヒストンH3 Lys9アセチル化(H3K9ac)を認識するFabを導入した胚を、SiMViewを用いて観察した。転写活性化の指標であるRNAP2 Ser2phのシグナルは、8細胞期(8-cell)では核内(拡大図中、点線枠)に見られないが、1,000細胞期(1k-cell)まで発生が進むと核内に集積する様子が見られた(拡大図中、黄色矢印)。一方で、H3K9acシグナルは発生の早い段階(8細胞期;8-cell)からすでに細胞核内に濃縮されていた。スケールバーは100 μm。
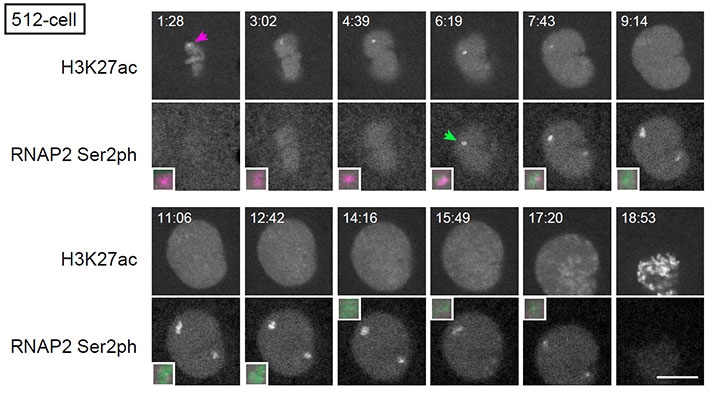
図3. miR-430遺伝子クラスターにおけるヒストンアセチル化と転写活性化
Ser2リン酸化型RNAポリメラーゼ(RNAP2 Ser2ph)とヒストンH3 Lys27アセチル化(H3K27ac)を認識するFabを導入した胚を、共焦点蛍光顕微鏡(FV1000)を用いて観察した。512細胞期の1個の核に注目し、細胞分裂直後から次の分裂期間まで経時的に画像を取得した。撮影開始からの経過時間を各画像の上方に表示した(分:秒)。H3K27acシグナルは分裂期直後(1:28)から2箇所に集積する様子が見られた(2つのうちの片方をマゼンタ色矢印で表示)。RNAP2 Ser2phシグナルは、H3K27acよりも遅れて同じサイトに集積した(6:19、緑色矢印)。拡大図は、H3K27ac(マゼンタ)とRNAP2 Ser2ph(緑)のシグナルが集積した場所(重ね合わせ)。スケールバーは10 μm。
今後の展開
今回、ヒストンのアセチル化修飾が胚ゲノムの転写活性化を引き起こすことが明らかになりました。しかし、アセチル化修飾によって胚ゲノムに具体的にどのような変化が起きているのか、アセチル化修飾がどのようなきっかけで上昇するのかなど、まだたくさんの疑問が残されています。今後も生細胞プローブを使って、このような問題をひとつずつ紐解いていく予定です。
- 用語説明
[用語1] 有性生殖 : 有性生殖をおこなう生物は、生殖のための特別な細胞「配偶子」(例えば、精子と卵子)を作り、異なる性の個体同士で配偶子を合体させることにより、両親とは違う新しい個体を作り出します。
[用語2] 転写活性がない状態 : 遺伝子からRNAポリメラーゼにより遺伝暗号(コドン)が読み取られ、メッセンジャーRNAが作られる過程を「転写」と呼びます。メッセンジャーRNAが翻訳されることでタンパク質が作られます。タンパク質合成は細胞機能に必須であるため、初期胚の発生過程でゲノムがいったん目覚めたあとは、生きている細胞では常に転写が行われています。
[用語3] 細胞の分化 : 細胞が、特定の機能や形態を持つ状態へ変化することを「分化」と呼びます。発生初期の分化していない状態(未分化)の細胞は、きっかけを与えることで神経細胞や表皮細胞へ分化します。我々の体は、1個の受精卵が増殖と分化を繰り返すことで生じた、多様な細胞から成り立っています。
[用語4] ヒストン修飾 : 真核生物のDNAは細胞核の中で、ヒストンたんぱく質と強く結合してヌクレオソーム構造を作っています。近年の研究から、アセチル化やメチル化などのヒストン修飾による遺伝子制御は、様々な細胞機能の基盤であることが分かってきています。
[用語5] 生細胞プローブ : 生きた細胞の中の物質の動態を追跡するツールを「生細胞プローブ」と呼びます。
[用語6] miR-430遺伝子クラスター : DNAから転写されて生成したRNAのうち、翻訳されないRNAを「ノンコーディングRNA」と呼び、そのうちのひとつに「マイクロRNA」があります。miR-430は、ゼブラフィッシュの胚ゲノム活性化の初期に転写され、卵子由来のRNAの分解に関与しています。
- 論文情報
| 掲載誌 : | Development |
|---|---|
| 論文タイトル : | Histone H3K27 acetylation precedes active transcription during zebrafish zygotic genome activation as revealed by live-cell analysis |
| 著者 : | Yuko Sato, Lennart Hilbert, Haruka Oda, Yinan Wan, John M. Heddleston, Teng-Leong Chew, Vasily Zaburdaev, Philipp Keller, Timothee Lionnet, Nadine Vastenhouw, and Hiroshi Kimura |
| DOI : | 10.1242/dev.179127 |
- 生細胞イメージングのための新しい分子ツールを開発|生命理工学系News
- エピジェネティックマークを生体内で観るための細胞内抗体プローブを開発|生命理工学系News
- 大隅栄誉教授率いる細胞制御工学研究センターを設置|生命理工学系News
- 受精卵から体の様々な細胞や組織に分化する仕組みの解明~エピゲノムの研究~ ― 木村宏|研究ストーリー|研究
- 木村研究室
- 研究者詳細情報(STAR Search) - 木村宏 Hiroshi Kimura
- 研究者詳細情報(STAR Search) - 佐藤優子 Yuko Sato
- 東京工業大学 科学技術創成研究院 (IIR)
- 東京工業大学 科学技術創成研究院 細胞制御工学研究センター
- 生命理工学院 生命理工学系
- 研究成果一覧
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
教授 木村宏
E-mail : hkimura@bio.titech.ac.jp
Tel : 045-924-5742 / Fax : 045-924-5973