生命理工学系 News
【研究室紹介】 上田研究室(~2022.12)
抗体、酵素のエンジニアリングによる新規生体システムの創製
生命理工学系にはライフサイエンスとテクノロジーに関連した様々な研究室があり、基礎科学と工学分野の研究のみならず、医学や薬学、農学等、幅広い分野で最先端の研究が活発に展開されています。
研究室紹介シリーズでは、ひとつの研究室にスポットを当てて研究テーマや研究成果を紹介。今回は、より優れた検出・診断・治療システムの創製を目指す、上田研究室です。
※上田教授は2022年12月にご逝去されました。

ライフエンジニアリングコース
教授 上田宏
| キーワード | タンパク質工学、抗体工学、バイオセンサー |
|---|---|
| Webサイト | 上田・北口研究室 |
研究紹介
タンパク質を用いた新規ツール・方法論の開発
私たちの研究室では、タンパク質工学をベースに、抗体や酵素を用いた新しい検出・診断法、さらにはがんなど難治疾患の治療法の開発に取り組んでいます。基本となる生物(化学)工学・生命工学の知識をもとに、独自のアプローチで、抗体工学、酵素工学、免疫工学、分析化学といった分野で研究を展開しています。なかでも特に、現代のバイオテクノロジー産業を牽引する、組み換え抗体を用いた微量物質検出法(免疫測定法)の開発、ならびに発光酵素を用いたタンパク質間相互作用検出系の開発に力を入れており、以下にそれらの一端を紹介したいと思います。
抗体を用いた新しい検出原理(オープンサンドイッチ法)
抗体は我々の体内で病原体などの外敵(抗原)から身を守るために働く重要なタンパク質です。生体内外を問わず、各種の抗原を特異的に認識できる抗体は、生物学の基礎研究から病気の診断・治療において幅広く用いられています。抗体はその構造上、各種抗原に特異的に結合する可変領域と定常領域に分けることができます(図1左)。近年、その可変領域断片を大腸菌等の微生物で発現させ、抗原結合能などの性能を向上させる技術(抗体工学)が発展し、抗体医薬(ヒト型抗体)の実用化にも大きく貢献してきました。検出・診断分野における抗体の利用(免疫測定)も、その有用性から年々増加していますが、これまでの免疫測定法はその実施に手間と時間がかかり、測定対象が低分子とタンパク質のような高分子の場合で測定原理を変更しなければならなかったりする問題がありました。
我々は、約20年前に抗体断片を構成する2 つの可変領域断片VHとVLとの相互作用が、共存する抗原濃度依存的に増大する現象を見出し、これを用いた免疫測定法(オープンサンドイッチ法・図1右)を提唱しました。その後、この原理を用いると、各種の低分子化合物やペプチドなど、通常のサンドイッチ免疫測定では測定できない低分子が高感度に検出出来ることが判明し、分析化学の新手法として有用性が示されてきました。
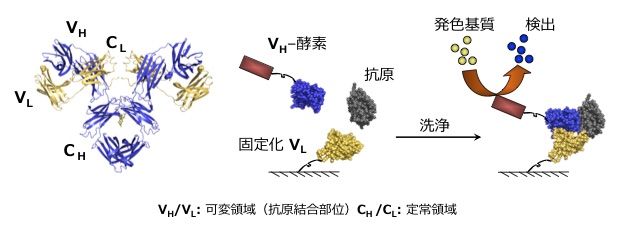
図1. 抗体の構造(左)と、オープンサンドイッチELISA法(右)
抗原結合により光る抗体Quenchbodyの開発
通常のオープンサンドイッチ法は、例えばVL断片を固相に固定しておき、VH断片に酵素を結合させておいたものとサンプルを混合して固相と反応させ、一定時間後に洗浄して固相に残ったVH断片量を酵素活性から検出する酵素免疫測定(ELISA)法を用いて行われます(図1右)。オープンサンドイッチELISA法を含め、これまでの殆どの免疫測定法は、サンプルとの反応後、洗浄を行ってから酵素反応などの測定を行う方法(非均一系と呼ぶ)となっています。これらは感度や精度の面では優れていますが、複数の反応と洗浄ステップを含むため測定に時間と手間がかかる問題がありました。もし溶液中(均一系)で抗体の各種抗原との結合を簡便迅速に調べることのできる汎用的な検出法があれば、免疫測定の世界を一新できる可能性があります。我々は最近、抗体断片を特殊な方法で部位特異的に蛍光標識することにより、抗原が結合するとその蛍光強度が顕著に増大し、混ぜて蛍光強度を測定するだけで抗原を検出できる抗体を作りだすことに成功しました。
その経緯は以下のようです。まず、VH断片とVL断片に色(励起・蛍光波長)の異なる2 種類の蛍光色素を修飾し、両者が抗原を介して相互作用(結合)すると、それによって2 つの色素間でエネルギー移動(蛍光共鳴エネルギー移動:FRET)が起きることを利用し、混ぜるだけで抗原測定が出来るようにしようと考えました(図2上)。このためには、2 つの抗体断片をそれらの活性に影響を与えずに蛍光ラベルする必要があります。そこで、最近開発された無細胞タンパク質合成系を用いた部位特異的修飾法を用いることにしました。この方法によれば、各種の蛍光色素で抗体断片のアミノ末端近傍の1箇所のみを修飾できると期待され、実際、赤の色素(TAMRA)で修飾したVHと、緑の色素(RGreen)で標識したVLの2 種類を調製でき、両者を混合して骨疾患の診断マーカーである抗原BGPの蛍光検出に成功しました。
ところが、ここで念のため対照実験としてTAMRA標識VHと未標識VLを混合して蛍光測定を行った所、予想外の結果が得られました(図2下)。すなわち、抗原濃度依存的に蛍光強度が有意に上昇したのです。
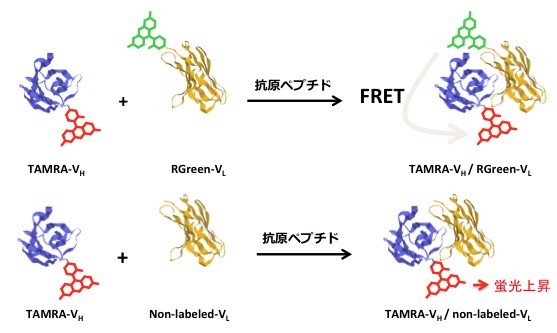
図2. FRETによる抗原検出(上)と、予想外の結果(下)
上記の結果をふまえ、我々は次に、VHとVLをリンカーペプチドで結合した一本鎖抗体(scFv)と呼ばれる組換え抗体断片のアミノ末端近傍を同様の方法で蛍光ラベルし、その蛍光強度の抗原依存性を調べました。その結果、驚くべき事にこのタンパク質は、抗原添加前には何らかの理由により蛍光がクエンチされているが、抗原を添加するとそのクエンチが解除され、約6倍の蛍光を発することが明らかとなりました。またその検出感度も従来のELISA法とほぼ同等で、類似分子の交差反応性も保たれていました。そこで蛍光クエンチの原因を調べた所、抗体内部にある数個のトリプトファン(Trp)残基を構造類似のフェニルアラニンに変異させると応答性が減少することが判明しました。すなわち、抗原不在時には抗体構造が不安定で、疎水的な蛍光色素はVH/VLの間に入り込み、これらの内部残基が蛍光をクエンチしていること、また、抗原を添加するとVH/VL/抗原の複合体が構造的に安定化し、色素が外部に露出してクエンチが解除し発光するメカニズムが明らかになりました(図3)。
さらに抗体中のトリプトファン残基は保存性が高く、他の抗原を認識するscFvでも同様の蛍光変化が見られ、血漿など共存物質の影響も少ないことが分かりました。混ぜるだけで数分以内に抗原が検出出来る新規免疫素子として我々はこのような蛍光標識抗体断片をQuenchbody(Q-body)と名付けました[15]。
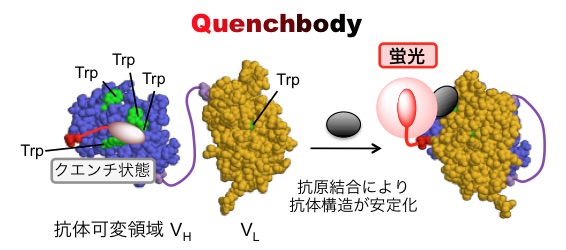
図3. クエンチボディ(Quenchbody, Q-body)の作動機構
以来、Q-bodyにより、タンパク質の特定部位のリン酸化が検出可能なこと、TAMRA以外に数種の波長の異なる色素が利用できること、色素を複数導入することで応答性を向上できること、などが明らかとなりました[10]。さらに大腸菌を培養して作った蛍光修飾Fab断片を用いて、高感度な違法薬物検出や細胞イメージングができることも明らかとなっています[7]。今後、各種疾患の臨床検査分野、抗癌剤などの血中薬物濃度モニタリングなどの医療分野、生物・化学テロ防止や覚せい剤検出といった安心/安全分野、水質・大気調査、残留農薬検査などの環境分野などで、迅速簡便高感度かつ実用的な検出素子として、また生物学の基礎研究ツールとしてQ-bodyが幅広く利用されることが期待されます。
発光酵素を用いたタンパク質間相互作用検出系の開発
ヒトゲノムとそこにコードされるタンパク質の実体がほぼ明らかになって10年以上が経過しました。しかし、生命の神秘は未だ解明されたとは言い難く、様々な病気の原因も不明です。その一因として、タンパク質の機能、特にタンパク質同士の相互作用について、理解が不十分なことがあげられます。現在、ヒト細胞内には、15〜30万種類のタンパク質間相互作用が存在すると言われています。 これらの時間的・空間的な変化やその制御機構の理解は、生命現象の解明に不可欠であるのみならず、疾患治療薬の開発などのために極めて重要です。
このような相互作用検出法の一つとして、特に細胞内での検出に良く用いられるProtein-fragment Complementation Assay(PCA)と呼ばれる方法があります。PCAにおいては、酵素や蛍光タンパク質などのレポータータンパク質を2つに分割してプローブとし、相互作用パートナーにそれぞれ融合させます。相互作用時にこれらプローブが近接し、レポータータンパク質が再構成し活性を回復することを利用して相互作用を検出します。この系は、特に細胞内で迅速、簡便に相互作用が検出できる特徴がありますが、プローブが不安定で精製タンパクを用いた試験管内での測定が難しい問題がありました。そこで我々は最近、このような問題のない酵素変異体同志の活性相補を原理とする新規タンパク質間相互作用検出系、FlimPIA(Firefly luminescent intermediate Protein-protein Interaction Assay)を開発しました[3][8]。この方法では、タンパク質そのものは分割しないため、PCAよりプローブが安定で、試験管内での同条件で100倍近い発光強度が得られる事、より長い距離間での相互作用が検出出来ることなどのメリットが判明しています。プローブ改良で性能も向上しつつあり、今後幅広い相互作用検出系への利用が期待されます。
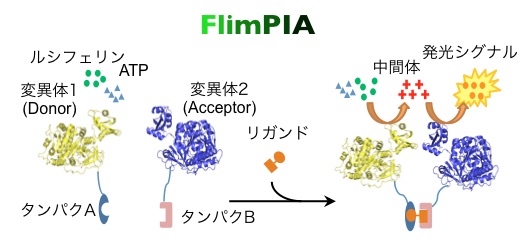
図4. 新原理のタンパク質間相互作用検出系FlimPIAの動作原理
研究成果
代表論文
- [1] J. Dong, M. Shichiri, C.-I. Chung, T. Shibata, K. Uchida, Y. Hagihara, Y. Yoshida and H. Ueda "An Open Sandwich immunoassay for detection of 13(R,S)-Hydroxy-9(E),11(E)-octadecadienoic acid" Analyst 142, 787 - 793 (2017).
- [2] H. Ohashi, T. Matsumoto, H.-J. Jeong, J. Dong, R. Abe and H. Ueda "Insight into the working mechanism of Quenchbody: Transition of the dye around antibody variable region that fluoresces upon antigen binding" Bioconj. Chem. 27, 2248-2253 (2016).
- [3] M. Kurihara, Y. Ohmuro-Matsuyama, K. Ayabe, T. Yamashita, H. Yamaji and H. Ueda "Ultra sensitive firefly luciferase-based protein-protein interaction assay (FlimPIA) attained by hinge region engineering and optimized reaction conditions" Biotechnol. J. 11, 91-99 (2016).
- [4] H.-J. Jeong, T. Kawamura, J. Dong and H. Ueda "Q-bodies from recombinant single-chain Fv fragment with better yield and expanded palette of fluorophores" ACS Sens. 1, 88-94 (2016).
- [5] H. Iwai, M. Kojima-Misaizu, J. Dong and H. Ueda "Creation of a ligand-dependent enzyme by fusing circularly permuted antibody variable region domains" Bioconj. Chem. 27, 868-873 (2016).
- [6] C.-I. Chung, R. Makino, J. Dong and H. Ueda "Open flower fluoroimmunoassay: a general method to make fluorescent protein-based immunosensor probes" Anal. Chem. 87, 3513-3519 (2015).
- [7] R. Abe, H.-J. Jeong, D. Arakawa, J. Dong, H. Ohashi, R. Kaigome, F. Saiki, K. Yamane, H. Takagi and H. Ueda "Ultra Q-bodies : quench-based antibody probes that utilize dye-dye interactions with enhanced antigen-dependent fluorescence" Sci. Rep. 4, 4640 (2014).
- [8] Y. Ohmuro-Matsuyama, K. Nakano, A. Kimura, K. Ayabe, M. Ihara, T. Wada and H. Ueda "A protein-protein interaction assay based on the functional complementation of mutant firefly luciferases" Anal. Chem. 85, 7935-7940 (2013).
- [9] Y. Ohmuro-Matsuyama, C.-I. Chung and H. Ueda "Demonstration of protein-fragment complementation assay using purified firefly luciferase fragments" BMC Biotechnol. 13, 31 (2013).
- [10] H.-J. Jeong, Y. Ohmuro-Matsuyama, H. Ohashi, F. Ohsawa, Y. Tatsu, M. Inagaki and H. Ueda "Detection of vimentin serine phosphorylation by multicolor Quenchbodies" Biosens. Bioelectron. 40, 17-23 (2013).
- [11] J. Dong, A. Sakurai, N. Nomura, E.Y. Park, F. Shibasaki and H. Ueda "Isolation of recombinant phage antibodies targeting the hemagglutinin cleavage site of highly pathogenic avian influenza virus" PLoS ONE 8, e61158 (2013).
- [12] K. Minami, M. Ihara, S. Kuroda, H. Tsuzuki and H. Ueda "Open-sandwich molecular imprinting: making a recognition matrix with antigen-imprinted antibody fragments" Bioconj. Chem. 23, 1463-1469 (2012).
- [13] M. Kojima, H. Iwai, J. Dong, S.-L. Lim, S. Ito, K. Okumura, M. Ihara and H. Ueda "Activation of circularly permutated β-lactamase tethered to antibody domains by specific small molecules" Bioconj. Chem. 22, 633-641 (2011).
- [14] K.N. Islam, M. Ihara, J. Dong, N. Kasagi, T. Mori and H. Ueda "Direct construction of an open-sandwich enzyme immunoassay for one-step noncompetitive detection of thyroid hormone T4" Anal. Chem. 83, 1008-1014 (2011).
- [15] R. Abe, H. Ohashi, I. Iijima, M. Ihara, H. Takagi, T. Hohsaka and H. Ueda" "Quenchbodies" : quench-based antibody probes that show antigen-dependent fluorescence" J. Am. Chem. Soc. 133, 17386-17394 (2011).
- [16] H. Iwai, B. Oztürk, M. Ihara and H. Ueda "Antibody affinity maturation in vitro using unconjugated peptide antigen" Protein Eng. Des. Sel. 23, 185-193 (2010).
- [17] M. Ihara, A. Yoshikawa, Y. Wu, H. Takahashi, K. Mawatari, K. Shimura, K. Sato, T. Kitamori and H. Ueda "Micro OS-ELISA: Rapid noncompetitive detection of a small biomarker peptide by open-sandwich enzyme-linked immunosorbent assay (OS-ELISA) integrated into microfluidic device" Lab. Chip 10, 92-100 (2010).
- [18] T. Sakata, M. Ihara, I. Makino, Y. Miyahara and H. Ueda "Open sandwich-based immuno-transistor for label-free and non-competitive detection of low molecular weight antigen" Anal. Chem. 81, 7532-7537 (2009).
- [19] 大室 有紀, 上田 宏 “ホタル発光酵素の反応機構を利用したタンパク質間相互作用検出系の開発” バイオサイエンスとインダストリー 72, 113-116 (2014).
- [20] 上田 宏 “免疫反応を測れる光る抗体” 現代化学 518, 32-36 (2014).
教員紹介
上田宏 教授 博士(工学)
| 1986年3月 | 東京大学 工学部化学工学科 卒業 |
|---|---|
| 1991年7月 | 東京大学 大学院工学系研究科 化学工学専攻 博士課程 中退 |
| 1992年12月 | 博士(工学)取得(東京大学) |
| 1991 - 1997年 | 東京大学 工学部 助手 |
|---|---|
| 1997 - 2000年 | 東京大学 大学院工学系研究科 講師 |
| 1998 - 2000年 | 英国ケンブリッジ大学 MRC蛋白質工学研究センター 客員研究員(ラムゼー記念奨学生) |
| 2001 - 2003年 | 東京大学 大学院新領域創成科学研究科 助教授 |
| 2003 - 2013年 | 東京大学 大学院工学系研究科助教授、准教授 |
| 2004 - 2008年 | 科学技術振興機構さきがけ研究者 兼任 |
| 2013 - 2016年 | 東京工業大学 資源化学研究所 教授 |
| 2016年より | 現職 |
| 1995年 | 化学工学会奨励賞 |
|---|---|
| 2002年 | 化学工学会研究賞 |
| 2014年 | 長瀬研究振興賞 |
- 所属学会
- 化学工学会、日本生物工学会、日本生化学会、日本分子生物学会、日本蛋白質科学会、日本化学会バイオテクノロジー部会、American Chemical Society、酵素工学研究会(副会長)、生物化学的測定研究会(副会長)、生物発光化学発光研究会
教員からのメッセージ
- 上田教授より
-
我々生命の主体であるたんぱく質の中には、依然として人間が模倣しがたい高い分子認識能や触媒能を持つものが数多くあります。しかし、天然のたんぱく質は応用の観点からみると必ずしも最適な性質を持っていません。私たちはここに「工学」の醍醐味があると考え、自然の摂理を学びつつ、タンパク質工学、ケミカルバイオロジーの手法を駆使してさまざまな蛋白質とそれを用いた検査・診断・治療法のデザインと創製を試みています。本気ですれば、大抵のことができます。一緒に、未来の診断と治療の世界を変えてみませんか?


※この内容は掲載日時点の情報です。