生命理工学系 News
【研究室紹介】 加納研究室
細胞を見て、知って、創る技術
生命理工学系にはライフサイエンスとテクノロジーに関連した様々な研究室があり、基礎科学と工学分野の研究のみならず、医学や薬学、農学等、幅広い分野で最先端の研究が活発に展開されています。
研究室紹介シリーズでは、ひとつの研究室にスポットを当てて研究テーマや研究成果を紹介。今回は、新しい細胞編集工学構築とそれを用いたiPS細胞研究への応用を目指す、加納研究室です。

生命理工学コース
准教授 加納ふみ![]()
| キーワード | 細胞編集工学、iPS細胞、次世代イメージング画像解析 |
|---|---|
| Webサイト | 加納研究室 |
研究紹介
次世代イメージングと画像解析技術をベースにした全く新しい細胞編集工学の創成
私たちは、細胞膜に一時的に穴を開け、細胞内に分子を導入する方法「セミインタクト細胞リシール法」を開発しています。セミインタクト細胞とは、レンサ球菌毒素ストレプトリジンO (SLO)を細胞膜に作用させて孔を開け、細胞膜を部分的に透過性にした細胞のことです(図)。この細胞に導入できる分子はタンパク質に限らず、核酸、人工合成・修飾された分子、膜不透過性化合物など多岐にわたり、様々な種類の分子の比率を同時にコントロールしながら導入できることが大きな特徴です。さらに細胞の中にあるオルガネラや細胞骨格の構造はほぼそのまま維持された状態で元の細胞質を流出させ、他の細胞や臓器から調製した細胞質と交換し、細胞質環境を改変することもできます。これによりセミインタクト細胞に疾患モデル動物の組織から抽出した細胞質を導入して細胞を病態環境に改変し、その中で生起する「病態環境でのタンパク質・脂質・遺伝子の動態」を解析することができます。私たちの研究室ではこのセミインタクト細胞技術とGFP可視化技術をカップルさせた様々な細胞内現象可視化アッセイを構築し、光学顕微鏡下で生起する小胞輸送過程や細胞周期依存的なオルガネラ形態変化に関わる制御因子の同定とその機能解析を行ってきました。
近年の研究で、セミインタクト細胞にした際に生じる細胞膜上の孔はカルシウム依存的に再封入(リシール)されることがわかりました。この細胞のことを「リシール細胞」と呼びます(図)。驚いたことに、リシール細胞はそのまま培養・継代でき、細胞は分裂し増殖も可能であることがわかりました。よって、導入した細胞質により核内における遺伝子のエピジェネティクスや転写制御機能の改変を誘起させられれば、新規の細胞形質転換法「細胞編集技術」を構築できると考えました。さらにリシール技術により、本方法は膜不透過性のナノプローブや低分子化合物などを導入し生きた細胞での活性が検出可能な、汎用性のある新規細胞内分子導入法としての側面も持つようになりました。
私たちの研究室では、このセミインタクト細胞リシール法による細胞編集技術と次世代イメージングおよびその画像解析技術を最適にカップルさせることにより、ヒトiPS細胞を中心に新規の機能賦活化細胞や遺伝子矯正細胞の作成とその評価技術を開発し、細胞を利用するあらゆる医薬・産業に対して新しい細胞デザインコンセプトと技術を提供し続けたいと考えています。そのため、富士フイルム株式会社や株式会社ニコンなどとの産学連携を推進しながら、東京大学大学院総合文化研究科・村田昌之研究室と連携して「細胞デザイン拠点(Cell-based Design Laboratories: CBDL)」を作り、細胞医薬の基盤技術になりうる新しい細胞編集技術をともに創造していこうとしています。
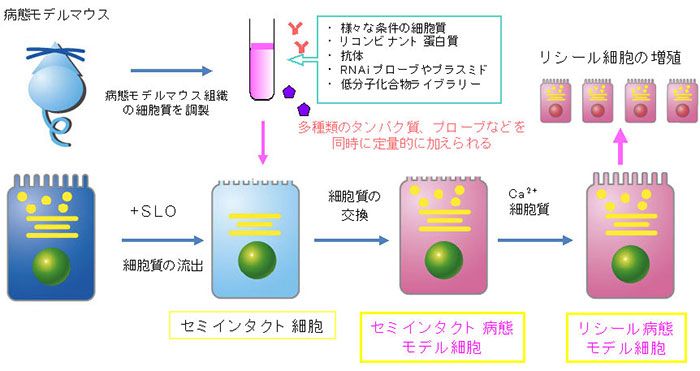
セミインタクト細胞リシール法の概略
研究成果
代表論文
- [1] Matsuto, M., Kano, F., Murata, M. (2015) Reconstitution of the targeting of Rab6A to the Golgi apparatus in semi-intact HeLa cells: A role of BICD2 in stabilizing Rab6A on Golgi membranes and a concerted role of Rab6A/BICD2 interactions in Golgi-to-ER retrograde transport. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1853 (10): 2592-2609. doi:10.1016/j.bbamcr.2015.05.005 .
- [2] Taguchi, Y., Imaoka, K., Kataoka, M., Uda, A., Nakatsu, D., Horii-Okazaki, S., Kunishige, R., Kano, F., Murata, M. (2015) Yip1A, a Novel Host Factor for the Activation of the IRE1 Pathway of the Unfolded Protein Response during Brucella infection. PLOS Pathogens. doi: 10.1371/journal.ppat.1004747 .
- [3] Nakatsu, D., Horiuchi, Y., Kano, F., Noguchi, Y., Sugawara, T., Takamoto, I., Kubota, N., Kadowaki, T., Murata, M. (2015) L-cysteine reversibly inhibits glucose-induced biphasic insulin secretion and ATP production by inactivating PKM2. Proc. Natl. Acad. Sci. USA. 112 (10): E1067-1076. doi: 10.1073/pnas.1417197112.
- [4] Sugawara, T., Kano, F., Murata, M. (2014) Rab2A is a pivotal switch protein that promotes either secretion or ER-associated degradation of (pro)insulin in insulin-secreting cells. Scientific Reports. 4. Article number: 6952. doi:10.1038/srep06952.
- [5] Nakatsu, D., Kano, F., Taguchi, Y., Sugawara, T., Nishizono, T., Nishikawa, K., Oda, Y., Furuse, M., Murata, M. (2014) JNK1/2-dependent phosphorylation of angulin-1/LSR is required for the exclusive localization of angulin-1/LSR and tricellulin at tricellular contacts in EpH4 epithelial sheet. Genes Cells. 19 (7): 565-581. doi: 10.1111/gtc.12158.
- [6] Fujiki, K., Shinoda, A., Kano, F., Sato, R., Shirahige, K., Murata, M. (2013) PPARγ-induced PARylation promotes local DNA demethylation by production of 5-hydroxymethylcytosine. Nature Communications. 4. Article number: 2262. doi:10.1038/ncomms3262.
- [7] Kano, F., Murata, M. (2013) The Semi-Intact Cell System and Methods for Cell Resealing: a Novel Systems Biology Tool to Elucidate Protein Networks with Spatio-Templioral Information. Advances in Systems Biology. 2(1): 6-14.
- [8] Murata, M., Kano, F. (2012) Semi-intact cell system: Application to the nalysis of membrane trafficking beween the endoplasmic reticulum and the Golgi apparatus and of cell cycle-dependent changes in the morphology of these organelles. in Crosstalk and Integration of Membrane Trafficking Pathways. (Weigert, R. ed.) INTECH (ISBN 978-953-51-0515-2)
- [9] Kano, F., Nakatsu, D., Noguchi, Y., Yamamoto, A., Murata, M. (2012) A Resealed-Cell System for Analyzing Pathogenic Intracellular Events: Perturbation of Endocytic Pathways under Diabetic Conditions. PLoS ONE. 7(8):e44127.
- [10] Kano F, Arai T, Matsuto M, Hayashi H, Sato M, and Murata M. (2011). Hydrogen peroxide depletes phosphatidylinositol-3-phosphate from endosomes in a p38 MAPK-dependent manner and perturbs endocytosis. Biochim Biophys Acta. (Molecular Cell Research), 1813(5):784-801.
- [11] 「細胞内生命現象の再構成:病態モデル細胞構築への応用」加納ふみ、村田昌之:生体の科学、65巻5号、494-495. (2014)
- [12] 「セミインタクト細胞リシール法を用いた細胞内イベントの可視化解析―「一細胞生物学」の細胞側ツールとして―」村田昌之、野口誉之、堀内雄太、堀井咲耶、加納ふみ:生物物理、Vol. 54 No.4, 206-209.(2014)
- [13] 「セミインタクト細胞リシール技術を用いた病態モデル細胞創成とその細胞工学的応用」加納ふみ、堀内雄太、野口誉之、村田昌之:
- [14] 「哺乳動物細胞ゴルジ体の細胞周期依存的ディスアッセンブリー」加納ふみ、村田昌之:生体の科学、63巻5号、404-407. (2012)細胞工学、Vol. 31 No.12,1376-1382. 秀潤社(2012)
- [15] 「セミインタクト細胞リシール法を用いた「病態モデル細胞」作製とその疾患研究への応用」村田昌之、加納ふみ:化学と生物、Vol.50(No.7) pp510-517. (2012)
教員紹介
加納ふみ 准教授 博士(理学)
| 1997年 | 京都大学 理学部 卒業 |
|---|---|
| 2002年 | 京都大学 大学院理学研究科 博士後期課程 修了 博士(理学)を取得 |
| 1999年 - 2002年 | 日本学術振興会特別研究員(DC1) |
|---|---|
| 2002年 - 2003年 | 日本学術振興会特別研究員(PD) |
| 2003年 - 2016年 | 東京大学 大学院総合文化研究科 助教 |
| 2007年 - 2011年 | さきがけ研究員兼任(「生命現象と計測」領域) |
| 2011年 - 2014年 | さきがけ研究員兼任(「細胞機能の構成的理解と制御」領域) |
| 2016年より | 現職 |
- 所属学会
- 細胞生物学会、分子生物学会、生物物理学会
教員からのメッセージ
- 加納准教授 より
-
2016年4月に、細胞制御工学研究ユニットで新設された研究室です。ヒトiPS細胞の細胞編集・フェノタイプ解析技術の開発を行っています。よろしくお願い致します。
お問い合わせ先
准教授 加納ふみ
すずかけ台キャンパス S2棟 609号室
E-mail : kano.f.aa@m.titech.ac.jp
※この内容は掲載日時点の情報です。最新の研究内容については研究室サイト![]() をご覧ください。
をご覧ください。