生命理工学系 News
【研究室紹介】 川上研究室
組織・器官のホメオスタシスと再生のメカニズム ―魚類のスーパー治癒能力に学ぶ―
生命理工学系にはライフサイエンスとテクノロジーに関連した様々な研究室があり、基礎科学と工学分野の研究のみならず、医学や薬学、農学等、幅広い分野で最先端の研究が活発に展開されています。
研究室紹介シリーズでは、ひとつの研究室にスポットを当てて研究テーマや研究成果を紹介。今回は、ゼブラフィッシュを使って、組織再生が起こる分子・細胞プロセスの解明を進める、川上研究室です。

生命理工学コース
准教授 川上厚志![]()
| キーワード | ゼブラフィッシュ、組織ホメオスタシス、再生 |
|---|---|
| Webサイト | 川上研究室 |
研究紹介
多細胞生物の体は、発生後も決して一定ではなく、毎日たくさんの細胞が入れ替わり続けます。にもかかわらず、私達が長年の間に全く見分けが付かないほど変貌することはありません。あらゆる多細胞生物は、たくさんの細胞を一つに繋ぎ止め、常に組織や器官を一定に維持、修復し続けています。このような個体を一定に維持しようとする働きを組織ホメオスタシスと呼びます。
ヒトでは生後に臓器や手足などを失うと生涯失われたままとなりますが、生物の種によっては、手足のような大きな組織でも再び生えてきます。脊椎動物の中では魚類がずば抜けて再生力が高く、手足に相当する鰭はもちろん、心臓の一部を切り取っても、脊椎損傷を与えても、さらにレンズや網膜、様々の内臓器官などの体の大きな部分や器官の一部を失っても、元通りに修復して健常な体に戻ることができます。
大規模な組織再生の仕組みはもちろん、組織ホメオスタシスのメカニズムも、実体は全くと言っていいほど解明されておらず、生命科学における残された課題のひとつとなっています。
私達の研究室では、再生の仕組みを解明するために、高度の再生能力を持つゼブラフィッシュを使って、組織再生機構の解明を進めています(図1)。
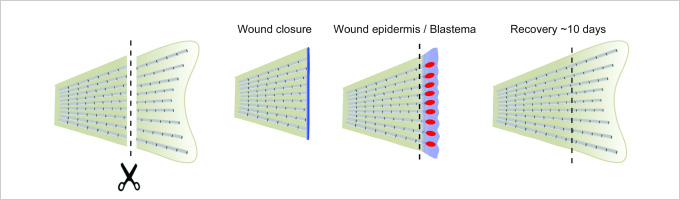
図1. 魚類のひれの再生。傷上皮(Wound epidermis)、再生芽(Blastema)と呼ばれる細胞が形成され、再生芽の増殖と形態形成によって組織は元通りになる。
再生過程で働く分子シグナルの作用メカニズム
組織の再生はどのような分子メカニズムによって起こるのか?私達は、マイクロアレイや高速シーケンサを使ったアプローチ、薬理学的な解析などから、さまざまの遺伝子やシグナルが再生過程を制御する仕組みを調べています。
特に、再生に必要なシグナルが、どの細胞から、どの細胞へ作用するのかということは、再生メカニズムを理解する上で重要です。私達は、トランスジェニック(遺伝子改変)ゼブラフィッシュ、細胞移植などの方法を組み合わせて、再生中の遺伝子やシグナルの働き方を調べています(図2)。
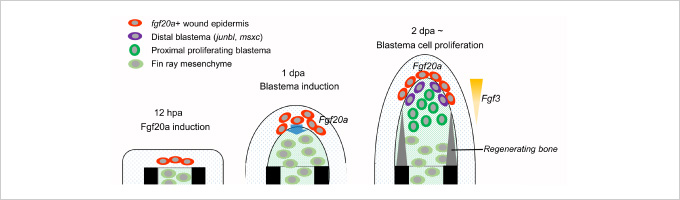
図2. 再生細胞の移植とシグナルの遺伝学的操作からわかったFgfシグナルの作用
再生する細胞の由来と分化運命
再生のメカニズムを知る上で重要なことは、再生した部分の多様な細胞はどうやって作られるのかということです。組織の再生は「幹細胞」のようなエリート細胞によって起こるのか、それとも、多彩な細胞がそれぞれ細胞分裂を再開するのか?この問題に、細胞系譜の解析から取り組んでいます。細胞の系譜を解析する方法は、トランスジェニック動物を使い、細胞に色(蛍光)をつけ、それを長期に観察することで行います。
また、もっとエレガントな方法として、細胞内でのゲノムDNAの組み換えを使って、狙った細胞を蛍光ラベルする方法があります。この方法では、子孫細胞が永遠にラベルでき、1つの細胞の生涯にわたる細胞系譜を調べることができます。このような方法で、私達は、再生上皮や再生芽の起源と細胞運命の解明を進めています。
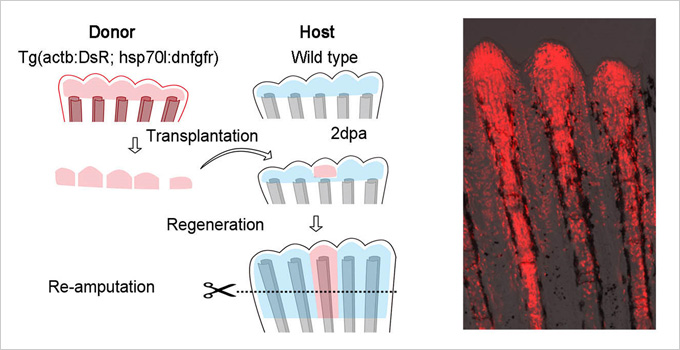
図3. 再生芽移植による蛍光ラベルされた細胞の追跡
組織再生への遺伝学的アプローチ
再生といえば、成体を使う物というのがアタリマエでしたが、私達は、発生が終わったばかりの体長1 mmくらいの稚魚を使って、再生過程の解析を行っています(図4)。ほ乳類と違って、魚類は卵黄を持っているおかげで、たとえ心臓や血管がなくても、10日くらい生存して、発生・成長を続けることができます。このような系を使って解析することで、ゼブラフィッシュで作製された数千もの変異体を利用して、ある遺伝子の変異が再生に与える影響を調べることができます。
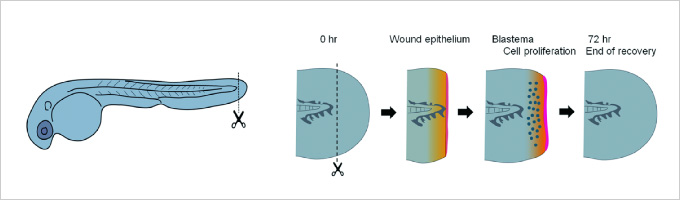
図4. 発生直後の個体の組織再生も成体組織の再生とほとんど変わらない。
私達は、造血系細胞がない変異体で、再生が始まろうとするとアポトーシスを起こしてしまう変異体を発見しました。この変異体での再生過程を詳しく解析した結果、傷害によって再生へと活性化された細胞は、造血細胞から何かの拡散性の因子を受け取らないと死んでしまうことが明らかになりました(図5)。現在さらに、再生細胞の生存を制御する仕組みについて研究を進めています。
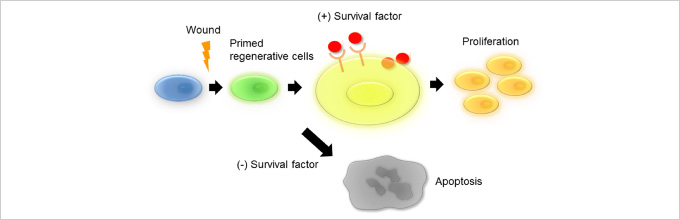
図5. 再生細胞の生存・増殖には、造血細胞に由来する生存因子を必要とする
研究成果
- 代表論文
- [1] Shibata, E., Yokota, Y., Horita, N., Kudo, A., Abe, G., Kawakami, K. and Kawakami, A. (2016) Fgf signalling controls diverse aspects of finregeneration. Development 143, 2920-2929. Doi:10.1242/dev.140699
Fgfシグナルの再生における機能を解明した。傷上皮で活性化されるFgf20aが再生芽の形成を誘導し、誘導された再生芽に発現するFgf3などが細胞の増殖を指令することを解明した。
- [2] Hasegawa, T., Nakajima, T., Ishida, T. Kudo, A. and Kawakami, A. (2015) A diffusible signal derived from hematopoietic cells supports 3the survival and proliferation of regenerative cells during zebrafish fin fold regeneration. Developmental Biology 399, 80-90.
造血細胞を欠損する変異体では、再生へと活性化された再生細胞が、増殖する代わりに細胞死を起こすことを発見した。体内の拡散性因子が、再生細胞の生存に必要なことを示した。
- [3] Yoshinari, N., Ando, K., Kudo, A., Kinoshita, M. and Kawakami, A. (2012) Colored medaka and zebrafish: Transgenics with ubiquitous andstrong transgene expression driven by the medakab-actin promoter. Development Growth & Differentiation 54, 818-828.
細胞系譜の解析を可能にするために、全身すべての細胞でDsRedを発現し、Cre組み換えで永続的にEGFP発現に変換出来るトランスジェニック系統を開発した。
- [4] 川上厚志 (2010) 「増殖か、死か」:組織再生における増殖細胞の生存戦略、実験医学(増刊) 細胞死研究総集編28(7),159-166. 再生組織における細胞増殖とアポトーシスの制御機構について、研究の最新の知見などもまとめた総説。
- [5] Ishida, T., Nakajima, T., Kudo, A. and Kawakami, A. (2010) Phosphorylation of Junb family proteins by the Jun N-terminal kinasesupports tissue regeneration in zebrafish. Developmental Biology 340, 468-479.
組織再生において、Junb, Junblと上流のキナーゼであるJNKが必須の役割を果たすことを解明した。
- [6] (REVIEW) Kawakami, A. (2010) Stem cell system in tissue regeneration in fish. Development Growth & Differentiation 52, 77-87.
組織再生における幹細胞の関与などについて論じた総説。
- [7] Yoshinari, N., Ishida, T., Kudo, A., and Kawakami, A. (2009) Gene expression and functional analysis of zebrafish larval fin foldregeneration. Developmental Biology 325, 71-81.
マイクロアレイ解析による再生関連遺伝子の同定と、変異体、阻害剤などを用いた解析。再生組織は多様な細胞からなることを示した。
教員紹介
川上厚志 准教授 理学博士
名古屋大学大学院理学研究科生物学専攻修了、学振研究員、名古屋大学助手、ニューヨーク大学医学部スカボール分子生物医学研究所ポスドク、遺伝学研究所および東大助手を経て、2005年より現職。
教員からのメッセージ
- 川上准教授より
-
私が学生時代は、携帯はもちろん、固定電話も少数派、パソコンが一般的になる少し前だったので、たいていの貧乏学生は暇をもてあましていました。
そのおかげで、ラボで実験するしかありませんでしたが、パッとしない青春のいっぽうで、研究に没頭し、ものを考える時間はたっぷりありました。
いまは、どうしてこう忙しそうになってしまったのでしょうか?じっくりとものを見たり、考えたりすることに贅沢に時間をかけられる時期を大事にして、自分独自の、ひととは違う何かを見つけて伸ばしてほしい。
お問い合わせ先
准教授 川上厚志
すずかけ台キャンパスB1棟602号室
E-mail : atkawaka@bio.titech.ac.jp
※この内容は掲載日時点の情報です。最新の研究内容については研究室サイト![]() をご覧ください。
をご覧ください。